谈初中化学试题中的“数据”存在的几个问题
2022-05-30田长明
田长明
摘要:初中化学试题命制中常常会涉及一些数据,这些数据必须客观和真实,但有些试题的数据或残缺不全、或主观臆造、或不足为据、或来源不实。这就需要教师在教学过程中及时发现问题,明辨真伪,去伪存真。
关键词:数据;传感器:氧气含量;硫酸铜:稀硫酸质量分数;氢氧化钙
文章编号:1008-0546( 2022 )11x-0070-03
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.11x.018
化学是一门以实验为基础的自然科学,而定量实验又是中学化学实验的重要组成部分,这就要求教师在课堂教学中要培养学生分析和处理数据的能力。
化学试题中经常会涉及一些数据。按理这些数据应该是真实可信的,应该是客观、真实和经得起实践与理论检验的。但笔者在教学中发现,一些试题的数据存在着问题,主要有下列四种情形:
一、数据残缺不全,图表绘制粗枝大叶
案例1是某市初三化学测试的一道选择题。
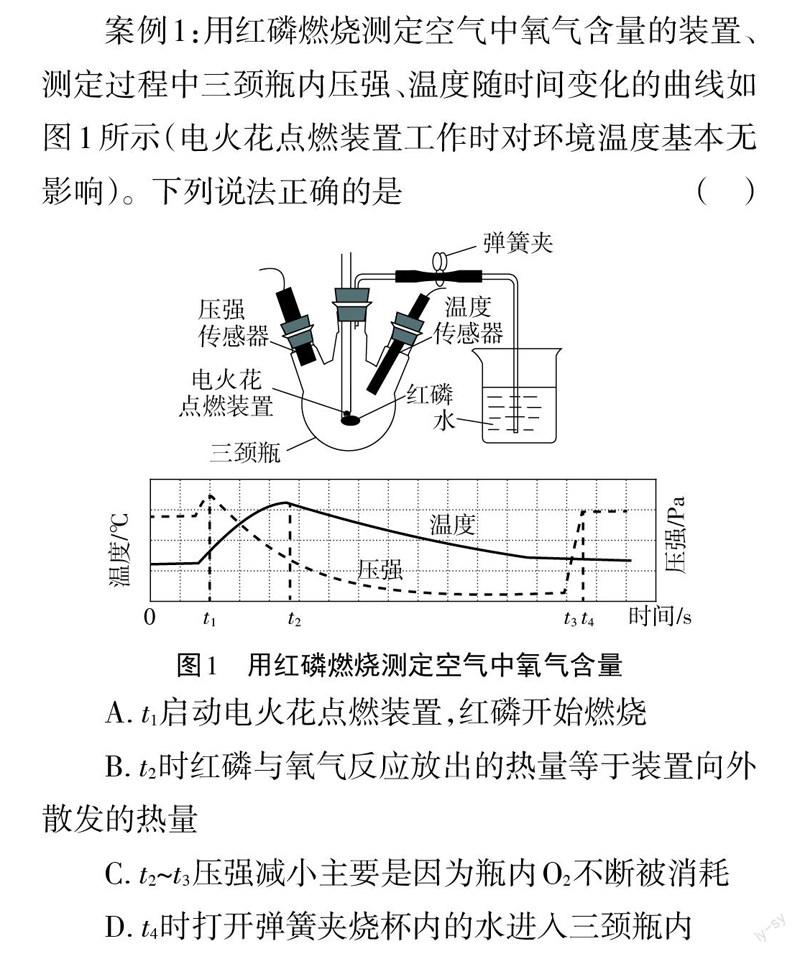
案例1:用红磷燃烧测定空气中氧气含量的装置、测定过程中三颈瓶内压强、温度随时间变化的曲线如图1所示(电火花点燃装置工作时对环境温度基本无影响]。下列说法正确的是
( )
A.t1启动电火花点燃装置,红磷开始燃烧
B.t2时红磷与氧气反应放出的热量等于装置向外散发的热量
C.t2-t3压强减小主要是因为瓶内O:不断被消耗
D.t4时打开弹簧夹烧杯内的水进入三颈瓶内
对于这道题,笔者有下列2点疑惑:
疑惑1:图1上只有温度、压强和时间的单位及0点,但具体的测量数据1个都没有,就让人怀疑这样的图表是不是真实的?
疑惑2:反应后剩余的气体主要是氮气,氮气约占空气体积的4/5,虽然图表上没有数据,但可以看出反应后三颈瓶内压强趋近0,这科学吗?
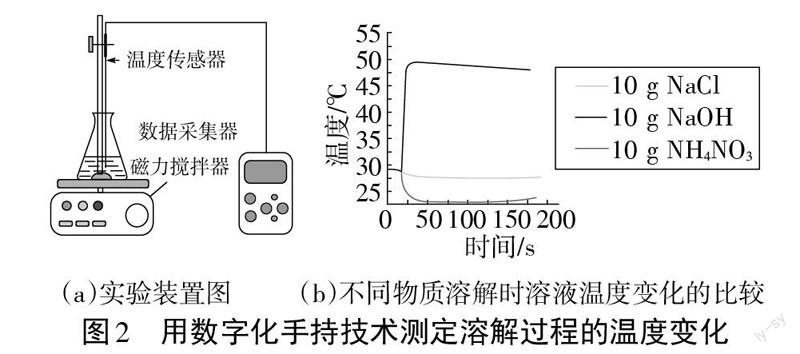
下面是粤教版九年级化学教材中利用传感器测定溶液的温度变化,图表上的数据就非常完整和规范。
随着科学技术的进步,中学化学实验也在引进现代化的测试方法,例如用数字化手持技术可以测定物质溶解于水时溶液的温度变化。
用量筒向3个同规格的锥形瓶中各加入100 mL水再分别加进10 gNH4NO3、NaCl和NaOH固体,开动磁力搅拌器、数据采集器动态采集溶液温度随时间变化的数据(见图2)。[1]
二、数据主观臆造,试题前后自相矛盾
案例2是某出版社九年级化学课时提优计划作业本中的一道题:
案例2:现有氧化铁、氧化铜组成的混合物80 g,其中氧元素的质量分数24%,加入150 g稀硫酸恰好完全反应,则该稀硫酸中氢元素的质量分数为 ( )
解析:氧化铁、氧化铜与稀硫酸的反应的实质是稀硫酸中的氢离子与氧化铁、氧化铜中的氧离子结合生成水。
根据题意,氧化铁、氧化铜中氧元素的质量为:m(O)=80x24%=19.2 g
这道选题对于九年级的学生来说难度偏大,很多学生忽略了水中氢元素的质量,从而误选了D,而笔者认为这道题不是难度问题,而是题目的命制是否是科学的?
疑惑1:硫酸铜和硫酸铁溶液都是酸性的,氧化铁、氧化铜和稀硫酸能否恰好完全反应?
疑惑2:通过计算不难得出该硫酸溶液的质量分数为78.4%,78.4%的硫酸溶液是不是稀硫酸?
为了解决疑惑1,笔者做了下列两则实验:
实验1:在3个烧杯中分别放入一定量氧化铜粉末(过量),分别在其中加入三份酸度不同的稀硫酸,用玻璃棒不断搅拌,充分反应后,用酸度计测定其溶液的pH(见图3)。
实验2:在3个烧杯中分别加入一定量氧化铁粉末(过量),分别在其中加入酸度不同的稀硫酸,用玻璃棒不断搅拌,充分反应后,用酸度计测定其溶液的pH(见图4)。
对比实验的结果见表1。
实验结果表明:氧化铜与稀硫酸反应,三个烧杯中都有氧化铜剩余,反应后生成硫酸铜溶液的质量分数不同(颜色深浅不同),反应后溶液都是酸性的,但酸度不同,生成的硫酸铜溶液质量分数越大,溶液的酸度越高。而氧化铁与三种酸度的稀硫酸几乎不反应,这就说明了氧化铁、氧化铜和稀硫酸不可能恰好完全反应。
疑惑2是浓硫酸和稀硫酸如何界定的问题,一般认为浓硫酸是指溶质质量分数大于或等于70%的硫酸溶液。即物质的量浓度大于11.43 mol/L硫酸为浓硫酸。而稀硫酸是指溶质质量分数小于或等于70%的硫酸的水溶液。该题中硫酸溶液的质量分数经计算为78.4%,应该不是稀硫酸,而是浓硫酸。
三、数据不足为据,化学原理大相径庭
案例3是九年级化学计算题中的一道高频题。
案例3:为了测定一瓶硫酸铜溶液中溶质的质量分数,取出50 g该溶液,向其中逐滴加入质量分数为16%的氢氧化钠溶液,反应过程生成沉淀的质量与所用氢氧化钠溶液的质量关系如图5所示。
请分析并进行计算:
N点对应的溶液中溶质为▲。
计算此硫酸铜溶液中溶质的质量分数 ▲。 解析:在硫酸铜溶液中滴加氢氧化钠溶液会生成氫氧化铜沉淀,当加入25 g氢氧化钠溶液时,沉淀质量达到最大,硫酸铜和氢氧化钠恰好完全反应,继续加氢氧化钠溶液,氢氧化钠会过量,因此N点对应的溶液中溶质为硫酸钠和氢氧化钠。
这道题数据好像没什么问题,但笔者有点疑惑。在硫酸铜溶液中加入氢氧化钠溶液,生成的沉淀是不是氢氧化铜?
为了解决这两个疑惑,笔者做了下列二则实验:
实验3:在试管中加入2 mLNaOH溶液,然后在NaOH溶液中滴加硫酸铜溶液,观察到有蓝色絮状沉淀生成,然后将反应后的悬浊液在酒精灯上加热,观察到有黑色沉淀生成(见图6)。
实验4:在试管中加入2 mLCuSO4溶液,然后在CuSO4溶液中滴加NaOH溶液,观察到有绿色沉淀生成,然后将反应后的悬浊液在酒精灯上加热,观察到无明显变化(见图7)。
实验3说明在氢氧化钠溶液中滴加硫酸铜溶液生成的是氢氧化铜沉淀,而实验4说明了在硫酸铜溶液中滴加氢氧化钠溶液,生成的沉淀不是氢氧化铜,而是碱式硫酸铜。碱式硫酸铜的成分比较复杂,无法计算出硫酸铜溶液的质量分数。
四、数据来源不实,实验设计荒诞
案例4是某市2021年的中考化学试题。
案例4:将含有CH4和H2的混合气体6 g完全燃烧,把产生的气体通入澄清石灰水中,得到20 g沉淀。则原混合气体中CH4和H:的质量比為
( )
A. 2:3
B.3:10
C.8:1
D.8:7
解析:二氧化碳通入澄清石灰水中,产生20 g碳酸钙沉淀,根据化学反应前后元素的质量不变,可知CH。中碳元素的质量为2.4 g,则CH4的质量为3.2 g,H2的质量为2.8 g,m(CH4):m(H2)=3.2 g:2.8 g=8:7,正确选项为D
笔者认为该题的实验设计首先是不切实际的,其一氢氧化钙微溶于水,石灰水吸收二氧化碳的量非常少,实验室一般用氢氧化钠浓溶液来吸收CO2。其二CO2通过石灰水不可能全部被吸收,大多数来不及反应就逸散到空气中,即使用20%的氢氧化钠溶液吸收CO2,吸收率也只有25%左右。实验室通常通过测量CO2的体积来求CO2的质量,通常采用图8的装置,用这样测量的误差要小很多。
另外笔者认为试题中的数据真实性值得推敲,假设CO2全部被石灰水吸收,产生20 g碳酸钙沉淀,需要石灰水的体积太大。我们不妨计算一下:
查阅资料可知:已知20 ℃时氢氧化钙溶解度为0.165 g。
因饱和石灰水是稀溶液,可设其密度为1.00 g.mL-1,8984.5 g澄清石灰水体积约为9L。在实验室要寻找大于9L的反应器是很难的,目前实验室配备最大的塑料烧杯也就5000 mL。
产生20 g碳酸钙,说明燃烧产生的CO2是0.2 mol,0.2 mol CO2气体在标况下的体积是4.48 L,如果用图8装置来测二氧化碳的体积,至少需要规格为SL的量筒,而实验室最大的量筒规格是1000 mL。
综上2点说明该题的实验设计和实验数据都是荒诞的。
“世界的本质就是数据”,[2]这是英国人维克托在《大数据时代》中提出的观点,数据是化学研究的基石,对待数据,教师的态度应该是认真的。
参考文献
[1] 江琳才,义务教育教科书(化学九年级下册)[M].广州:广东教育出版社.2014:196.
[2] [英]维克托·迈尔·舍恩伯格,[英]肯尼思·库克耶.大数据时代(M).杭州:浙江人民出版社,2012.
