基于生活问题解决的复习课教学设计
2022-05-30陈洲
陈洲
摘要:以“质量守恒定律的应用”复习课为例,基于主题情境“钙片的选择”,分析了基于生活问题解决的复习课教学设计的结构,分享了具体的课例和设计意图,从以生活问题推动课堂学习进程、以实验探究分析解决生活问题、以生活问题解决提升综合素养等方面进行了反思与再认识。关键词:生活问题解决;质量守恒定律的应用;钙片的选择;主题情境;数字化实验
文章编号:1008-0546(2022)11-0058-05
中图分类号:G632.41
文献标识码:Bdoi:10.3969/j.issn.1008-0546.2022.11.013
化学作为一门中心的、实用的学科,与实际生活有着紧密的联系。作为九年级化学的启蒙课,学生对于化学的已有了解基本来源于生活——如化工企业、商业广告和一些网络视频,了解的内容也非常有限,更多的只能被一些易于观察的现象、危险刺激的反应(例如:爆炸、腐蚀等)所吸引。因此,如果完全脱离生活而展开化学的学科内容,就会让学生产生一定的隔阂,造成学生学习化学的热情下降。课堂学习素材的选择和设计离学生的生活距离越远,学生的学习困难就越大。基于学生生活经验展开学习并解决实际问题显得尤为重要。
一、基于生活问题解决的复习课教学设计的结构
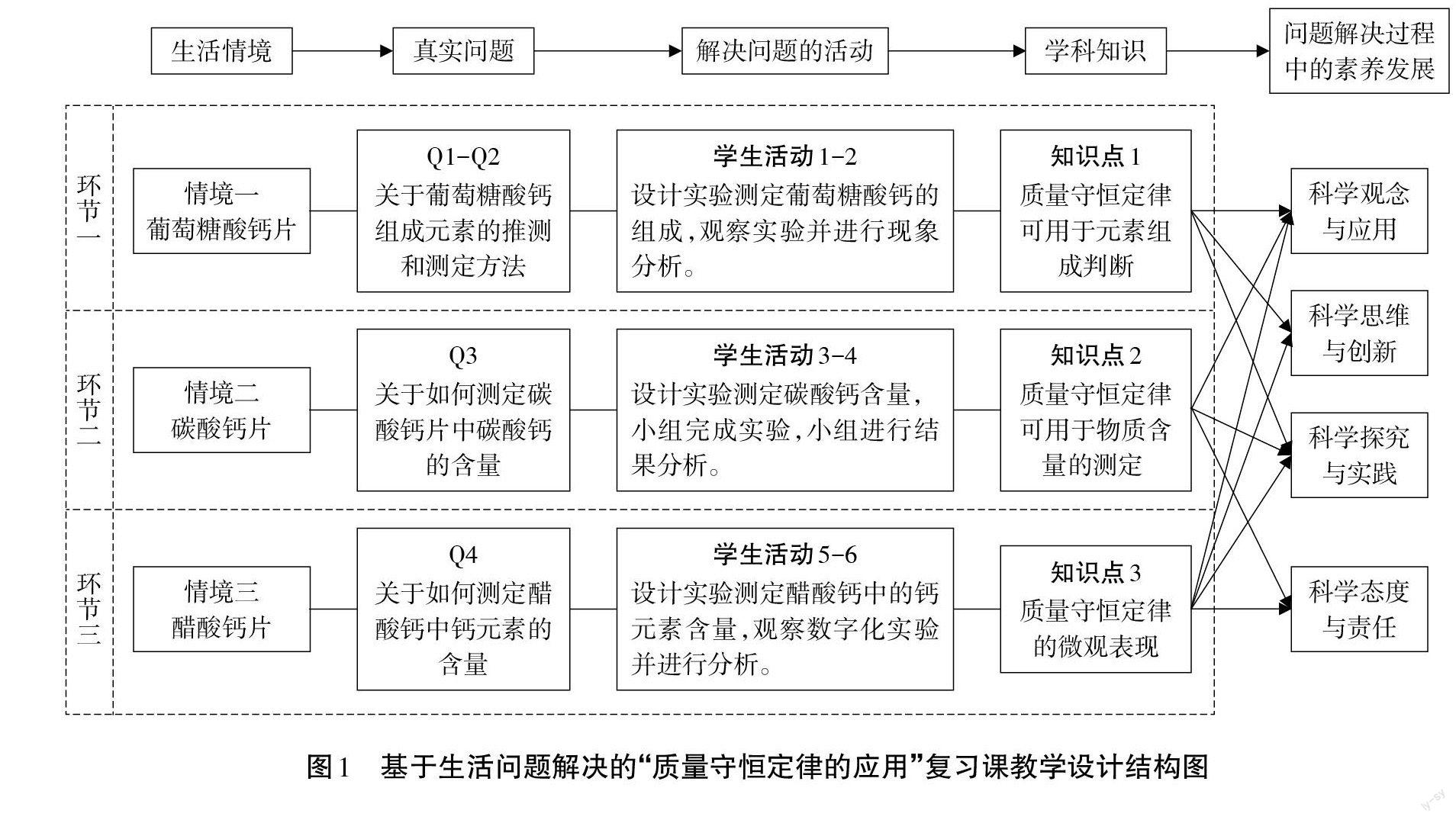
基于生活问题解决的复习课教学设计首先要有合适的生活情境,在生活情境中产生真实的化学问题,其次要设计合理的学生多元活动来解决问题,从而在应用已有学科知识的过程中巩固知识,促进素养的发展。
质量守恒定律是九年级化学学习的一个比较重要的定律,在初中化学沪教版教材中起着承上启下的作用。化学老师无法指导学生解决所有的问题,但可以通过质量守恒定律应用的复习,培养学生自己去进行化学问题的分析和实践。
已有的关于质量守恒定律的复习课中,大多数都将目光集中在质量守恒定律的概念复习和习题讲解上,在内容上似乎与新授课有所不同,但对学生的要求并没有改变,仍然是会用质量守恒定律进行计算而已,并没有起到拓展和提升的作用,也没有充分体现出质量守恒定律在解决化学问题中的作用,更没有体现出在解决生活问题中的作用。
“质量守恒定律的应用”[1]复习一课,笔者以生活中“钙片选择的烦恼”为主线,通过购买钙片过程中产生的困惑引发出具體的化学问题,通过实验探究、分组合作、交流讨论等学习活动,应用质量守恒定律来解决这些实际问题,深化对质量守恒定律应用的理解,其教学设计结构如图1所示。
二、基于生活问题解决的复习课教学的课例分享
环节一:认识葡萄糖酸钙片
【情境1】老师去药店购买钙片,发现钙片种类很多,老师应该购买哪一种钙片呢?
【资料卡1】葡萄糖酸钙片中有效成分为葡萄糖酸钙(Mr=430),辅料中含有蔗糖、柠檬酸等成分。
【问题1】阅读资料卡1,思考:葡萄糖酸钙片中除了Ca元素,还可能有哪些元素?请设计实验证明。
【学生活动1】小组讨论,设计实验,交流评价。
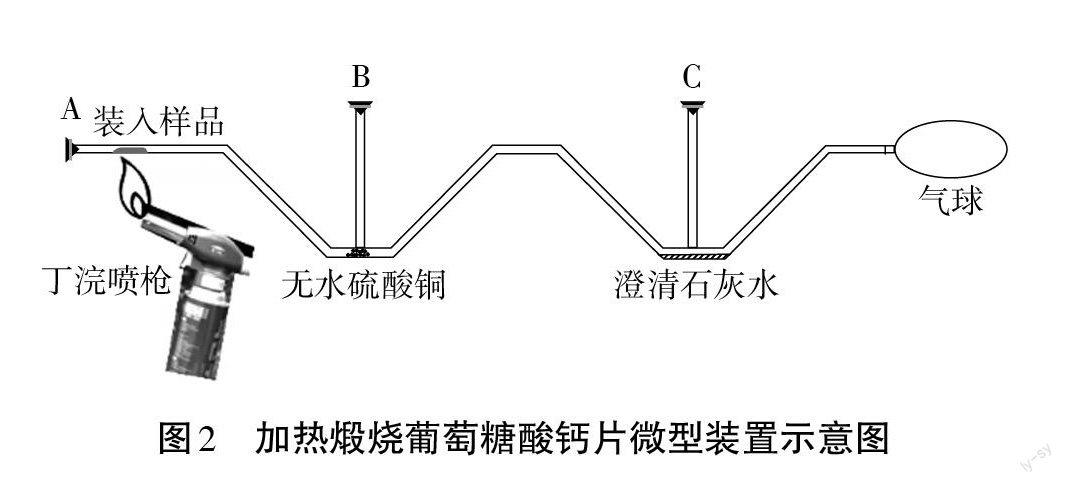
【实验1】(教师演示,验证学生的猜想)
实验用品:自制W型管、气球、丁烷喷枪、橡胶帽、铁架台(带铁夹)、葡萄糖酸钙片、无水硫酸铜、澄清石灰水。
实验装置:见图2。
实验步骤:从A口加入2片葡萄糖酸钙片,在B处加入无水硫酸铜,C处加入澄清石灰水,用橡皮帽塞住A、B、C三个口,然后用丁烷喷枪对准样品处加强热,观察B处和C处的现象。
实验现象:无水硫酸铜变蓝,澄清石灰水变浑浊。
实验结论:葡萄糖酸钙片中除含有钙元素外,还含有碳元素和氢元素。
【归纳总结1】判断葡萄糖酸钙片中是否含有碳元素和氢元素,依据是化学反应前后元素的种类不变,质量守恒定律应用1是用于分析物质的元素组成。
设计意图:本环节的设计目的是通过认识生活中的葡萄糖酸钙片的元素组成,巩固质量守恒定律的一个应用——分析物质的元素组成。初中阶段对有机物的组成研究仅仅只需要达到定性层面,而无需达到定量层面。通过如图1所示教师设计的创新微型装置,让学生根据现象进行证据推理,从而确定氢元素和碳元素。至于是否含有氧元素,学生根据定性的方式无法实现,需要采用定量方式,从而为第二环节埋下伏笔。
环节二:分析碳酸钙片
【情境2】观看视频:葡萄糖酸钙的含钙量并不高,售货员推荐碳酸钙片,我是否应该听从售货员的建议呢?
【资料卡2】1.碳酸钙片的主要成分为碳酸钙,辅料为甘露醇、硬脂酸镁、阿斯巴坦、香精等。2.辅料不与盐酸反应产生二氧化碳。
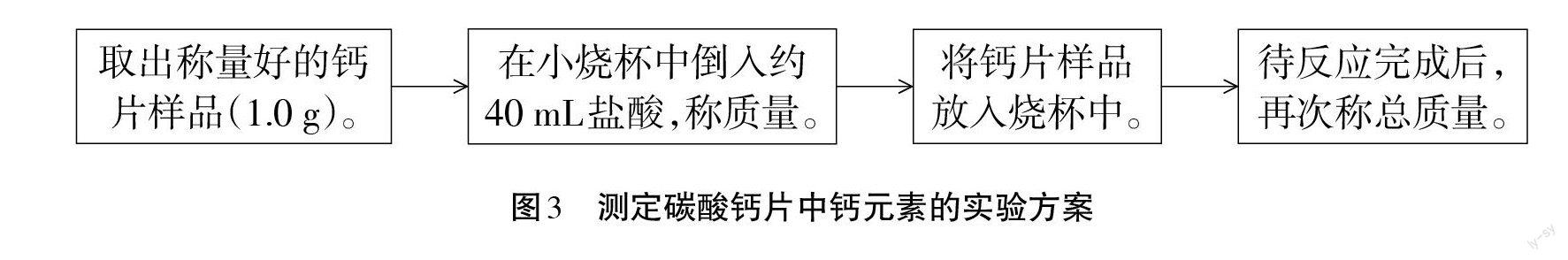
【问题2】根据资料,如何测定碳酸钙片中钙元素的质量分数?请小组讨论并设计实验。
【学生活动2】学生自主设计,进行方案的分析与讨论,并形成共识(具体见图3)。
【资料卡3】实验小贴士:1.实验时注意实验操作规范和安全。2.注意不能让盐酸飞溅。3.放人样品后请先将烧杯取下,轻轻晃动,促进完全反应。4.反应过程中注意电子秤读数变化,记录好实验数据,及时进行数据处理。
【实验2】以小组为单位,用家用厨房高精度电子秤合作完成上述实验方案,并记录数据。(A组同学数据如下:取用钙片质量1.00 g,盐酸和烧杯总质量78.54 g,反应后总质量79.26 g。)
【问题3】为什么反应后质量会减轻?(追问:反应放出的二氧化碳气体的质量是多少?你的依据是什么?)
【学生活动3】(交流与讨论)反应后生成的CO2逸出反应装置,使得质量减轻;产生CO2的质量为78.54 g+1.00 g-79.26 g=0.28 g;依据是参加反应的反应物质量总和等于生成物质量总和。
【学生活动4】根据实验所得数据,计算所取碳酸钙片中钙元素的质量分数。以A组同学数据计算如下:
解:设碳酸钙的质量为X。
则钙元素的质量为0.63 gx40%=0.254 g,钙元素的含量为0.254g/1.0 gx100%=25.4%。
答:所取碳酸钙片中钙元素的质量分数为25.4%。
【问题4】(投影碳酸钙片标签)标签上标注的每片碳酸钙片含钙500 mg,实际测得碳酸钙片质量为1.8g,根据标签可计算得钙元素质量分数=0.5 g/1.8 gx100%=27.8%,与你所测定的结果略有差异,请分析可能的原因。
【学生活动5】(交流与讨论)1.可能反应没有完全;2.可能带出了水蒸气3.称量有误差……。
【归纳总结2】质量守恒定律可用于解释某些化学反应现象,定量测定物质的成分。
设计意图:本环节的设计是围绕质量守恒定律的另外两个应用:解释化学反应现象和定量测定物质的成分展开的。通过葡萄糖酸钙的含钙量并不高,售货员推荐碳酸钙片,自然而然引出实际问题:计算碳酸钙片中的含钙量。通过对反应后质量减轻原因的分析,应用质量守恒定律解释化学反应现象。基于已有的经验,根据碳酸钙片和稀盐酸发生反应产生二氧化碳的量计算得出碳酸钙片中碳酸钙的质量,从而测定碳酸钙片中钙元素的质量分数。本环节将质量守恒定律的应用渗透在整个过程中,培养了学生的方案设计能力、实验操作能力、综合计算能力及应用化学知识解决实际问题的能力。
环节三:探究醋酸钙补钙剂
【情境3】观看视频:老师的妈说老年人肠胃不好,不能用碳酸钙片进行补钙,医生建议用醋酸钙颗粒进行补钙。
【问题5】碳酸钙片和醋酸钙颗粒的含钙量有何区别?老师带来1袋醋酸钙颗粒的标签上注明含钙元素50.6 mg,请阅读资料卡4,设计实验,测定醋酸钙中钙元素的质量。
【资料卡4】1.相比于碳酸钙片,食用醋酸钙补钙剂会减小对胃肠壁的冲击。醋酸钙补钙剂中主要成分为醋酸钙,辅料为蔗糖,蔗糖中不含Ca2+。2.醋酸钙是一种可溶性的钙盐,用Ca(Ac)2表示,相对分子质量为158。3.醋酸钙溶于水产生Ac-和Ca2+。4.醋酸钙与盐酸反应不生成CO2。
【学生活动6】分组讨论,设计实验方案。小组代表汇报讨论结果,进行班级范围内的集体讨论和分析。
【归纳总结3】(1)定量测定物质成分的视角1:宏观上应用元素守恒,微观上应用原子守恒。例如:宏观上碳酸钙与二氧化碳中的碳元素守恒,微观上抓住的是碳原子数守恒。(2)定量测定物质成分的视角2:转化法,即转化为便于测量的物质。例如:醋酸钙无法转化为二氧化碳,可以在醋酸钙溶液中加入碳酸钠溶液,通过测定恰好完全反应时碳酸钠的质量,计算得到醋酸钙的质量,即可求得钙元素的质量。
【教师】什么时候是反应恰好完全进行呢?上面一个实验,不再产生气泡时即为反应恰好完全进行,本实验不再产生沉淀时即为反应恰好完全进行,而不再产生沉淀用肉眼难以直接观察,我们可以借助数字化实验来完成。
【实验3】教师演示数字化实验。
实验药品:光电门传感器、滴数传感器、电导率传感器、数据采集器、电脑及软件、10%的碳酸钠溶液、醋酸钙补钙剂。
实验装置:见图4。
实验步骤:按图4所示连接好装置,设置好横坐标、采集频率、采集时间。点击电脑屏幕上的“开始采集”按钮,打开滴数传感器活塞,把碳酸钠溶液滴人烧杯中,观察电脑屏幕上的曲线变化(见图5)。
实验结果:
【问题6】根据实验结果,如何确定何时恰好完全反应?此时,消耗10%碳酸钠溶液(密度为1.1 g/mL)的体积为多少mL?质量为多少g?
【学生活动7】(教师与学生共同分析与讨论)相同温度下,溶液电导率与溶液中的离子浓度和带电离子的种类相关。反应未恰好完全进行时,溶液中离子浓度逐渐增大(滴人的碳酸钠溶液未完全与醋酸钙溶液反应),反应恰好完全进行后(即沉淀已完全形成后),再滴人碳酸钠溶液,电导率即开始趋于稳定。通过溶液电导率的变化趋势进行判断,当电导率刚要趋于稳定时,即为恰好完全反应时。由图5可知,在滴人碳酸钠溶液1.3 mL时,碳酸钠与醋酸钙恰好完全反应,可以由此计算消耗溶质碳酸钠的质量为10 %x1.1 g/mLxl.3 mL=0.143 g。
【问题7】请计算该包醋酸钙补钙剂中钙元素的质量。
【学生活動8】进行计算。
解:设该醋酸钙颗粒中钙元素质量为x。
根据反应方程式:
Ca(Ac)2+Na2CO3=CaCO3↓+2NaAc可得如下关系式:
计算得到钙元素的质量为53.9 mg,与包装袋上所标注的结果相差不大。
【问题8】市场上有不同的补钙剂,为什么不只生产含钙量高的补钙剂呢?生活中我们如何选择合适的钙片?
【资料卡5】见表1。
【学生活动9】(交流与讨论)对于不同的人群,需要不同类型的补钙剂,就像今天我们要测定不同钙片中钙元素的含量,要选择不同的方案一样,我们要根据实际情况选择最优的方案。
设计意图:本环节的设计目的是从转化法及微观视角巩固质量守恒定律的应用。通过数字化实验,将肉眼难以直接观察的现象通过图像进行表征。同时,注重从宏观走向微观,关注微粒之间的联系,体现质量守恒定律的微观解释——反应前后原子的种类、质量和个数不发生改变在解决实际问题中的作用。
【课堂总结】(边总结边形成板书,见图6)今天这节课,我们通过研究钙片的选择,复习了质量守恒定律的应用。质量守恒定律可以帮助我们质疑实验现象,量化研究过程,守住学科原则以及衡量方案优劣。希望同学们在今后的学习生涯中,也能够质疑眼前的困难,量化眼前困难的难度,守住自己的优势和阳光的心态,用恒心去战胜学习路上的困难!
三、基于生活问题解决的复习课教学的思考与再认识
1.以生活问题推动课堂学习进程
生活问题贴近学生实际,将生活问题渗透在整个学习进程中能有效地激发学生充分参与。选择钙片来补钙是大家熟知的生活问题,在选择钙片时人们通常会考虑以下几个问题:①钙片中除了钙元素还含有哪些元素,这些元素是否会对人体不利?②钙片的含钙量是否足够?③钙片是否易于吸收?④钙片的售价是否让人可以接受?这些问题学生是可以考虑到的,或许是已经存在他们脑海中的。通过对这些问题的梳理,可以形成推动课堂前进的内在问题串。钙片中是否含有其他元素——需要测定钙片中的元素组成;钙片的含量是否足够——需要测定物质的成分;钙片是否易于吸收——需要根据钙片不同的性质来进行判断;钙片的售价是否可以让人接受——需要对比不同钙片的含钙量、优缺点等特点。因此,根据这些内在联系的问题先后顺序,逐步展开来串联课堂,就让课堂学习的进程变得无比顺畅。
2.以实验探究分析解决生活问题
实验探究活动是解决生活问题的有效途径。课堂中教师将生活中常见补钙剂直接应用于实验,拉近了化学与实际生活间的距离。通过教师设计的微型实验装置,探究和分析葡萄糖酸钙片中的元素组成;通过课堂分组实验,学生亲身体验碳酸钙片中钙元素含量的测定,并对自己小组产生的误差进行分析;通过数字化实验的观察与分析,研究醋酸钙颗粒中钙元素的含量,并与碳酸钙片进行对比。整节课的实验活动由定性研究走向定量研究,由传统实验拓展到创新实验、数字化实验,将质量守恒定律与设计实验、完成实验、推导计算的过程紧密联系,反映了质量守恒定律在解决实际问题中的应用比较广泛。从课堂实践来看,本节课每一个课堂实验既是课堂所需,也是实际探究所需。在化学学科启蒙学习阶段,要充分让学生体会到化学需要靠实验解决生活问题。
3.以生活问题解决提升综合素养
解决实际问题,需要的知识不是单一的,发展的学生能力素养也是综合的。本节课中需要解决的是钙片的选择问题,复习的主题是质量守恒定律的应用,在实际学习过程中,学生需要用到不同層次、不同维度的知识。在判断葡萄糖酸钙的元素组成过程中,学生需要选择合适的样品检验水和二氧化碳的产生;在测定碳酸钙的含量过程中,学生需要设计合适的探究过程以及合适的药品与碳酸钙反应进行测定;在测定醋酸钙中钙元素的含量过程中,学生需要根据醋酸钙的知识,搜索已学物质中与其类似的物质,然后再寻找合适的试剂与醋酸钙反应并进行测定,整个学习过程就是综合运用知识的能力提升的过程,证据推理、模型认知、实验探究与创新意识等素养在课堂学习过程中有机地得到渗透。
参考文献
[1]王祖浩.义务教育教科书·化学(九年级上册)[M].上海:上海教育出版社,2012:10.
