血清Flt3L和Gas6水平对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染预测价值分析
2022-05-30陈瑜陶石胡敏符才波
陈瑜 陶石 胡敏 符才波
非霍奇金淋巴肿瘤是一类具有高度异质性的淋巴细胞增生疾病,按其来源分为B 细胞、T 细胞和NK 细胞淋巴瘤,目前发病率在不同年龄阶段呈上升趋势[1]。利妥昔单抗化疗是临床用于治疗非霍奇金淋巴瘤的重要手段,但因利妥昔单抗具有免疫抑制的作用,患者受其影响,容易导致免疫力下降,继而引发肺部感染,不利于预后。肿瘤合并感染是非霍奇金淋巴瘤发生死亡的原因之一,因此,早期预测肺部感染的发生,并给予针对性治疗,可以减少非霍奇金淋巴瘤患者肺部感染发生率,进一步减少死亡率。相关研究显示,FMS 样酪氨酸激酶3 配体(Flt3 ligand,Flt3L)和生长停滞特异性蛋白6(growth arrest-specific protein 6,Gas6)与反应机体的感染有关[2-3]。但二者在非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的研究报道鲜少。借此,本研究将评估血清Flt3L 和Gas6 水平在非霍奇金淋巴瘤患者利妥昔单抗化疗后的水平变化情况,探讨其在肺部感染患者中的诊断价值。
1 资料与方法
1.1 一般资料
选取2019年7月至2021年7月在海南医学院第一附属医院血液内科收治的116 例非霍奇金淋巴瘤患者作为研究对象,其中男67 例,女49 例,年龄10~85 岁。纳入标准①符合非霍奇金淋巴瘤的临床诊断标准[4],且经病理组织学证实;②所有患者均为初治;③均经过6 个疗程利妥昔单抗化疗;④临床资料完整者;⑤无其他肿瘤疾病史;⑥患者及家属知情同意。排除标准:①伴有影响血清Flt3L 和Gas6 水平的血管疾病(血液系统疾病、免疫系统疾病、全身性感染、休克、肾功能损伤等);②近1 个月有使用抗生素治疗;③伴有其他重要脏器疾病;④伴有精神障碍。本实验经医院伦理委员会批准。
1.2 肺部感染评估
参考最新临床肺部感染相关标准[4]评估患者是否发生肺部感染,将116 例患者分为肺部感染组48 例,非肺部感染组29 例以及未感染组39 例。
1.3 观察指标
收集非霍奇金淋巴瘤患者的临床资料[性别、年龄、BMI、吸烟史、糖尿病史、高血压史、肺部疾病史、肿瘤分期(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期)[5]、病理分型(B 淋巴瘤、T 淋巴瘤)[1]、国际预后评分(International Prognostic Index,IPI)[6]、左心射血分数以及利妥昔单抗的总剂量,实验室指标包括血红蛋白、β2-微球蛋白、血清乳酸脱氢酶、Flt3L 和Gas6。
1.4 国际预后指数(international prognostic index,IPI)评分[6]
非霍奇金淋巴瘤国际预后评分包括年龄、行为状态、Ann Arbor 分期、乳酸脱氢酶(LDH)、结外病变受侵部位数五项指标,每一个预后不可因素计1 分,共5 分,评分愈高表面危险程度愈高。
1.5 实验室指标检测
采集所有患者空腹外周静脉血4 mL,用肝素抗凝,离心机以3 000 r/min 速度离心10 min,离心半径为10 cm,取上清液,-20℃以下冷藏备用。采用全自动生化分析仪(厂家:美国贝克曼库尔公司,型号:AU5800)及配套试剂盒以比色法检测血红蛋白、血清乳酸脱氢酶,以化学发光法检测β2-微球蛋白,以酶联免疫吸附法检测血清Flt3L、Cas6 水平,检测期间严格遵守操作规范。
1.6 统计学方法
采用SPSS 15.0 统计学软件进行数据处理,计量资料以(±s)表示,组间用独立样本t检验,计数资料用n(%)表示,采用χ2检验,肺部疾病史、血清Flt3、Cas6 水平对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的影响,采用Logistic 回归分析检验,绘制受试者工作特征曲线(ROC 曲线),检验血清Flt3、Cas6水平预测非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的预测价值,以P<0.05为差异有统计学意义。
2 结果
2.1 非霍奇金淋巴瘤患者的临床相关项目比较
三组患者性别、年龄、BMI、吸烟史、糖尿病史、高血压史、肿瘤分期、病理分型、国际预后评分、左心射血分数、利妥昔单抗的总剂量、血红蛋白、β2-微球蛋白(mg/mL)、血清乳酸脱氢酶比较,差异无统计学意义(P>0.05),三组患者肺部疾病史、血清Flt3L、Gas6 水平比较:肺感染组>非肺部感染组>未感染组,差异有统计学意义(P<0.05)。见表1。
表1 非霍奇金淋巴瘤患者的临床相关项目比较[n(%),(±s)]Table 1 Comparison of clinically relevant items in patients with non-Hodgkin lymphoma[n(%),(±s)]

表1 非霍奇金淋巴瘤患者的临床相关项目比较[n(%),(±s)]Table 1 Comparison of clinically relevant items in patients with non-Hodgkin lymphoma[n(%),(±s)]
项目性别(例)男女χ2/t 值0.977 P 值0.613年龄(岁)BMI(kg/m2)吸烟史0.751 1.371 1.391 0.474 0.257 0.498糖尿病是否是否肺部感染组(n=48)26(54.16)22(45.84)50.34±5.68 23.03±1.25 21(43.75)27(56.25)16(33.33)32(66.67)非肺部感染组(n=29)16(55.18)13(44.82)50.59±5.92 23.49±1.68 14(48.28)15(51.72)11(37.94)18(62.06)未感染组(n=39)25(64.10)14(35.90)51.83±6.03 22.96±1.34 22(56.41)17(43.59)17(43.58)22(56.42)0.961 0.618高血压1.212 0.545肺部疾病史17(35.41)31(64.59)29(60.41)19(39.59)13(44.83)16(55.17)19(64.52)10(34.48)18(46.15)21(53.85)14(35.89)25(64.11)7.463 0.023肿瘤分期是否有无 ⅠⅡⅢⅣ0.384 0.998组织病理分型B 淋巴瘤T 淋巴瘤国际预后评分左心射血分数(%)利妥昔单抗的总剂量(g)血红蛋白(g/L)β2-微球蛋白(mg/mL)血清乳酸脱氢酶(U/L)细胞沉淀率(mm/h)Flt3L(pg/mL)Gas6(mg/mL)10(20.83)12(25.00)14(29.17)12(25.00)44(91.66)4(8.34)2.53±0.48 63.89±5.19 8.23±1.95 99.76±10.38 3.02±1.07 264.31±22.78 17.48±2.16 81.76±5.69 20.17±4.56 6(20.68)8(27.58)9(31.03)6(20.71)27(93.11)2(6.89)2.47±0.39 64.18±4.95 8.03±1.97 103.03±10.95 2.96±0.87 259.83±21.79 16.60±1.96 83.45±6.67 18.52±3.10 9(23.07)10(25.64)12(30.76)8(20.53)36(92.30)3(7.70)2.50±0.51 64.56±5.23 8.39±2.05 104.74±11.87 2.68±0.79 256.71±23.68 16.53±2.08 95.34±5.21 14.34±2.47 0.05 0.973 0.150 0.182 0.272 2.284 1.522 1.214 2.749 58.570 28.725 0.860 0.833 0.761 0.106 0.221 0.300 0.068 0.000 0.000
2.2 非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染Logistic 回归分析
血清Flt3L、Cas6 水平升高是非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的危险因素(OR>1,P<0.05)。见表2。
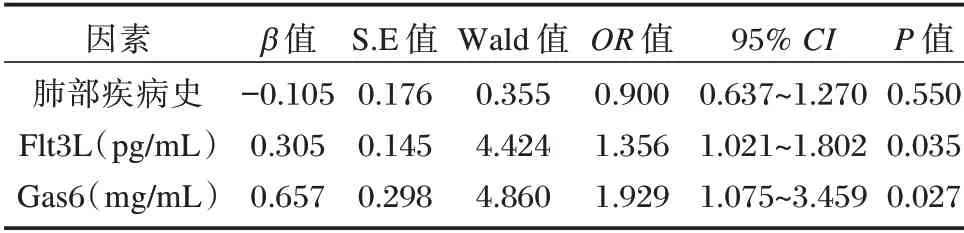
表2 非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的Logistic 回归分析Table 2 Logistic regression analysis of pulmonary infection in patients with non-Hodgkin lymphoma after rituximab chemotherapy
2.3 血清Flt3L、Gas6 对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的预测效能
ROC 曲线图结果显示,血清Flt3L、Gas6 水平联合预测非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的曲线下面积(AUC)为0.879,高于单一检测(P<0.05)。见表3,图1。
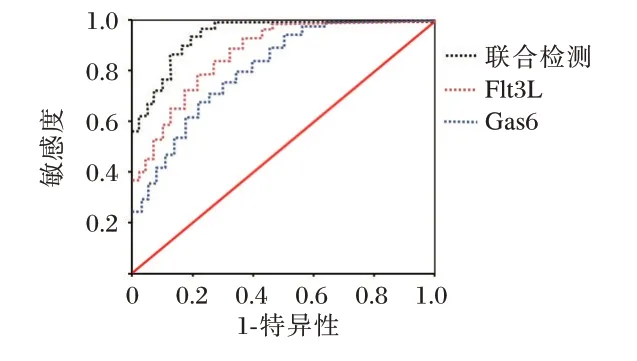
图1 ROC 曲线Figure 1 ROC curve

表3 血清Flt3L、Gas6 对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的预测效能Table 3 Predictive efficacy of serum Flt3L and Gas6 on pulmonary infection in patients with non-Hodgkin's lymphoma after rituximab chemotherapy
3 讨论
非霍奇金淋巴瘤主要在淋巴结、脾脏,胸腺等部位病变,是免疫功能异常、病毒感染、细胞感染以及遗传等多因素共同作用的结果,该病发病率、危害性均高,严重危害患者身体健康。化疗是非霍奇金淋巴瘤常用治疗方法,但单独应用化疗时效果欠佳。利妥昔单抗用作嵌合抗CD20 单克隆抗体药物,也是目前临床上标准治疗药物,与化疗药物联合使用可以增强对肿瘤细胞的敏感性。崔岗[6]研究显示,利妥昔单抗用于在免疫抑制治疗下治疗非霍奇金淋巴瘤可以抑制肿瘤恶性特性。但长期使用利妥昔单抗会引起感染、血液事件、心血管事件等不良反应。相关研究发现,应用利妥昔单抗治疗的不良反应约为14%~53%,且多为肺部感染[7]。因此,非霍奇金淋巴瘤患者应用利妥昔单抗治疗需预防肺部感染的发生。
Flt3L 是一种可以刺激早期造血的细胞因子,与Flt3L-受体特异性结合,对多种干细胞、血细胞、前体细胞的生成与分化具有促进作用。还能与多种细胞因子协同,提高造血功能以及免疫功能。Gas6 是依赖维生素K 蛋白,通过Tyro3、Axl、Mer受体相结合,产生各种生物学效应,包括增殖效应、炎症抑制效应等[8]。Gas6 可通过白细胞来增加机体炎症反应,促进吞噬和抗凋亡,相关研究提示,Gas6 与C 反应蛋白、白细胞介素10 等炎症因子相关[9]。因此,检测血清Flt3L、Gas6 水平对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染的预测有一定价值。
化疗患者免疫力较差,机体处于慢性微炎状态,容易继发呼吸道感染,且向下蔓延,引起肺部感染[10]。有肺部疾病史患者呼吸道上皮细胞坏死,上皮纤毛运动功能受损等原因,导致呼吸系统的防御功能下降,易发生肺部感染[11]。本研究肺部感染组和非肺部感染组有肺部疾病史比例高于非感染组,证实了肺部疾病史与之相关,与白丹[12]研究结果相似。通过分析临床特点发现,肺部感染组血清Flt3L、Gas6 水平较高,认为血清Flt3L、Gas6 水平升高患者有肺部感染倾向,与不良预后特征相关,与相关研究结果相似[13-14]。Logistic 多因素回归分析显示,血清Flt3L、Gas6 水平对于判断非霍奇金淋巴瘤患者利妥昔单抗化疗后是否肺部感染有重要价值,其水平升高与发生肺部感染有关。晏黎[15]等学者研究发现,血清Flt3L、Gas6 水平与非霍奇金淋巴瘤化疗后的感染相关,可作为临床辅助评估肺部感染的重要指标。ROC 曲线图结果显示,血清Flt3L、Gas6 水平对非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染预测的AUG 值分别是0.718、0.702,进一步证实了血清Flt3L、Gas6 与非霍奇金淋巴瘤患者利妥昔单抗化疗后肺部感染相关,可作为预测利妥昔单抗化疗后肺部感染的良好指标。二者联合检测时AUG 值为0.879,敏感度和特异度分别是87.50、85.41,均高于单独检测,因此,非霍奇金淋巴瘤患者利妥昔单抗化疗期间通过监测血清Flt3L、Gas6 水平可以早期患者肺部感染情况,同时,积极采取干预措施可以降低利妥昔单抗化疗后肺部感染的发生率,提高预后。
综上所述,非霍奇金淋巴瘤患者血清Flt3L 和Gas6 水平升高是利妥昔单抗化疗后发生肺部感染的独立危险因素,早期联合检测血清Flt3L 和Gas6水平有利于预测患者化疗后感染情况和病情判断。
