3种种植方式对生态介质箱中苦草的生长生理和水体修复效果的影响*
2022-05-29王趁义郭炜超王凤玲
田 啸 王趁义# 杨 娜 郭炜超 王凤玲
(1.浙江万里学院生物与环境学院,浙江 宁波 315100;2.宁波晟乾环境技术开发有限公司,浙江 宁波 315100)
随着社会经济的发展及城市化进程的加快,水体富营养化及黑臭现象加剧,水环境生态平衡遭到严重破坏,不但影响城市河湖景观,还会危害人类身体健康[1]。同时,治理水体占用大量的公共资源,阻碍国民经济的可持续发展。沉水植物是维护水体生态系统结构和功能的重要组成部分[2]。苦草(Vallisnerianatans)是沉水植物中的典型代表,耐污耐寒,能在缺氧环境中正常生长,具有较强的氮、磷吸收能力,且能增加水体透明度,提升水中溶解氧水平,被广泛用于河湖库水体的生态修复中[3]。但水体深于100 cm将严重影响苦草植株的生长,同时由于植物凋零腐烂后会引起水体二次污染,而一般的栽培方式只能保证植物的种植面积和数量,并不能保证后续植物的养护、植物死亡和凋零后的处理处置,因此选择种植方式和种植基质是影响水生植物生长与生理状况、水体生态修复效果的重要影响因素。
潜水式生态介质箱是本课题组研发的一种集成化综合治理技术装置,该装置可根据受污染水体的水质特点和深度来灵活调节潜浮深度,解决污染水体深度大、透明度低、不适应于沉水植物生长的问题,实现对各类污染物及营养盐等多层次、多梯度的吸附利用和有效去除。为更好发挥沉水植物和生态介质箱的协同修复作用,本研究以苦草为受试植物,利用静态水培试验,探究3种种植方式对苦草生长生理形态特征和水体修复效果的影响,为河湖库黑臭水体治理提供有效的新技术和试验依据,并为构建新型集约化修复方式提供实践基础。
1 材料与方法
1.1 试验材料
苦草植株的初始平均株高和质量分别为(36.4±0.26) cm、(10.41±0.24) g,试验前用蒸馏水洗去泥土和枯叶,再植入暴晒一周后的河道污水中驯化1周。苦草和河泥均由宁波晟乾环境技术开发有限公司提供。
试验水样采自宁波市鄞州区某生活区旁的黑臭河道,水质如下:总磷(TP)、总氮(TN)、氨氮、高锰酸盐指数、Ca2+、Mg2+分别为5、15、10、80、2.6、0.92 mg/L,各微量元素均小于0.15 mg/L,pH为6.5~7.5。
试验所用的构筑材料为亚克力板;基质为外购的沸石、陶粒、活性炭,粒径分别为15~20、10~15、5~8 mm。
1.2 试验装置
潜水式生态介质箱装置见图1,长×宽×高为350 mm×350 mm×250 mm。箱体分为4层,上3层分层放置基质,从上到下依次填充厚度均为50 mm的沸石、陶粒、活性炭;箱体四周、隔离板及管壁中均布有孔径小于所用基质粒径的渗水孔;将苦草植入100 mm厚的河泥放入第4层箱底,通过塑料管延伸出箱体;箱体顶部用带孔塑料板封闭,箱体底部悬挂竹球。
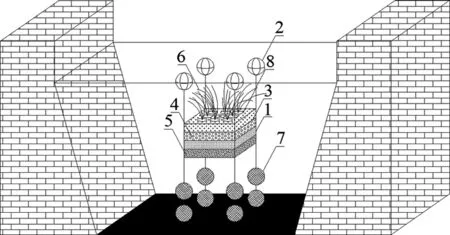
1—箱体;2—浮体;3—隔离板;4—基质;5—河泥;6—沉水植物;7—竹球;8—塑料管图1 潜水式生态介质箱示意图Fig.1 Schematic diagram of submersible ecological medium box
1.3 试验设计
试验使用9个160 L水箱,每个水箱均注入100 L河道污水,为排除溶解氧对试验的影响,对每个试验组进行不间断曝气处理,曝气量为3 L/min。共设计3组试验:河泥组(苦草植入河泥中)、基质组(苦草植入基质中)、混合组(苦草植入混合河泥(河泥和基质)中),每组种植10株苦草,做3个重复取平均值。
试验于2020年3月28日至4月28日进行,将事前驯化过的苦草植入装置,试验水体温度为16~26 ℃,适应3 d后采样,每隔7 d采样一次,共采样5次,于采集日的10:00采集植物样本和水面下5~10 cm处的水样,每次采集100 mL,并用接近水样水质的人工污水进行补充,维持总体积不变,每次采集的植物样本为同一株苦草的叶片。试验结束时测定苦草株高、根系长度、单株干质量、单株鲜质量与植株含水率。
1.4 试验方法与数据处理
利用分析天平称量单株质量和干质量;皮尺测定株高和根系长度;乙醇提取法测定植物的叶绿素a+b含量,ɑ-萘胺比色法测定植物的根系活力[4];电导率法测定植物的质膜透性[5];硫代巴比妥酸法测定植物的丙二醛[6]122。水体中TP、TN、氨氮、高锰酸盐指数和pH分别采用《水质 总磷的测定 钼酸铵分光光度法》(GB 11893—89)、《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(GB 11894—89)、《水质 氨氮的测定 水杨酸分光光度法》(HJ 536—2009)、《水质 高锰酸盐指数的测定》(GB 11892—89)及便携式pH计(MIK-pH5050)测定。
2 结果与讨论
2.1 种植方式对植物生长生理的影响
2.1.1 苦草生长状况
沉水植物通过根茎叶从种植基质和水体中吸收营养物质来供自身生长,河泥中含有氮、磷、铁和锰等营养元素,基质中营养物质相对于河泥较贫瘠,且基质会吸附水体中的氮、磷元素,因此基质与植物之间存在着竞争关系,不利于苦草的生长。由表1可见,种植方式对苦草的单株干质量与含水率无显著影响;不同试验组中苦草的株高和单株鲜质量均依次为河泥组>混合组>基质组,且差异显著;混合组的苦草根系长度最长,基质组最短。可见,混合组和河泥组环境更适合苦草扎根,促进植株株高和生物量的增长。

表1 苦草的生长状况比较1)Table 1 Comparison of growth status of Vallisneria natans
2.1.2 根系活力
根系是植物吸收水分和营养物质的重要器官,根系活力反映了植物吸收氮、磷的能力及生长发育状况[7]。经过28 d的培养,各试验组苦草的根系活力依次为河泥组(2.39 mg/(g·h))>混合组(1.83 mg/(g·h))>基质组(1.42 mg/(g·h)),且差异显著(P<0.05)。河泥组和混合组中含有利于苦草生长所需的营养元素和细菌、真菌分泌的次生代谢产物,可促进植物的根系活力;基质中的营养物质贫瘠,微生物缺乏,不利于植物的扎根生长。
2.1.3 叶绿素a+b
由图2(a)可知,试验前14天,苦草对新环境存在适应阶段,各试验组的叶绿素a+b呈现先下降后升高的趋势。之后,各试验组苦草的叶绿素a+b均呈波动下降趋势,这是因为苦草表面聚集并附着了微生物,影响植物的光合作用及叶绿素含量[8]。经过28 d的培养,各试验组的叶绿素a+b依次为河泥组(0.725 mg/g)>混合组(0.632 mg/g)>基质组(0.439 mg/g),且差异显著(P<0.05)。原因是混合组和基质组中基质对光照进行阻隔,苦草接收到的光照强度降低,直接植入河泥中更利于苦草生长。随着苦草的生长,植物密度会进一步变大,在试验中后期,各试验组苦草的叶绿素a+b均呈下降趋势。
2.1.4 质膜透性
质膜透性是植物抗逆性生理指标之一,是观察膜系统受到损坏的重要标志[9],质膜的损害程度可用相对电导率表示[10]。由图2(b)可知,试验前7天,由于苦草初期的移栽与前期的环境适应导致相对电导率均呈快速上升趋势;7 d后,各试验组的相对电导率缓慢变化趋于稳定。经过28 d的培养后,各试验组的相对电导率依次为基质组(13.82%)>混合组(11.15%)>河泥组(10.00%),且差异显著(P<0.05)。河泥组对苦草的损害程度最小,说明基质的胁迫进一步损害了苦草的质膜。
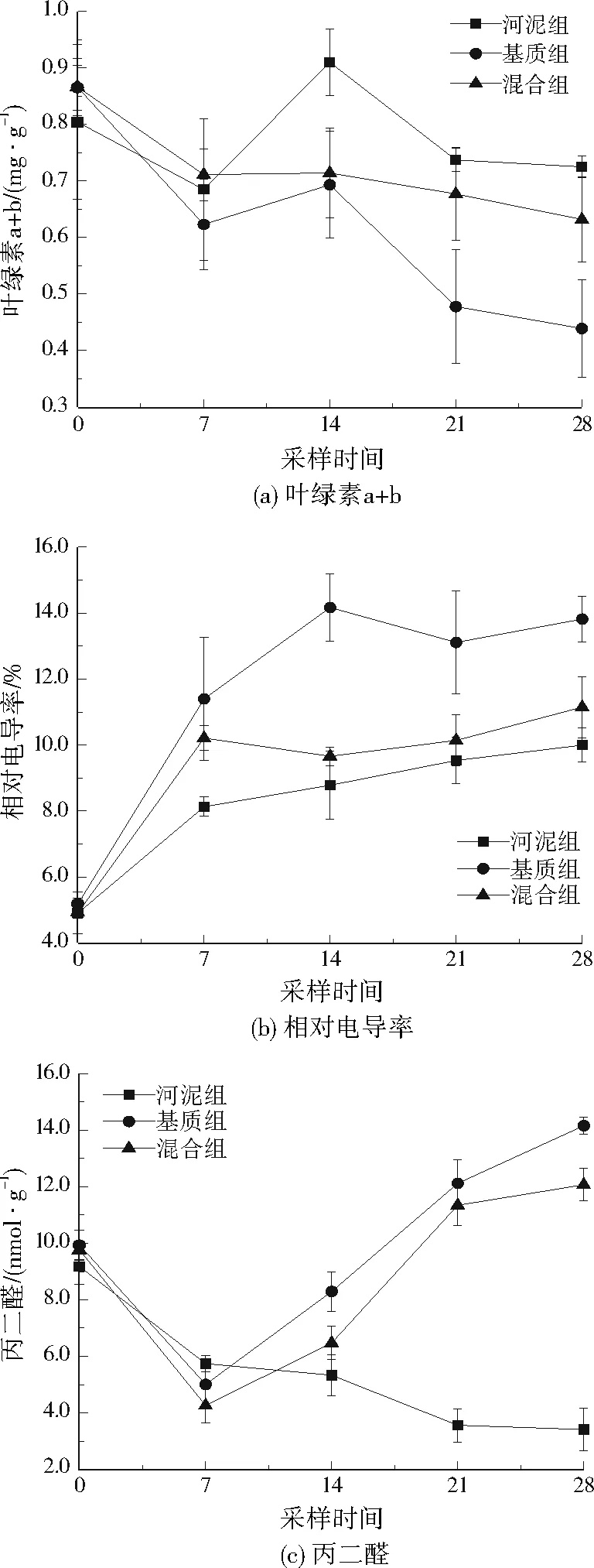
图2 种植方式对植物生理生化指标的影响Fig.2 Effects of planting method on physiological and biochemical indexes of plants
2.1.5 丙二醛
丙二醛是植物细胞膜脂过氧化产物,其含量高低可反映膜脂过氧化作用强弱及质膜损坏程度[6]124。植物通过增加丙二醛分泌量来保护质膜免受损害。由图2(c)可知,最初因移植受到基质和外界环境的胁迫,使苦草细胞内电解质外渗量上升,随着逐渐适应环境,各试验组苦草中丙二醛含量减小,第7天丙二醛含量出现了转折:河泥组的苦草得到来自河泥的营养,丙二醛含量持续下降,而基质组和混合组的苦草因基质营养贫瘠,且碱性侵害不利植物的扎根生长,致使其丙二醛含量不断升高,这进一步证实基质的胁迫对苦草有一定的损害。经过28 d的培养,各试验组苦草中丙二醛依次为基质组(14.15 nmol/g)>混合组(12.07 nmol/g)>河泥组(3.41 nmol/g),且差异显著(P<0.05),河泥组更适合苦草生长。
2.2 种植方式对水体修复效果的影响
2.2.1 TP去除率
多孔基质不仅有吸附作用,还能为微生物的生长提供附着载体,促进其代谢作用。由图3(a)可见,各试验组水体中TP去除率都呈上升趋势。试验前7天,基质组和混合组的TP去除率上升迅速,是因为水体中可溶性磷酸盐与基质中的Ca2+、Al3+、Mg2+等离子反应,产生了固相沉淀[11]。试验进行到28 d时,各试验组TP去除率依次为混合组(46.0%)>基质组(45.1%)>河泥组(11.1%)。河泥组对TP的去除率远低于另外两组,说明单一的水生植物除磷作用较弱,除磷主要靠生态介质箱中的基质吸附或絮凝沉淀实现[12]。
2.2.2 TN去除率
水体中氮元素主要依靠苦草的吸收与同化[13]、基质吸附[14]、根际微生物代谢[15]等作用去除。由图3(b)可见,各试验组水体中的TN去除率随时间延长而不断升高。当试验进行到28 d时,TN去除率依次为混合组(54.5%)>基质组(36.1%)>河泥组(21.0%)。混合组在第14~21天有一段明显的上升趋势,这是由于混合组中各种基质孔隙中滋生了微生物,形成沉水植物-生物膜系统,同时苦草逐渐适应基质的环境,开始与基质一起发挥协同净化作用。
2.2.3 氨氮去除率
由图3(c)可见,在试验前7天,各试验组氨氮去除率迅速上升。混合组和基质组对氨氮的去除率远高于河泥组,这与混合组和基质组中各种基质对氨氮的初期吸附有关;试验进行到28 d时,各试验组的氨氮去除率依次为混合组(72.7%)>基质组(61.1%)>河泥组(39.6%),此时水体中滋生了一些有利于氨氮去除的菌种,如硝化细菌。3个试验组对水体中氨氮的去除效果存在明显差异,混合组和基质组对TN和氨氮的去除效果较优。

图3 种植方式对水质指标的影响Fig.3 Effect of planting method on water quality indicators
2.2.4 高锰酸盐指数去除率
由图3(d)可见,各试验组水体的高锰酸盐指数去除率都呈先快速上升,再逐步稳定的趋势。试验前7天,由于高锰酸盐指数的初期浓度较高,通过苦草根系的吸收、基质的吸附以及根际土著微生物膜的代谢等协同作用[16],使各试验组的高锰酸盐指数浓度快速下降,试验21 d时达到稳定;到28 d时,河泥组、基质组和混合组中高锰酸盐指数去除率基本相近,分别为89.0%、89.9%、91.2%。此时,基质已吸附饱和,出现少量藻类和根系有机分泌物等,使3个试验组的高锰酸盐指数去除率无明显差异。
2.2.5 装置生物膜的镜检
镜检发现,生物膜中不仅存在硝化菌,还生长了大量的原生动物和藻类,如菌胶团(Corynebacteriummicelles)、轮虫(Rotifer)、草履虫(Paramecium)、小球藻(Chlorellavulgaris)、线虫(CaenorhabditisElegans)、曲型小环藻(Cyclotella)(见图4)等,说明该装置的微生物挂膜性能良好。上述微生物在去除污染物方面发挥着重大的作用,相对于外来投加的微生物,水体中的土著微生物群能更好地应对水体污染,装置所用挂膜材料能使土著微生物快速附着成膜,增加装置对水中TN、TP、高锰酸盐指数的处理性能。
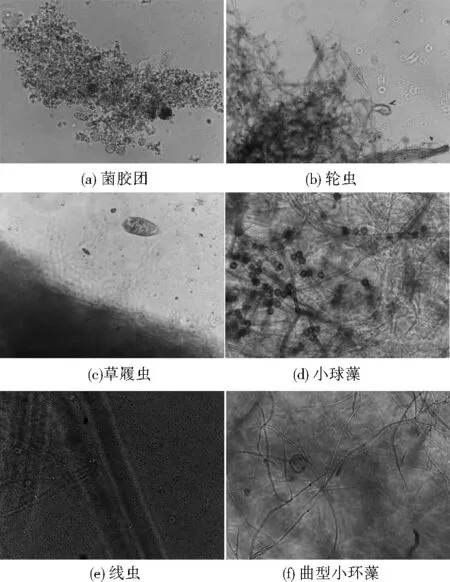
图4 显微镜检查装置内生物膜中微生物(200倍)Fig.4 Microscopic examination of microorganisms in biofilm in the device (200 times)
3 结 语
(1) 从苦草生长和生理生化角度看,将沉水植物直接植入介质箱底层河泥中对苦草的损害最小,最有利于苦草的生长发育,其次是混合组,而直接植入介质箱基质中的苦草虽然也能生长发育,但生长存在抑制和胁迫。从水体净化效果来看,种植方式对高锰酸盐指数的去除无明显影响,但混合组的水质(TP、TN、氨氮)均优于河泥组和基质组,综合比较,混合组对水体的净化效果最佳。
(2) 将苦草种植在潜水式生态介质箱的底层河泥中(传统的生态浮床是将苦草种植在河道的河泥中),虽有利于苦草的生长,但对水体修复效果并不明显;同时存在河泥和基质虽对苦草的生长有一定的损害,但在总体上却有利于水体修复效果的提升。因此,生态介质箱采用混合组“基质+河泥”的方式种植苦草,能充分发挥苦草和基质的协同修复和净化能力。
