辅因子与发酵调控谷氨酸棒状杆菌合成丁二酸
2022-05-28沙凤孙科谭芳美熊美惠
*沙凤 孙科 谭芳美 熊美惠
(苏州科宁多元醇有限公司 江苏 215000)
丁二酸可以作为关键的模块化合物,用于生产各种商品化学品,包括1,4-丁二醇、己二酸和四氢呋喃,以及生物可降解聚合物,如聚丁二酸酯。它目前主要是通过化学合成工艺从化石燃料中生产出来的,这带来了很高的环境成本,尤其是更高的二氧化碳排放。随着化石燃料价格的飞涨和环境意识的提高,丁二酸的生产工艺可能需要变得更加经济和环保。
丁二酸是三羧酸循环的中间产物,在一些厌氧和兼性厌氧生物的厌氧发酵过程中作为最终产物排出体外。目前利用发酵法合成丁二酸的主要菌种包括:产丁二酸厌氧螺菌(Anaerobiospirillum succiniciproducens)、产丁二酸放线杆菌(Actinobacillus succinogenes)、大肠杆菌(E.coli)、产丁二酸曼氏杆菌(Mannheimia succiniciproducens)、酿酒酵母(Saccharomyces cerevisiae)、谷氨酸棒状杆菌(Corynebacterium glutamicum)等[1]。尽管已报道多种微生物可以发酵生产丁二酸,但大多数生产菌在简单培养基中无法生长,用于培养的有机氮源以及产物纯化的费用昂贵。为了使丁二酸的生物生产可行且经济,必须开发更高效的菌株和发酵方法。一方面能以较高的速率产生丁二酸,耐受较高浓度的物质;另一方面能利用简单的培养基,因为微生物生长所需的氨基酸或复杂的营养物质阻碍了丁二酸的生产回收。为了实现这些目标,选择高效丁二酸生产微生物或对代谢途径的加强,是不可避免的。谷氨酸棒状杆菌(Corynebacterium glutamicum)是常用的氨基酸、有机酸生产菌,其生长速度快,产酸效率高,且具有良好的食品安全性[2-3]。
C.glutamicum主要通过葡萄糖形成磷酸烯醇式丙酮酸(PEP)和丙酮酸,在羧化酶作用下合成草酰乙酸进入TCA循环,经苹果酸及富马酸,最终生成丁二酸[4]。在此过程中最主要限制因素为NADH的供给。C.glutamicum在厌氧发酵生产丁二酸过程中,辅酶Ⅰ(NAD+,NADH)参与了多步反应。根据代谢流理论,分析从葡萄糖到丁二酸的代谢途径,1mol的葡萄糖在EMP途径中共产生2mol NADH,通过TCA还原臂生成2mol的丁二酸,但是这个过程需要4mol NADH参与。为了达到葡萄糖到丁二酸的最高理论产率,就需要额外的2mol NADH。针对上述问题,我们以C.glutamicum SA001为生产丁二酸的出发菌株,它是一株乳酸脱氢酶缺陷的工程菌。通过提高代谢过程中辅酶NADH含量,增加由乙醛酸循环途径到丁二酸的代谢流,考察丁二酸产量及产率的变化。
1.实验材料与方法
(1)菌株和质粒
Escherichia coli DH5α由本实验室保藏;C.glutamicum SA001由本实验室保藏;质粒pMD18-T、pXMJ19由本实验室保藏。
(2)方法
①培养基
LB液体培养基:蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,121℃灭菌15min。
LB固体培养基:在LB液体培养基中添加2%的琼脂粉,121℃灭菌15min。
厌氧发酵培养基:Glucose 20g/L,(NH4)2SO420g/L,urea 5g/L,KH2PO41g/L,K2HPO41g/L,MgSO4·7H2O 0.25g/L,CaCl20.01g/L,FeSO4·7H2O 0.01g/L,MnSO4·H2O 0.01g/L,ZnSO4·7H2O 1mg/L,CuSO40.2mg/L,NiCl2·6H2O 0.02mg/L,biotin 0.2mg/L,110℃灭菌5min。
电转培养基:蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,3%甘氨酸,0.1% Tween 80,121℃灭菌15min。
②培养条件
种子液培养:将-20℃甘油保存的菌种于固体培养基平板划线活化,30℃培养24h。用接种环刮取平板上的菌3环,转至30mL含有10μg/mL氯霉素的培养基中。30℃,220rpm振荡培养12h。
好氧诱导培养阶段:将种子液以4%接种量接入30mL含有10μg/mL氯霉素和0.6mmol/L IPTG的发酵培养基中,30℃,200rpm下诱导培养10h。
厌氧发酵产酸阶段:将好氧诱导培养好的菌液在6000rpm,4℃低温离心5min,去上清,用30mL发酵培养基洗菌后,转入100mL血清瓶中,补加0.84g/L的Na2CO3,并通入氮气排除体系内的空气后,拧紧瓶塞,30℃,220rpm下厌氧发酵8h。
③目的基因cysQ的克隆
引物设计:在NCBI(National Center for Biotechnology Information)数据库中,来源于E.coli DH5α编码NADP(H)磷酸酶的基因cysQ(Genbank:NC_000913.2),设计其PCR扩增引物cysQ-F(CCCAAGCTTATGTTAGATCAAGTA TGCCAGCTTG)和cysQ-R(GCTCTAGATTAGTAAATAGACACTCTG AACCCC),由南京金斯瑞生物科技有限公司合成。PCR反应体系:94℃变性5min,按如下参数循环30次:94℃变性1min,60℃退火60s,72℃延伸1.5min;最后72℃延伸10min。对所得到DH5α基因组DNA上的cysQ基因进行PCR扩增。PCR反应所得到的产物分别用0.8%的琼脂糖凝胶电泳分析结果。
④重组质粒pXMJ19-cysQ的构建
纯化后的cysQ基因片段以及质粒pXMJ19用SmaⅠ和HindⅢ双酶切,把双酶切后得到的产物在16℃下经T4 DNA连接酶作用连接12h以上,在E.coli DH5α中转化构建重组质粒pXMJ19-cysQ。经含氯霉素平板涂布后挑选抗性克隆,然后提取质粒并进行Hind Ⅲ单酶切及SmaⅠ/Hind Ⅲ的双酶切鉴定。
⑤NADP(H)ase的诱导表达
将重组质粒pXMJ19-cysQ和空质粒pXMJ19分别电转入C.glutamicum SA001中。挑取阳性转化子按如下方法诱导表达:挑取单菌落至含20μg/mL氯霉素抗性的LB培养液中,37℃振荡培养过夜;然后按3%的接种量接种到新鲜的培养液(含20μg/mL氯霉素)中,37℃培养至OD600约为0.8时,加入IPTG至终浓度0.6mmol/L,30℃,200rpm下诱导表达6h。
⑥重组菌酶活测定
蛋白质定量采用常规的Bradford法[5]。将新鲜菌体用100mmol/L pH8.0的Tris-HCl缓冲液充分悬浮菌体进行超声破碎。破碎结束后,将菌液10000rpm,4℃离心15min。重组菌酶活力在0.5mM NADPH,5mM MgCl2,5mM丙酮酸,乳酸脱氢酶2U,100mMTris-HCl缓冲液(pH8.0)中进行测定。在30℃,波长340nm处检测吸光值变化。1U酶量定义为NADP(H)磷酸酶每分钟消耗1μmol NADPH的量。
⑦发酵代谢产物分析
菌体密度是用紫外可见分光光度计在波长600nm处测吸光度值,细胞干重(DCW)是由DCW与OD600测定的标准曲线换算得到,换算公式为:DCW(g/L)=0.4×OD600。使用DNS法测定发酵液中残糖浓度。辅酶含量测定,色谱柱为美国SEPAX公司Sepax HP-C18 Column色谱柱;流动相A为含有5%乙腈的20mmol/L KH2PO4,pH5;流动相B为纯水;采用梯度洗脱方式,流速1ml/min;柱温为37℃;紫外检测器波长为260nm。
2.结果与分析
(1)NADP(H)磷酸酶基因在SA001中的克隆和表达
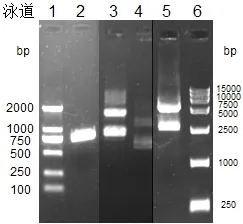
图1 来源于Escherichia coli DH5α的NADP(H)磷酸酶基因的克隆Fig.1 Cloning of the NADP(H)ase gene from Escherichia coli DH5α
PCR扩增后的NADP(H)磷酸酶基因cysQ和载体pXMJ19分别进行SmaⅠ/Hind Ⅲ双酶切,酶切产物纯化后用T4 DNA连接酶连接,构建表达载体pXMJ19-cysQ。重组质粒经单酶双切鉴定,结果与预期一致。将PCR的扩增产物经0.8%琼脂糖凝胶电泳鉴定,电泳结果见图1。由图可知,在第2泳道(近750bp)有特异性扩增条带,其大小与预期符合(目的产物约为741bp)。第5泳道,约在4974bp和2368bp处各有单一条带,表明目的片段NADP(H)磷酸酶基因已成功连接至表达载体pXMJ19中。

表1 对照菌与重组菌的比酶活及胞内辅酶浓度Tab.1 Specific enzyme activity of NADP(H)ase,the concentration of intracellular NAD+,NADH,NADP+ and NADPH in the control strain and recombinant strain
重组菌总蛋白的SDS-PAGE分析如图2所示。第1泳道为带有pXMJ19-cysQ质粒的E.coli DH5α超声得到的可溶性蛋白,第2泳道为带有空质粒pXMJ19的E.coli DH5α超声得到的可溶性蛋白,它表明所表达的重组蛋白大约为28kDa,其与预测的氨基酸序列大小较为一致,同时在对应位置的第二泳道则几乎没有克隆蛋白表达,表明重组质粒pXMJ19-cysQ构建成功。
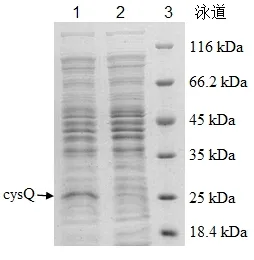
图2 SDS-PAGE分析重组质粒表达结果Fig.2 SDS-PAGE analysis of recombinant protein
(2)NAD+、NADH、NADP+以及NADPH的测定
30℃、220r/min培养菌体至OD600=0.8,加入IPTG培养基中至终浓度为0.6mmol/L,30℃、220r/min诱导10h后,对出发菌株和重组菌株进行相应的酶活测定以及胞内辅酶NAD+、NADH、NADP+和NADP测定,结果如表1所示。
重组菌NADP(H)磷酸酶的比酶活为0.625U/mg,相较于对照菌酶活提高了3.1倍,胞内NAD(H)的总量提高了16.7%,同时,NAD(H)与NADP(H)总量提高了22.3%。这可能是因为菌体在过表达NADP(H)磷酸酶后,用于生物合成(如氨基酸,脂类以及核苷酸的合成)的辅酶Ⅱ减少,为维持细胞的生长,菌体应激调节机制促使辅酶Ⅱ的合成途径增强,使胞内辅酶水平整体提高。
(3)两阶段发酵产丁二酸
对照菌和重组菌有氧培养至干重达到8.9g/L、9.6g/L时,用新鲜的发酵培养基洗菌,转入100mL血清瓶中,30℃,220rpm条件下厌氧发酵8h,并分别在0h,2h,4h,6h和8h取样测定各种参数。两阶段发酵对照菌与重组菌厌氧发酵菌体干重、残糖量,产物丁二酸以及副产物乙酸浓度随时间变化过程,如图3所示。
以葡萄糖为碳源发酵产丁二酸,重组菌厌氧阶段8h内消耗了17.5g/L的葡萄糖,丁二酸的浓度达到11.9g/L。相较于对照菌,产物的得率增加了31.3%,同时副产物乙酸的量降低了6.97%,丁二酸与乙酸的摩尔比值提高了35.2%。这一结果表明,NADP(H)磷酸酶的过量表达,提高了辅酶NADH的供给,能够使得流向乙酸合成途径的代谢流量减少,增加丁二酸合成强度。
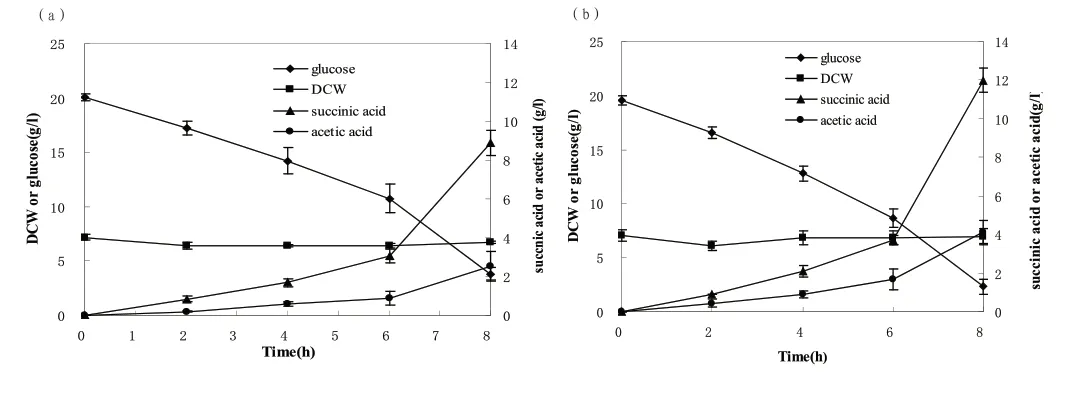
图3 对照菌(a)与重组菌(b)厌氧发酵菌体干重、残糖以及产物随时间变化过程Fig.3 Time-course of DCW,glucose and the products during anaerobic-phase fermentation after aerobic culture by the control strain (a)and recombinant strain (b) in sealed bottles
3.结论
通过构建重组谷氨酸棒状杆菌SA001/pXMJ19-cysQ,有氧条件下重组菌NADP(H)磷酸酶的酶活比,相较于对照菌酶活提高了3.1倍,并在厌氧发酵过程中仍然保持一定活性。
重组菌厌氧阶段8h内丁二酸产量达到11.9g/L,相较于对照菌,产物的得率增加了31.3%,同时副产物乙酸的量降低了6.97%,丁二酸与乙酸的摩尔比值提高了35.2%。
