高原肺水肿动物模型研究进展
2022-05-28向雪梅郭鑫曾佳容刘倍余张耀雷孙红玉
向雪梅,郭鑫,曾佳容,刘倍余,张耀雷,孙红玉
(西部战区总医院基础医学实验室,成都 610083)
高原肺水肿(high altitude pulmonary edema,HAPE)是一种危及生命的疾病,主要发生在迅速上升到高原但未适应高海拔环境的个体[1-3]。HAPE的患病率约为1%~2%[4],通常随着海拔的上升而增加[5]。HAPE 的早期体征表现为咳嗽、活动时呼吸困难、劳累、作业能力下降,然后逐渐发展为静息时呼吸困难、端坐呼吸、紫绀、咳嗽,重者因呼吸衰竭而死亡[6]。临床上将肺水肿分为肺泡性水肿和间质性肺水肿,前者具有明显症状和体征,易为临床所发现;后者发展隐匿缓慢,可无症状和体征,故易被临床检查所忽略,通常也称为亚临床肺水肿。HAPE 早期及恢复期多表现为间质性肺水肿,肺纹理增粗;进展期与稳定期病变主要累及肺实质[7-8]。
自从20 世纪60 年代HAPE 被认为是非心源性肺水肿以来,已经提出过许多病理生理学假说来解释在年轻且健康的个体中突然出现肺水肿的现象。既往认为,肺动脉高压是HAPE 产生的主要机制,为HAPE 的形成提供了血液动力学基础[9-10]。目前认为,低氧引起的低氧诱导因子(hypoxia inducible factor,HIF-1α)等介导的多个基因的转录发生改变,进而引起生化代谢、神经调控、免疫应答、血管功能、体液平衡等的异常改变。近日,格日力[11]、马四清等[12]、吴刚等[13]提出HIF-1 或许将成为调控低氧肺动脉高压的一个靶点,HIF-1 是细胞适应低氧环境调控基因表达最重要的转录因子。目前已证实HIF-1 可以控制人体内多达数百种(占2%~5%基因组)低氧反应基因[14]。HIF-1α 以氧依赖性方式降解,在正常氧时被降解,缺氧时HIF-1α 被保护免于降解,增加低氧靶基因表达,增加对低氧的适应性[15]。这些靶基因的表达能够促进红细胞、毛细血管的生成以保持氧供,加速糖酵解、抑制线粒体的呼吸来维持ATP 供给、调节血红蛋白水平和氧化还原酶类活性来调控免疫及体液平衡、一些能够调节血管紧张度、细胞凋亡和存活基因转录因子的蛋白。最新研究表明表观遗传学与HIF 协同参与低氧转录反应[16]。总之,所有细胞和分子防御的目的是为了恢复能量代谢和保持氧的稳态。经过近70 年的探索,HAPE 动物模型的制备方法及病理生理特点取得一些进展[6,17-23]。本文梳理了相关进展,综述如下。
1 HAPE 模型的制备方法
根据低氧暴露方式分为缺氧暴露、转基因动物模拟缺氧、缺氧暴露联合其它方法3 种,具体制备如下。
1.1 缺氧暴露
低压低氧是国内外制备HAPE 模型最常用的方法,动物低氧方案各有利弊,尚无确切统一的标准化方案。接下来分为大鼠和其它动物两部分阐述。
1.1.1 大鼠
大鼠是最常用的动物,包括Sprague-Dawley 品系(SD)、Wistar 品系。早在1971 年就出现了用低压低氧的方式制备HAPE 模型,Bartlett 等[24]将成年SD 雄性大鼠在低压舱中暴露于4200 m(450 mmHg)21 d。结果表明,暴露在高海拔环境下的动物会经历1 个早期阶段,此时,肺的重量增加,如果暴露持续足够长的时间(在这些条件下为20~21 d),水肿消退,肺泡增生的速度加快,肺泡表面积增加,这一变化可能具有适应性意义。虽然该研究并没有获得典型的HAPE 动物模型,可能是因为海拔不够高,但为早期的HAPE 模型研究提供了有益的参考。
1983 年,刘士群等[25]采用成年大白鼠,摸拟5000 m 高原。结果以斑块状分布的间质性肺水肿为主,肺泡性肺水肿出现的数目少,且程度轻。实验证明了大白鼠在模拟5000 m下48~72 h 可发生间质性肺水肿,也证明了高原缺氧所引起的肺动脉压升高和局部肺血液灌流增加是产生HAPE 的主要机制。刘士群等[26]紧接着在1984 年模拟6000 m高原以观察大、小鼠的缺氧反应,发现在低压缺氧的24~72 h,大、小白鼠的肺含水量均趋向增高。刘士群的这两项研究为国内的HAPE 模型奠定了基础。
随后,不管是在模型制备上,还是机制探索上都取得了一定的进展。首先,在模型制备上,Colice等[27]选用两种SD 的变异品系,即Hilltop(H)和Madison(M)来探索HAPE 动物模型,得到的都是轻度间质性HAPE,但M 比H 大鼠在24000 英尺模拟下暴露9~12 h 后会出现更严重的HAPE。其次,在HAPE 的发生机制上,到1999 年大多数研究低氧致水肿机制的工作都集中在在肺毛细血管内皮细胞通透性的改变和肺血管床张力改变的因素上。Tomlinson 等[28]将目光放到了气道上皮功能上,发现像人类一样,中度低压缺氧的亚急性暴露(气压=0.5 atm,24 h)会抑制SD 大鼠气道上皮的钠转运。之后,在药物预防和治疗HAPE 上,Berg 等[29]假设银杏叶提取物可以预防HAPE,将SD 大鼠置于高原舱(380 mmHg,10%氧浓度)24 h,但该模型无HAPE典型的组织病理表现,猜测其原因可能是海拔不够高,或者暴露时间不够长。以上的这些研究以最终获得间质性HAPE 为主,少有肺泡性HAPE。
2015 年,王雷琛等[30]通过缺氧暴露的方法(模拟海拔6000 m,72 h),得到间质性和肺泡性HAPE模型,猜测其原因可能是海拔较高、暴露时间较长。2020 年,林雪等[21]不仅重复了王雷琛等[30]的模型,同时还设置了实地低氧组(4200 m,28 d),比较这两种不同低氧胁迫方式构建HAPE 模型的效果。结果两组SD 大鼠HAPE 模型构建成功,且都得到肺泡性水肿。以上两项研究提示6000 m 72 h 低压低氧暴露可得到肺泡性HAPE 模型,未来需要更多的研究判断其稳定性。此外,这是初次在实地低氧环境中建立适合高海拔地区的、简单有效且可复制的大鼠HAPE 实验模型[21]。
综上所述,SD 大鼠在低压低氧条件下可诱导间质性HAPE 模型,也可诱导肺泡性HAPE 模型,这主要取决于海拔高度、持续时间、上升速率等[31]。
除了常用的SD 大鼠,国内外学者也选用Wistar大鼠,模拟海拔5000~6000 m,暴露24~72 h 制备HAPE 模型,镜下可见明显的肺泡隔增宽、毛细血管充血等间质性肺水肿表现,提示得到的HAPE模型以间质性肺水肿表现为主,肺泡性肺水肿少见[32-34]。
1.1.2 其它动物
除了大鼠,人们尝试用绵羊来制备HAPE 模型。Bland 等[35]和Landolt 等[36]未能检测到成年绵羊在缺氧期间肺淋巴流量的增加。之后大量证据表明,绵羊对缺氧的肺血管反应可能与其他哺乳动物不同[37-39],甚至有文献报告缺氧会导致新生绵羊血管外肺水减少[40]。以上研究表明绵羊不适合制备HAPE 模型。
王雷琛等[41]采用小鼠(昆明种),雌雄各半,模拟6000 m 高原,共72 h,观察到肺间质性及肺泡性水肿。王雷琛2015 年发表的两篇文章[30,41]所用的大鼠品系不同,但高原条件一致,均表现出间质性和肺泡型水肿,并与林雪等[21]的报道一致,这是一项可喜的发现,提示该条件下诱导的HAPE 模型的稳定性较好。
2003 年,Kleinsasser 等[42]用猪制备HAPE 模型。猪的体积大,可以使用肺部X 射线来帮助诊断肺水肿。选用8~10 周龄的家养白猪在缺氧(18 468 英尺,10%氧浓度)下暴露1 周。只有1 头猪X射线阳性,但是肺气体交换障碍和支气管肺泡灌洗液变化提示早期肺水肿。
常见的HAPE 高原模拟以6000 m 为主,暴露时长在24~72 h。2020 年,石继鹏等[22]探索新的HAPE 模型,选用新的品系(BALB/c 小鼠),共暴露72 h,且模拟的海拔高达8000 m,此前最高的实验记录为25 000 英尺[43](约7600 m),结果显示,肺泡壁明显增厚,肺泡间充血伴大量炎症细胞浸润,提示肺泡性HAPE 模型建立成功。
综上所述,制备HAPE 模型建议选用大鼠,其病理生理表现与人类HAPE 病例相似[37,44-48]。海拔越高,病理生理表现越明显,急性的暴露时长通常在1~3 d。
1.2 模拟缺氧-转基因工程技术
转基因工程是当今最先进的技术之一,将此技术应用在HAPE 模型领域的最新文献发表在2020年,并立即引起众多学者的关注。Gojkovic 等[49]条件性删除小鼠骨髓细胞中的Von Hippel-Lindau 因子(VHL),研究低氧反应对肺水肿的影响,该模型显示出一些最重要的HAPE 症状,确定了髓系VHL缺失小鼠作为HAPE 模型的可能性。
随后,Nikinmaa[50]对此进行评论,指出Gojkovic的模型具备HAPE 的大多数的症状,并提出,这是一种有潜力、有希望的HAPE 动物模型。稍后,Swenson 等[51]也展开评论,提出Gojkovic 的小鼠炎症性HAPE 模型是分子生物学和基因操作的一个杰作,是在无肺炎的情况下产生的炎性肺水肿,可能在HAPE 的晚期并依赖于HIF 的机制中发挥作用,但不能作为HAPE 的标准模型,对于研究和治疗HAPE 的研究者而言,HAPE 的动物模型一直是像圣杯一样的追求[52]。一个好的小型动物模型将允许进行更广泛和高通量的实验,以更好地了解病理生理过程,并筛查预防和治疗的药物或非药物策略,尚需更多的学者探索HAPE 模型,不能停止建立HAPE 标准模型的脚步[51]。
1.3 缺氧暴露联合其它方法
1.3.1 缺氧暴露联合疲劳诱导
缺氧和劳累已被确定为HAPE 发展的两个主要因素[53],使动物产生劳累的方法包括跑台力竭运动、游泳、睡眠干扰等,其中使用得最多的是跑台力竭运动[54]。
自1937 年第1 例HAPE 病例报道后,到1968年仅有几百例的临床案例报道而无相关的机制报道。Whayne 等[48]人假设HAPE 可能与肺小动脉收缩、心输出量增加等有关,于是利用Long-Evans 大鼠(150~225 g)诱发了一种早期形式的肺水肿,即血管周围水肿。模型的制备方式为低氧暴露联合游泳运动。结果表明,缺氧或小动脉阻断后的肺动脉高压均可引起幼鼠早期肺水肿。该研究奠定了大鼠作为研究HAPE 机制实验动物的基础。
国内学者模拟高原4000~6000 m,用游泳(每日游6 次,每次40 min)或跑台力竭运动(15~20 m/min,每次40 min)使动物劳累,用SD 大鼠来进一步复制HAPE 动物模型,成功建立间质性HAPE 模型[55]、低氧习服模型[56]、出血性HAPE 模型[23]。
在国外的报道中,2010 年,Bai 等[17]模拟高原4700 m,让大鼠行走48 h,每4 h 停顿1 次,表现为典型的出血性肺水肿,与单纯缺氧或单纯运动相比,缺氧和运动相结合对肺泡-毛细血管屏障的损害更为严重,缺氧和劳累可以在不引起肺部炎症的情况下出现HAPE 样症状[17]。2012 年She 等[57]复制以上Bai 的模型研究了远端肺形态学的细节。肺片显示肺间质增厚和肺泡腔中红细胞的肿胀。提示通过复制Bai 的模型,得到较好的重现效果。
2019 年,Paul 等[43]引入肺部chest X-ray 检查更准确地诊断HAPE,另外,模拟海拔高达25 000 英尺(约7620 m),雄性SD 大鼠游泳直到筋疲力尽,擦干后立即放置在缺氧模拟室内18 h。经X 射线检测的该HAPE 模型得到证实,大鼠死亡率很低,有望应用于HAPE 模型的建立。Scott 等[45]还观察到炎症和HAPE 是协同事件,彼此之间没有起因和影响。
综上,低氧暴露联合疲劳诱导似乎适合制备肺泡性、出血性等更为危重的HAPE 模型。
1.3.2 缺氧暴露联合内毒素感染
大鼠通常能很好地耐受高原,不容易发展成肺水肿。Ono 等[58]用肠炎沙门氏菌内毒素预处理雄性SD 大鼠(重200~250 g),模拟高原4300 m,暴露24 h,组织学证据显示,内毒素预处理后低氧暴露的大鼠肺内形成了斑块状分布的肺水肿,组织学形态与HAPE 患者类似。
1.3.3 缺氧暴露联合病毒感染
正如Ono 等[58](1993 年)研究了内毒素预处理增加了大鼠对HAPE 的易感性那样,Carpenter 等[59]假设先前存在的病毒性呼吸道感染会增加幼小动物对低氧引起的肺水肿的敏感性。Carpenter 等[59]用鼠副流感病毒(仙台病毒)感染幼鼠(22~24 d;50~60 g),然后将幼鼠暴露在缺氧环境下(常压,10%氧浓度)24 h,结果表明,先前存在的病毒性呼吸道感染会使幼鼠对低氧环境下肺血管通透性的敏感性增强。这一发现与当时发表的一些文献相似,即被诊断出HAPE 的儿童往往在高海拔暴露之前就已患有呼吸道感染[60],提示早前的呼吸道感染可能增加了儿童患HAPE 的机率。
1.3.4 缺氧暴露联合化学药物诱导
2004 年,曾南阳[61]在5200 米高原实地,给Wistar 大白鼠注射肾上腺素(0.05 mg/100 g)。所有动物给药后均出现心衰引起肺水肿最后死亡。镜下见典型的肺泡性水肿病理特征。该研究指出肾上腺素诱发的大鼠高原性肺水肿均有心衰症状,且高原性肺水肿体征出现早、病情发展快。
2011 年,陈有等[62]也在高原实地(3700 m)展开研究,他们给雄性新西兰大白兔注射生理盐水(共400 mL)。该研究设计较全面,其一,输入生理盐水诱导间质型HAPE 向肺泡型肺水肿转变;其二,加以地塞米松来促进肺水通道蛋白5 表达,以减轻肺水肿;其三,使用心得安抑制肺水通道蛋白5 表达,以降低重吸收功能,促进建立肺泡性HAPE 模型。结果显示,地塞米松组未出现肺泡型HAPE,而心得安组出现2 只肺泡型肺水肿动物,这与实验设计相符。此外,该研究考虑到临床上多数HAPE 患者发病前有夜间入睡困难的情况,设置睡眠干扰组,通过输液加睡眠干扰方式,能使37.5%(3/8)动物诱导出肉眼可见的肺泡型HAPE 动物模型。
2 HAPE 动物模型评价指标
动物暴露于低氧环境后,会引发一系列的缺氧应激反应,主要表现为肺动脉压升高、动脉血气改变、肺含水量增多,支气管肺泡灌洗液中的总蛋白及炎性细胞因子水平增加,肺泡毛细血管渗透率增加、肺泡液体清除能力下降、肺屏障通透性增加、生化及氧化应激指标改变、组织学表现异常等。HAPE 模型常用评价指标见表1。
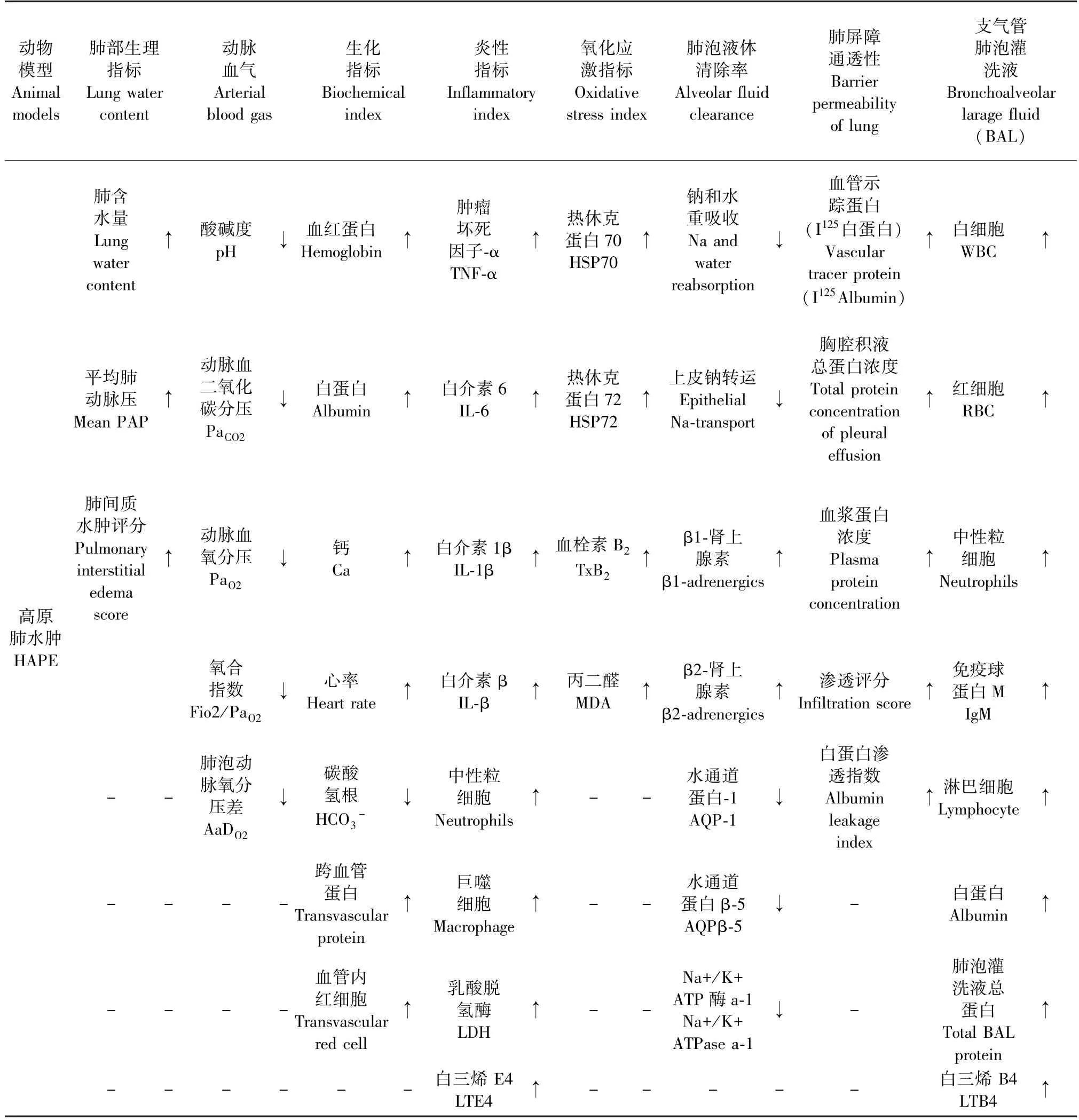
表1 高原肺水肿动物模型的评价指标Table 1 Evaluation indicators of HAPE models
3 结语
在这篇综述中,我们描述了HAPE 常用制备方法以及部分病理生理特点。由于高原低张性缺氧是引起HAPE 的根本原因[63],因此缺氧环境是制备HAPE 模型必不可少的。缺氧环境有2 种方式可以实现,第1 种方式是在高原上进行实地研究,但由于受到地理条件的限制,开展的并不多;第2 种,同时也是最常用的方式是进行高原模拟,即使用高原舱,据报道已有复合低压舱可模拟高原低气压,高温、低温、干热、紫外线照射等环境因素,为HAPE动物模型研究提供了实验平台[64]。有时只依靠缺氧暴露并不能得到满意的模型,为了进一步制备稳定、可靠的HAPE 模型,部分研究会联合其它方法,包括疲劳、内毒素感染、病毒感染、药物注射等。HAPE 模型最常用方法是缺氧暴露,其次是低氧暴露联合疲劳,之后是低氧暴露联合其它方法。
用于创建HAPE 的动物包括大鼠、小鼠、猪、兔、灵长类和绵羊[42,65-67]。国内外常用雄性大鼠,因在临床上男性患病率比女性高。不同于肺水肿动物模型,其制备方法多种多样,包括化学药物、高原暴露等[68]。HAPE 作为肺水肿的一部分,至今仍缺乏标准、可靠的实验模型,随着新技术的发展与普及,转基因工程小鼠模型已经出现并适用于炎性HAPE 研究[50]。另外,动物实验难以像临床一样通过肺部CT 或超声[69]检查诊断HAPE。因此,并没有明确的评价指标证实HAPE 动物模型建立成功,可通过完善CT 检查以进行优化。
总的来说,标准的HAPE 动物模型的缺失仍然是阻碍HAPE 研究发展的关键原因之一。HAPE 动物模型发展至今,取得了可喜的成果,但仍然存在很多难题与痛点,包括动物对高原的耐受性、高原条件限制、无明确的评价指标、指向性不强、重现性不好等,有待进行更多的基础研究。