胰腺癌免疫系统人源化小鼠模型的构建及评估
2022-05-28罗宝花刘晓秋雷静玉张彩勤张永斌师长宏
罗宝花 刘晓秋 雷静玉 张彩勤 张永斌师长宏*
(1.广州中医药大学科技创新中心,广州 510405;2.空军军医大学实验动物中心,西安 710032;3.广州中医药大学实验动物中心,广州 510405)
胰腺癌是一种恶性程度极高的肿瘤,其发病隐匿、进展迅速、预后极差,5 年生存率仅为8.5%[1-3]。临床数据显示,胰腺癌对放疗不敏感,对化疗易耐药,手术切除是目前治疗胰腺癌的主要手段[4-6]。然而,多数患者在确诊时已存在局部血管的浸润或转移,术后的转移率和复发率很高,患者术后5 年总生存率不超过20%~25%[7-8]。因此,迫切需要寻找新的治疗策略来提高胰腺癌的治疗效果。
近年来,肿瘤免疫疗法和免疫检查点抑制剂的诞生给肿瘤治疗带来了革命性的变化,针对细胞毒性T 淋巴细胞抗原4 (cytotoxic T-lymphocyteassociated protein-4,CTLA-4)和程序性死亡蛋白1/程序性死亡蛋白配体1(programmed death protein 1/programmed death protein ligand 1,PD-1/PD-L1)的免疫检查点抑制剂在非小细胞肺癌、黑色素瘤、肾癌等恶性肿瘤的治疗中取得了卓越疗效[9-11],显示了人体免疫系统在抗肿瘤方面的巨大潜力。目前针对胰腺癌开展的免疫疗法包括免疫检查点抑制剂、CAR-T 疗法、溶瘤病毒、肿瘤疫苗、免疫因子调节剂等,大部分免疫治疗的疗效评估都是临床研究[12-15],周期较长,进程缓慢,少数的临床前研究也是在自发胰腺癌小鼠模型上进行[16-18],由于存在种间差异,临床前研究结果与肿瘤患者实际临床特点的一致性较差,难以实现临床转化,因此,亟需找到一个合适的临床前动物模型来推动胰腺癌免疫治疗策略的开发。近年来,随着重度联合免疫缺陷小鼠的不断改良,具有人免疫系统的人源化小鼠模型得以建立,通过将患者来源的肿瘤细胞系或肿瘤组织移植入免疫系统人源化小鼠体内构建的肿瘤免疫双人源化小鼠模型,可以极大程度地模拟患者体内肿瘤组织与免疫系统的相互作用,可能成为推动肿瘤免疫治疗策略临床前研究的理想工具。
本研究通过将人外周血单个核细胞和人胰腺癌细胞系Aspc1 同时植入重度联合免疫缺陷小鼠NCG 体内以构建胰腺癌免疫系统人源化小鼠模型并进行模型的有效性评估,以期为后续开展的胰腺癌免疫治疗研究提供基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
24 只5~6 周龄SPF 级雌性重度联合免疫缺陷NCG 小鼠,体重22~25 g,购自江苏集萃药康生物科技有限公司【SCXK(苏)2018-0008】,饲养在空军军医大学实验动物中心SPF 级屏障设施内【SYXK(陕)2017-001】。环境温度23~25℃,相对湿度40%~60%,12 h 昼夜交替,小鼠笼盒、垫料、饲料及饮用水等经高温高压灭菌处理,动物自由摄食和饮水。相关动物实验获得空军军医大学实验动物福利及伦理委员会批准(审批号:20180512)。
1.1.2 细胞系
人胰腺癌细胞系Aspc1 细胞购买于ATCC,使用DMEM 培养基(10%胎牛血清+1%青链霉素)于37℃、5% CO2孵箱中培养。
1.1.3 主要试剂与仪器
4 份健康人新鲜外周血从西京医院输血科获取,获得医学伦理委员会批准(KY20193035),人淋巴细胞分离液、小鼠淋巴细胞分离液(天津市灏洋生物科技有限公司),抗人hCD45 流式抗体(BD,555482),抗鼠mCD45 流式抗体(BD,553082),IHC试剂盒(康为世纪有限公司),抗人PD-L1 抗体(Abcam,ab205921),抗人CD45 抗体(CST,13917 S),抗人CD8 抗体(proteintech,66868-1-Ig),抗人CD4 抗体(Abcam,ab133616),抗人颗粒酶B 抗体(Abcam,ab208586),胎牛血清、DMEM 培养基、0.05%胰酶(Gibco);人抗PD-1 单抗帕博利珠单抗(K 药) 购自MSD;荧光正置显微镜(奥林巴斯BX43) 用于免疫组织化学染色分析,FC500(Beckman Coulter)和Flow Jo 软件用于流式细胞采集与数据分析。
1.2 方法
1.2.1 动物分组
NCG 小鼠适应性饲养1 周后,随机分为未重建组(Aspc1)、重建不治疗组(Aspc1+PBMC)及重建K药治疗组(Aspc1+PBMC+K),共3 组,每组8 只,所有动物均饲养在SPF 级屏障设施内。
1.2.2 PBMC 的分离纯化
应用Ficoll 密度梯度离心法1750 rpm,20℃,20 min 获取第2 层环状乳白色淋巴细胞层,即PBMC,加入3~5 倍体积的红细胞裂解液,4℃裂解5 min,随后加入3~5 倍体积buffer 重悬细胞,750 rpm,4℃,10 min 低速离心以去除血小板,重复3 次,最后用PBS 重悬细胞计算细胞数量和活率。
1.2.3 免疫系统人源化小鼠模型的构建
获取新鲜纯化的PBMC 后,用PBS 重悬为5 ×107/mL,并置于冰上,每只小鼠注射剂量为1 × 107,经尾静脉注射植入NCG 小鼠体内,构建免疫系统人源化小鼠模型。
1.2.4 流式细胞术分析小鼠外周血中人免疫细胞的重建水平
PBMC 植入后第3 周用断尾法采集小鼠外周血,并用Ficoll 密度梯度离心法分离出PBMC 制成单个细胞悬液,同时标记流式抗人hCD45 和抗鼠mCD45 荧光抗体后,进行流式分析,评估小鼠外周血中人免疫细胞的重建水平。计算方法:hCD45/(hCD45+mCD45),应用FlowJo 7.6.1 软件进行分析及绘图。
1.2.5 胰腺癌免疫系统人源化小鼠模型的构建
PBMC 植入NCG 小鼠体内后第2 天,将处于对数生长期的Aspc1 细胞经0.05%的胰蛋白酶消化后,用无菌PBS 缓冲液和Matrigel 基质胶以1 ∶1 的比例将细胞重悬至2 × 106/200 μL,经皮下植入小鼠体内,构建胰腺癌免疫系统人源化小鼠模型。
1.2.6 肿瘤生长监测及K 药治疗
在肿瘤细胞接种后,动态监测肿瘤生长情况,每周2 次监测肿瘤体积并绘制肿瘤生长曲线,肿瘤体积计算方法:V(mm3)=长(mm)×宽2(mm2)/2,当肿瘤生长至100~200 mm3时,重建K 药治疗组(Aspc1+PBMC+K)开始给予K 药治疗,经腹腔注射,每周2 次,每次剂量为10 mg/kg,持续治疗3 周,未重建组(Aspc1)及重建不治疗组(Aspc1+PBMC)给予等剂量生理盐水。
1.2.7 免疫浸润情况分析
治疗3 周结束后,终止实验,对荷瘤小鼠采用吸入CO2安乐死,收集各组小鼠肿瘤组织、脾及骨髓,固定于4%多聚甲醛溶液中,石蜡包埋后做组织切片,进行免疫组织化学染色或免疫荧光染色,显微镜下观察染色结果并拍照,应用Image-Pro Plus 6.0软件进行半定量分析。
1.3 统计学分析
使用Graphpad Prism 8.0 统计软件对数据进行统计分析及图片制作,以平均值± 标准差()表示。采用t检验法进行组间差异性分析,P<0.05为差异具有统计学意义。
2 结果
2.1 成功构建免疫系统人源化小鼠模型
经过多次实验摸索,确定按照图1A 指示的流程,应用Ficoll 密度梯度离心法获得新鲜的纯度>94%,活率>98%的人PBMC,然后经尾静脉注射植入重度联合免疫缺陷小鼠NCG 体内,在PBMC 植入3 周后采集小鼠外周血,利用流式细胞术分析小鼠外周血免疫细胞中人CD45+细胞比例,结果显示,小鼠外周血中 hCD45/(hCD45+mCD45) > 25%(54.7%~84.2%)(图1B),待实验结束时,收集重建小鼠的脾及骨髓,用4%多聚甲醛溶液固定后,石蜡包埋做组织切片,进行免疫组织化学染色,结果显示,脾和骨髓中也含有较高水平的人CD45+细胞(图1C),这些结果均提示免疫系统人源化小鼠模型构建成功。
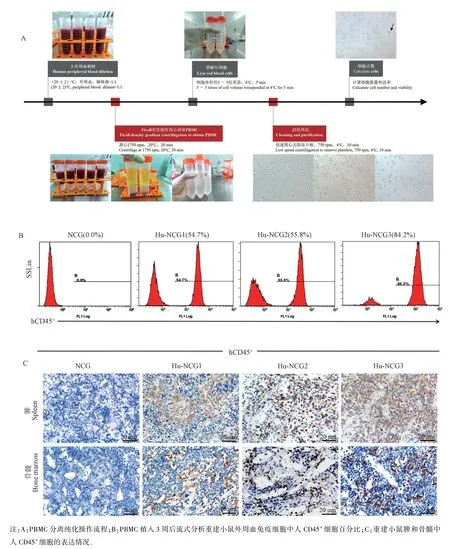
图1 成功构建免疫系统人源化小鼠模型Note.A.PBMC separation and purification procedure.B.Flow cytometry analysis of the percentage of human CD45+ cells in the peripheral blood immune cells of reconstructed mouse 3 weeks after PBMC implantation.C.The expression of human CD45+ cells in spleen and bone marrow of mouse was detected.Figure 1 Humanized immune system mouse model was successfully constructed
2.2 重建的人源免疫系统能够抑制人源胰腺癌生长
本研究在构建胰腺癌免疫系统人源化小鼠模型前,先在重度联合免疫缺陷小鼠NCG 皮下植入2 × 106Aspc1 细胞,并对其生长情况进行定期监测,结果显示,Aspc1 细胞在植入第3 周时,肿瘤体积达100 mm3左右(见图2A),可以开始治疗,而Hu-PBMC 小鼠模型(humanized-peripheral blood mononuclear cells,Hu-PBMC)的重建时间一般为3周左右[19],因此,本研究在后续进行胰腺癌免疫系统人源化小鼠模型构建时,在相近的时间点分别将PBMC 和Aspc1 植入NCG 体内,在PBMC 植入后第3 周,肿瘤体积达100~200 mm3时进行流式检测以评估人源免疫系统的重建效果,并开始K药治疗(图2B)。结果显示,与未重建组(Aspc1)相比,重建不治疗组(Aspc1+PBMC)能够减缓肿瘤生长(P<0.01),而重建K 药治疗组(Aspc1+PBMC+K)减缓肿瘤生长的作用则更为显著(P<0.001)(图2C),提示重建的人源免疫系统有功能,能够发挥抗肿瘤作用。
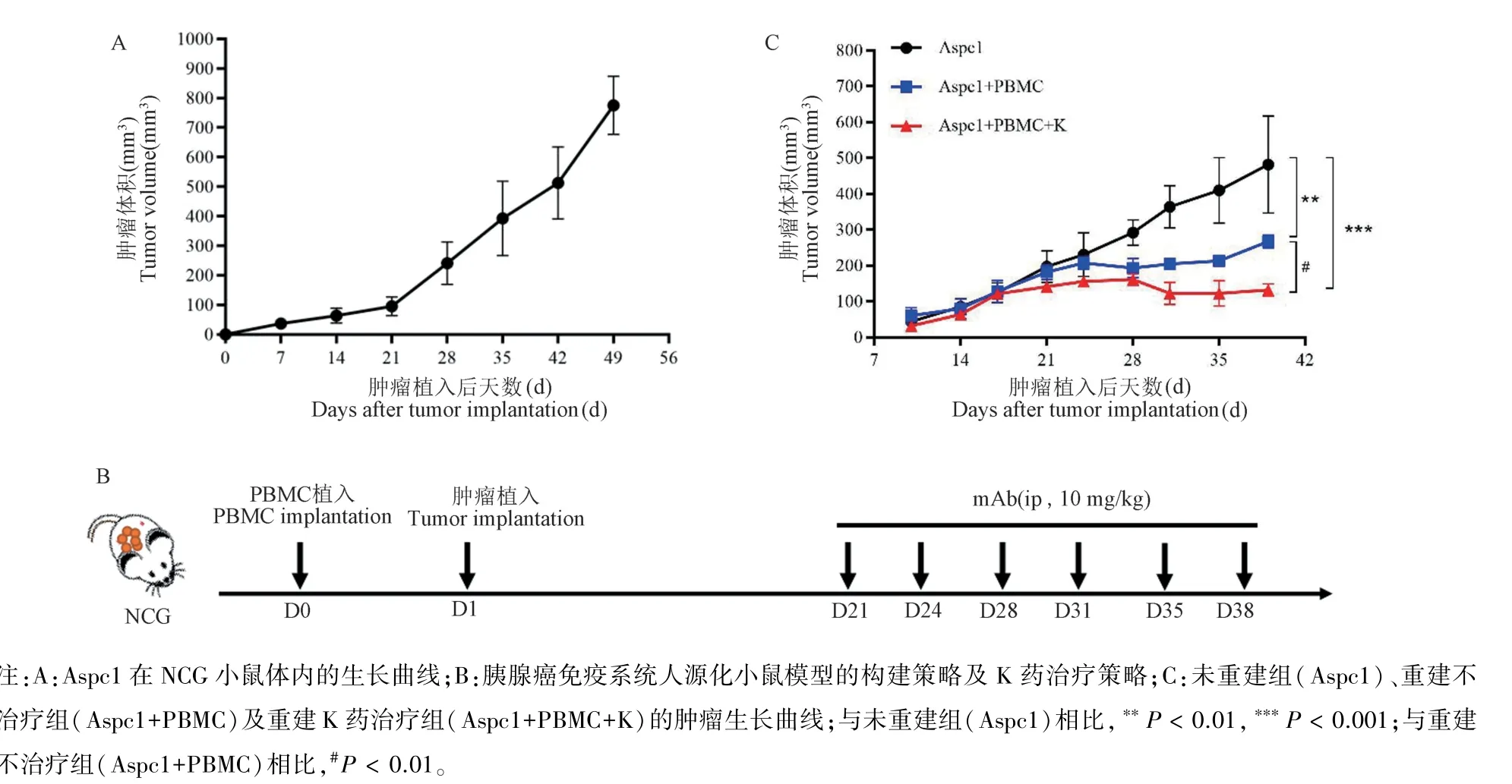
图2 重建的人源免疫系统能够抑制人胰腺癌生长Note.A.Growth curve of Aspc1 in NCG mouse.B.Construction strategy of humanized immune system mouse model with human pancreatic cancer and treatment strategy of K drug.C.Tumor growth curves of the non-reconstruction group (Aspc1),reconstruction without treatment group (Aspc1+PBMC) and reconstruction of K drug treatment group (Aspc1+PBMC+K).Compared with non-reconstruction group (Aspc1),**P <0.01,***P <0.001.Compared with reconstruction without treatment group (Aspc1+PBMC),#P <0.01.Figure 2 Reconstructed humanied immune system inhibits the growth of human pancreatic cancer
2.3 重建的人源免疫系统能够被人抗PD-1 单抗活化
K 药治疗结束后,收集未重建组(Aspc1)、重建不治疗组(Aspc1+PBMC) 及重建K 药治疗组(Aspc1+PBMC+K)小鼠的肿瘤组织做免疫组织化学染色和免疫荧光染色,分析不同处理组之间肿瘤组织内人PD-L1、CD45、CD8、CD4 和颗粒酶B(Granzyme B,GZMB)的表达差异,结果显示,未重建组(Aspc1) 的肿瘤组织内无人PD-L1、CD45、CD8、CD4 和GZMB 表达,重建不治疗组(Aspc1+PBMC)与重建K 药治疗组(Aspc1+PBMC+K)组的肿瘤组织均有人PD-L1、CD45、CD8、CD4 和GZMB表达,与重建不治疗组(Aspc1+PBMC)相比,重建K药治疗组(Aspc1+PBMC+K)的肿瘤组织中人CD45和CD4 的表达无显著性差异,而PD-L1 (P<0.001)、CD8(P<0.01)和GZMB(P<0.01)的表达显著性增多(图3A,3B),这些结果表明重建的人源免疫系统能够被人抗PD-1 单抗活化,而且人抗PD-1 单抗治疗诱导的增强的抗肿瘤作用主要与CD8+T 的活化有关。

图3 重建的人源免疫系统能够被人抗PD-1 单抗活化Note.Differential expression of human PD-L1,CD45,CD8,CD4 and GZMB in tumor tissues of the non-reconstruction group (Aspc1),reconstruction without treatment group (Aspc1+PBMC) and reconstruction of K drug treatment group (Aspc1+PBMC+K).Compared with the reconstruction without treatment group (Aspc1+PBMC),*P <0.05,**P <0.01,***P <0.001.Figure 3 Reconstructed humanized immune system can be activated by human anti-PD-1 monoclonal antibody
3 讨论
CD45 分子在所有白细胞上都有表达,称为白细胞共同抗原,是所有免疫细胞的共同标志物[20]。Hu-PBMC 小鼠模型是一种构建较为简单和经济的免疫系统人源化小鼠模型,当人PBMC 植入重度联合免疫缺陷小鼠后第3 周,小鼠外周血免疫细胞中人CD45+细胞的比例大于25%时,提示该模型构建成功[19]。Hu-PBMC 小鼠模型主要以重建人的T 淋巴细胞为主,比例可达90%以上,因此该模型是研究成熟T 细胞功能及其效应的理想模型,可用于研究人效应T 细胞的活化过程或用于免疫治疗药物的评估等[21]。但是,该模型有一明显的局限性,由于重建的人源免疫细胞与鼠源细胞的主要组织相容性复合体(major histocompatibility complex,MHC)不匹配,会出现致死性的移植物抗宿主反应(graftversus-host disease,GVHD),通常在PBMC 植入后4~6周开始出现,其严重程度与人T 细胞的植入水平直接相关,可以通过小鼠体重减轻、炸毛、弓背等症状来评估。由于GVHD 的发生,Hu-PBMC 小鼠模型实验观察窗口期较短,在实验过程中需要充分利用免疫系统人源化小鼠模型的窗口期,以保证肿瘤免疫双人源化小鼠模型构建成功后还能有足够的时间窗口进行后续实验,因此,在进行肿瘤免疫双人源化小鼠模型的构建时,需要综合考虑免疫重建所需的时间以及人源肿瘤的生长情况。为了充分利用实验窗口期,本研究实施了在构建胰腺癌免疫系统人源化小鼠模型前,先在重度联合免疫缺陷小鼠皮下植入胰腺癌细胞并对其生长情况进行动态监测,以确定肿瘤植入与进行免疫重建的最佳时间,从而实现最长的免疫治疗窗口。
在对临床患者的肿瘤标本进行免疫药物筛选时,理想情况下应该使用患者自身的PBMC 进行重建,但是由于肿瘤患者接受过化疗或自身免疫力下降等诸多原因,从肿瘤患者外周血中获取的PBMC数量非常有限,而Hu-PBMC 小鼠模型构建的成功率与植入的PBMC 的数量密切相关,多数情况下从肿瘤患者外周血中获取的PBMC 数量不能满足实验要求,因此,在无法从患者上获取足量的PBMC的情况下,可以考虑使用正常人的PBMC 进行重建并分组评估给予不同干预的治疗效果。但由于不同个体来源的PBMC 可能会对免疫治疗药物产生不同的反应,因此,我们在进行免疫系统人源化小鼠模型的构建时会同时选用3 个以上的PBMC 供体,对同一种免疫治疗药物进行评估,以明确该药物在不同个体上是否具有普适性。根据本实验结果,不同的供体对帕博利珠单抗具有一致的反应性。
PD-1 是一种免疫负调控分子,能够在T 细胞上表达,PD-L1 是其配体,在肿瘤微环境中,PD-1/PDL1 的相互作用可促使肿瘤细胞逃避免疫监测,从而促进肿瘤进展。与正常组织相比,肿瘤组织中PDL1 的表达明显增多,大量研究认为这是由抗肿瘤免疫反应诱导的,肿瘤浸润淋巴细胞在识别肿瘤抗原后,释放γ-干扰素(interferon-γ,IFN-γ)产生抗肿瘤免疫反应,与此同时,肿瘤细胞会表达PD-L1 产生一种适应性免疫抵抗以逃避免疫细胞的杀伤[22-23],因此,肿瘤组织中PD-L1 的表达上调,可认为是一种肿瘤免疫反应活化的标志。CD8+T 细胞是细胞毒性T 淋巴细胞,能够分泌各种细胞因子参与免疫反应,如IFN-γ、GZMB 等,对肿瘤细胞具有直接杀伤作用,是机体发挥抗肿瘤作用的关键细胞[24]。在本研究中,未进行免疫重建的小鼠体内肿瘤组织不表达人PD-L1,无CD8+T 细胞浸润,而进行免疫重建后,肿瘤组织中有人源性CD8+T 细胞的浸润和PDL1 的表达,表明小鼠体内的人源肿瘤组织能够诱导重建的人源免疫系统发挥抗肿瘤免疫反应,抑制肿瘤生长,即免疫系统人源化小鼠模型具有人免疫功能。在给予K 药治疗后,与不治疗的免疫系统人源化小鼠相比,肿瘤组织中浸润的人源性CD45+细胞、CD4+T 细胞的含量无明显变化,而CD8+T 细胞、GZMB 和PD-L1 的表达明显增多,表明抗PD-1 单抗治疗诱导的增强的肿瘤抑制作用主要与CD8+T 的活化有关,重建的人源性CD8+T 细胞能够与抗PD-1单抗发生反应。
本研究构建的胰腺癌免疫双人源化小鼠模型具备人源肿瘤细胞和人源免疫系统,能够较好地模拟胰腺癌患者体内肿瘤组织与免疫系统之间的相互作用,可以作为临床肿瘤患者的“替身”用于评估临床前胰腺癌免疫疗法的有效性及安全性,有望成为推动肿瘤免疫治疗策略临床前研究的理想工具。