巨噬细胞MED1 缺失对小鼠血糖水平及胰岛素抵抗的影响
2022-05-28高杰夏聪聪张亚莉姚雷清席雨燕邹宇佳王令白亮刘恩岐
高杰 夏聪聪 张亚莉 姚雷清 席雨燕邹宇佳王令*白亮刘恩岐
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723001;2.西安交通大学医学部基础医学院,西安 710061)
糖代谢紊乱、胰岛素抵抗(insulin resistance,IR)与多种代谢综合征如2 型糖尿病、肥胖、动脉粥样硬化等心血管代谢性疾病存在着密切的相关关系,严重危害人类健康和生活质量[1-3]。迄今为止,由于糖代谢紊乱、胰岛素抵抗病因复杂,发病机制与病理过程尚未完全阐明,故仍缺乏有效的预防与治疗策略。慢性炎症是诱导胰岛素抵抗病理过程的关键因素[4-5]。已有研究表明,脂肪过多积累引起的炎症和脂质代谢异常可导致肥胖相关胰岛素抵抗的发生。肥胖小鼠实验研究表明,巨噬细胞浸润脂肪组织,分泌产生TNF-α、IL-6 和MCP-1 等炎症细胞因子,使机体处于低度炎性反应状态[4]。提示巨噬细胞相关的炎症活动可能参与胰岛素抵抗的发生。
转录辅激活子MED1 是Mediator 复合物的核心成员,是多种核受体和转录因子的关键辅激活子,调控机体各种生物学过程,如生殖、发育、分化和代谢等[6]。Chen 等[7]研究表明,骨骼肌MED1 特异性敲除之后,小鼠葡萄糖耐受性提高以及胰岛素敏感性增强,并且能够抵抗高脂饮食诱导的肥胖。前期研究发现,肝MED1 具有调控胰岛素敏感性的作用[8];同时进一步研究显示,巨噬细胞MED1 的表达显著影响机体炎症反应程度[9]。据此,我们猜想MED1 通过巨噬细胞参与糖代谢及胰岛素抵抗的发生发展。为探讨巨噬细胞MED1 调控胰岛素抵抗发生的作用,本研究通过构建肥胖模型,在不同时期分析MED1ΔMac小鼠血糖水平和胰岛素抗性,为预防和治疗胰岛素抵抗及代谢综合征提供了理论依据和实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
MED1fl/fl小鼠由美国西北大学Feinberg 医学院Janardan K.Reddy 教授赠送,通过与巨噬细胞特异性Cre(Lyz2-Cre)小鼠(购买自美国Jackson 实验室) 杂交,获得 MED1ΔMac和同窝野生型对 照MED1fl/fl小鼠【SCXK(陕)2018-001】。选取9 只MED1fl/fl和7 只MED1△MacSPF 级雄性小鼠,8 周龄,体重约为21 g。饲养期间,全部动物均在西安交通大学医学部实验动物中心【SYXK(陕)2020-005】无特定病原菌(specific pathogen free,SPF)屏障设施内饲养,各组小鼠自由饮水。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22~25℃。所有操作均符合西安交通大学医学部实验动物管理法规定(审批号:IACUC 2017581)。
1.1.2 主要试剂与仪器
200 mg/mL 葡萄糖溶液(G8270-100G),60%Kcal 高脂饲料(D12492),胰岛素注射液(KVGY574),TG(198021)、TC(192061)试剂盒,4%甲醛(ISO014),hematoxylin(G1005-1),eosin(G1005-2)。
血糖仪(Ascensia Diabetes Cares Holdings AG,Contour plus one,印度尼西亚),毛细管离心机(凯达,TG12 M,中国),全波长酶标仪(TECAN,Infinite M200 Pro,瑞士),莱卡切片机(LEIKA,RM2235,德国),正置光学显微镜(尼康,Nikon Eclipse E100,日本)。
1.2 方法
1.2.1 动物分组及实验干预
动物分为两组:MED1fl/fl对照组和MED1△Mac敲除组。分别给予高脂饮食(HFD)饲喂0、4、8、12、16和20 周,动态监测体重、血糖和胰岛素抗性。
1.2.2 葡萄糖耐受性试验(glucose tolerance test,GTT)和胰岛素耐受性试验(insulin tolerance test,ITT)
GTT 实验:小鼠禁食16 h 腹腔注射葡萄糖(2 g/kg),尾部取血,运用血糖仪分别于注射后0、30、60、90 和120 min 测定血糖水平。
ITT 实验:小鼠禁食4 h,腹腔注射胰岛素(0.75 U/kg),尾部取血,运用血糖仪分别于注射后0、30、60、90 和120 min 测定血糖水平。
1.2.3 血浆与肝TG、TC 测定分析
禁食4 h,毛细管采集尾部血样,3000 r/min 离心15 min,收集血浆,测定血浆TG、TC 含量。
1.2.4 组织病理学检测
高脂饮食饲喂结束后,取小鼠肝和白色脂肪组织,4%甲醛固定,常规石蜡包埋,制作石蜡切片(4 μm),HE 染色后,10 × 20 倍镜下观察肝、脂肪细胞形态,用Image J 软件分析脂肪细胞大小。
1.3 统计学分析
2 结果
2.1 巨噬细胞MED1 敲除(MED1ΔMac)小鼠模型构建
为了确定MED1 在胰岛素抵抗发生中的调控作用,我们构建了MED1ΔMac模型鼠。具体构建过程为:将8 周龄左右MED1fl/fl小鼠与Lyz2-Cre 小鼠进行交配,获得MED1fl/+/Lyz2-Cre+/-杂合小鼠,此小鼠再与MED1fl/+/Lyz2-Cre-/-小鼠杂交,筛选获得MED1ΔMac小鼠。以子代小鼠尾巴基因组DNA 为模板,运用loxP 引物进行PCR 扩增,获得的1.8 kb 片段代表筛选出的小鼠均带有两个loxP 位点,2.0 kb片段代表野生型小鼠,若同时出现1.8 kb 和2.0 kb条带,则代表杂合小鼠。运用Cre 引物进行扩增获得700 bp 的片段,表明筛选出的小鼠是Cre 阳性(+)(图1A)。如果小鼠携带fl/fl 位点,同时Cre 阳性,则表明巨噬细胞 MED1 基因被敲除,即MED1ΔMac小鼠。为进一步确定巨噬细胞MED1 的敲除效率,我们分别从mRNA 水平检测MED1 的表达。分离培养MED1fl/fl和MED1ΔMac小鼠腹腔巨噬细胞,提取总RNA,RT-PCR 结果表明,与MED1fl/fl小鼠相比,MED1ΔMac小鼠巨噬细胞中MED1 mRNA 表达水平显著降低(P<0.05)(图1B)。以上实验结果表明,MED1ΔMac小鼠模型构建成功,为后续功能学实验研究奠定了坚实的基础。
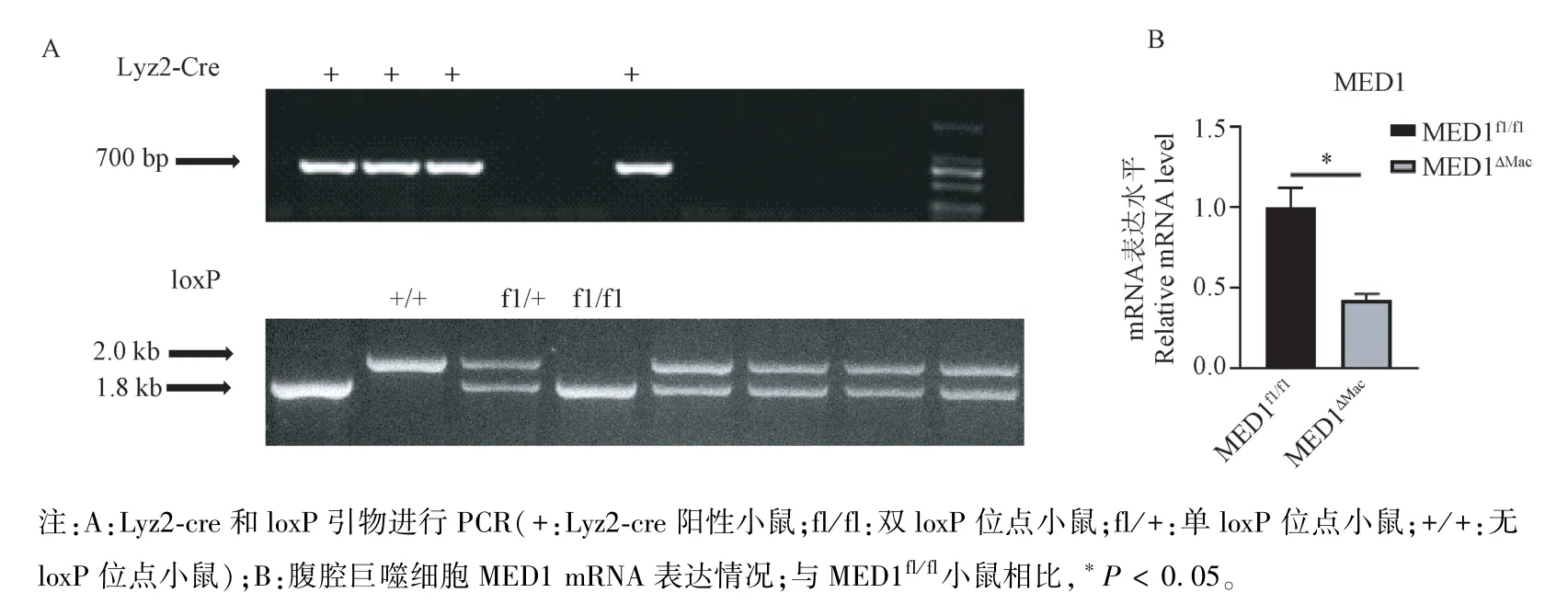
图1 巨噬细胞MED1 敲除小鼠基因型鉴定Note.A.PCR Genotyping of MED1fl/fl and MED1ΔMacmice using Lyz2-cre and loxP primer (+.Lyz2-cre positive mice.fl/fl.Double loxP locus mice.fl/+.Single loxP locus mice.+/+.loxP free mice).B.Statistical analysis of expression of MED1 in peritoneal macrophage by RT-PCR.Compare with MED1fl/flmice,*P <0.05.Figure 1 Genotyping of macrophage-specific MED1 knockout mice
2.2 巨噬细胞MED1 参与血糖调控,但不影响胰岛素抗性
选用8 周龄MED1fl/fl和MED1ΔMac雄性小鼠为模型,分别给予高脂饮食0、4、8、12、16 和20 周,诱导小鼠肥胖发生。在高脂饮食饲喂的不同时期,动态检测体重、TG、TC 和血糖水平。从图2 可以看出,高脂饮食饲喂后,与MED1fl/fl小鼠相比,MED1ΔMac小鼠体重有升高的趋势,但无显著性差异,且两组小鼠血浆TC 和TG 无差异。两组小鼠血糖在高脂饮食饲喂的0、4、8、12 和16 周均无明显差异,但在20 周时,MED1ΔMac小鼠血糖显著升高(P<0.01)(图2),而且,MED1ΔMac小鼠肝重量、皮下脂肪和内脏脂肪均有增加趋势(图3)。然而,进一步葡萄糖耐受性试验和胰岛素耐受性试验表明,两组小鼠的葡萄耐受性和胰岛素敏感性无明显差异(图4)。

图2 高脂饮食诱导下巨噬细胞MED1 缺失小鼠体重、血糖和TC、TG 变化Note.MED1fl/fl.Wild-type mice.MED1△Mac.MED1 knockout mice.Compared with MED1fl/fl mice,**P <0.01.Figure 2 Changes in body weight,blood glucose,TC and TG of macrophage-specific MED1 knockout mice induced by HFD

图3 HFD 饲喂20 周后巨噬细胞MED1 缺失小鼠肝和脂肪重量Figure 3 Liver and fat weight of macrophage-specific MED1 knockout mice after 20 weeks of HFD feeding

图4 HFD 饲喂20 周后巨噬细胞MED1 缺失小鼠GTT 和ITT 测定Figure 4 Determination of GTT and ITT of macrophage-specific MED1 knockout mice after 20 weeks of HFD feeding
2.3 巨噬细胞MED1 缺失促进肝脂肪变性、内脏脂肪细胞扩张
为评估巨噬细胞MED1 缺失对肝脂肪变性的作用,在HFD 20 周后处理小鼠,肝石蜡切片进行HE染色,结果表明,喂食HFD 的MED1fl/fl小鼠的肝细胞被大的细胞质脂质液滴扩张,而这种效应在喂食HFD 的MED1ΔMac小鼠中更为明显(见图5)。

图5 小鼠肝切片HE 染色Figure 5 HE staining of mouse liver tissue
同时为了评估巨噬细胞MED1 敲除对脂肪组织炎性细胞浸润的影响,我们在皮下脂肪组织(sWAT)、内脏脂肪组织(gWAT)石蜡切片进行HE染色,研究结果表明,无论是皮下脂肪组织还是内脏脂肪组织,喂食HFD 的MED1ΔMac小鼠与其对照组相比有巨噬细胞积累但并未看到明显巨噬细胞浸润(图6A),而MED1ΔMac小鼠内脏脂肪细胞面积更大,小鼠皮下脂肪细胞大小未见明显差异(图6B)。
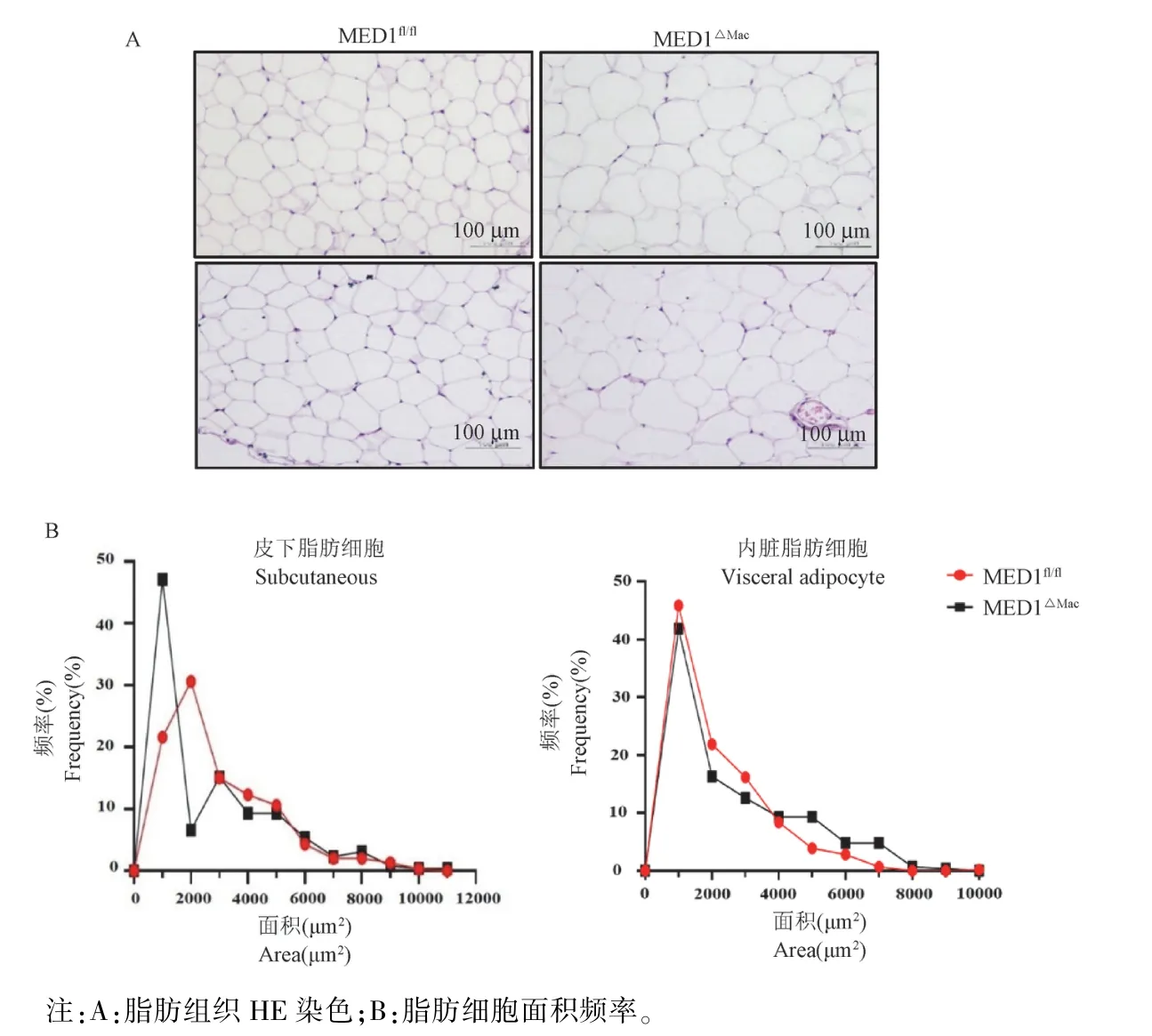
图6 HFD 饲喂20 周后MED1fl/fl和MED1△Mac小鼠内脏、皮下脂肪HE 染色及脂肪细胞大小分布Note.A.HE staining of fat tissue.B.Adipocyte area frequency.Figure 6 HE staining of fat tissue and adipocyte size distribution in MED1 fl/fl and MED1△Mac mice after 20 weeks of HFD feeding
3 讨论
近年来,肥胖是导致胰岛素抵抗的主要危险因素,肥胖与脂肪细胞功能紊乱、巨噬细胞浸润和轻度炎症有关。脂肪组织合成并分泌多种生物活性分子,即脂肪因子和细胞因子,它们影响脂质和葡萄糖的代谢。有研究表明,胰岛素抵抗程度会由于血清脂肪酸代谢作用的不同而变化[10]。根据资料显示,具有生物活性的脂质分子:长链酰基辅酶A、神经酰胺和二酰甘油,这些脂质在脂肪细胞中的积累可能与胰岛素抵抗的发生有关[11]。目前认为,巨噬细胞在诱导胰岛素抵抗病理过程中扮演重要角色。巨噬细胞是一种具有高度可塑性和异质性的细胞群体,在体内外不同微环境细胞因子和微生物产物的影响下可表现出不同的表型和功能。根据活化状态和功能不同,主要分为M1 型和M2 型[12]。M1 和M2 型巨噬细胞在肥胖诱导胰岛素抵抗的发生、发展中分别起到促进和抑制的作用。M1 型巨噬细胞浸润脂肪组织,促炎症反应因子如TNF-α、IL-6 等释放增多,使机体所处于的低度慢性炎症状态,通过胰岛素干扰信号传导通路引起肝、骨骼肌及脂肪组织的胰岛素抵抗。
MED1 是转录调控复合物的关键辅激活因子,其调控多个基因表达,亦是组织中脂质和能量代谢的关键调控者。本课题组前期发现肝MED1 特异性敲除(MED1ΔLiv)小鼠能够抵抗高脂饮食和PPARγ诱导的脂肪肝形成,增强胰岛素敏感性。有研究报道骨骼肌MED1 特异敲除小鼠葡萄糖耐受性和胰岛素敏感性均增强,能够抵抗高脂饮食诱导的肥胖[7]。而本研究中,我们发现巨噬细胞MED1 特异性敲除小鼠对胰岛素的敏感性并没有增强,可能是MED1 在不同细胞的功能差异引起,具体机制还需进一步研究解析。
MED1 是PPARs 的关键辅激活子,PPARα 激动剂能减缓NAFLD 大鼠脂质代谢失调,具有适度的胰岛素增敏作用[13]。Jia 等[14]研究发现,与PPARα缺失表型相似,肝实质细胞MED1 缺失导致脂肪酸氧化代谢相关基因的表达受到严重阻滞。肝MED1缺失能够减弱糖皮质激素受体激活剂诱导的肝细胞脂肪变性[15]。在本研究中,我们试图确定巨噬细胞MED1 缺失是否影响胰岛素抵抗,在巨噬细胞MED1 缺失时,通过生理状态下肥胖导致的慢性炎症来探究对胰岛素抵抗的影响。通过HFD 饲喂,巨噬细胞MED1 缺失小鼠更能表现出肥胖、血浆胆固醇和甘油三酯水平的升高,葡萄糖耐量和胰岛素耐量的受损,尽管两组之间的差异并不显著,但仍可提示巨噬细胞MED1 缺失在胰岛素抵抗中发挥的作用,而结果不显著可能与生理状态下肥胖导致的免疫细胞募集较慢产生的慢性炎症有关,因此可能没有较多的巨噬细胞浸润,我们可以尝试用注射脂多糖诱发小鼠快速炎症反应来观察巨噬细胞MED1 缺失后对靶组织的作用;而对于靶组织而言,在HFD喂养下主要表现为肥胖和巨噬细胞浸润,这点在肝组织中较为明显,因此,当巨噬细胞MED1 缺失后,可能促进了胰岛素抵抗的发生发展。
本研究以巨噬细胞MED1 特异性敲除小鼠为动物模型,发现巨噬细胞缺失MED1 引起HFD 诱导的血糖水平升高,肝脂肪变性和脂肪细胞增大,但无显著胰岛素抵抗,为后续MED1 功能解析和巨噬细胞介导的肥胖性炎症研究提供参考。