早期肝细胞癌根治术后复发相关危险因素的临床研究
2022-05-28林春城
林春城
泉州市第一医院肝胆外科,福建泉州 362000
肝 细 胞 癌(hepatocellular carcinoma,HCC)在 我国高发,对于早期HCC来说,手术切除、消融及肝移植是三大根治性治疗方式[1-2]。肝移植受肝源短缺的限制无法在临床大量广泛应用,因此,目前在临床,手术切除和消融是早期HCC的主要治疗方式[3-4]。手术、消融和肝移植是HCC的三大根治性治疗手段,早期HCC患者经根治性治疗后,5年生存率可达60%~80%,但同时5年内复发率可达70%[5-6]。该研究回顾性地收集了2010年6月—2018年12月于该院接受手术切除或消融治疗的符合纳入标准的132例HCC患者的临床信息,主要探讨早期HCC根治性治疗后复发的危险因素,并探讨不同治疗方式术后复发危险因素的异同,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院接受手术切除或消融的132例HCC患者进行回顾性定量分析。纳入标准:①病理或临床确诊的未接受任何治疗的单发HCC;②BCLC 0或A期;③Child-pugh A或B级,PS 0或1;④患者接受根治性治疗(超声引导经皮消融或外科手术切除),消融组患者获得完全消融且随访过程中无局部肿瘤进展;⑤患者能按计划随访且随访>2年。排除标准:①患者同时合并其他部位恶性肿瘤;②PT>21 s或PLT<50×109。HCC的诊断标准参照相关文献[2]。该研究为回顾性队列研究,已通过泉州市第一医院医院伦理委员会审查及批准,并获得了知情豁免。
1.2 方法
经皮消融和外科手术切除的选择根据患者的意愿并经多学科患者讨论决定。经皮消融采用Cool-Tip射频治疗系统(valleylabtm,boulder,co,USA),电极针为中空冷却裸露2 cm或3 cm的17 G Cool-tip电极,最高功率200 W;或UMC-1 MW微波消融系统(航天工业总公司与北京301医院联合研制),微波频率2 450 MHz,微波天线16 G。消融时患者取仰卧位,采用芬太尼及氟哌利多静脉镇痛,同时在进针部位采用2%利多卡因局部注射。超声引导下将消融电极穿刺至肿瘤底部。穿刺点数及能量释放次数依据肿瘤大小而定,重复穿刺直至肿瘤被气体完全覆盖并获得至少0.5~1.0 cm的安全边缘。外科手术切除采用开腹或腔镜下切除,完整切除肿瘤并获得0.5~1.0 cm的安全边缘。
1.3 观察指标
消融术后1个月评估消融疗效,完全消融标准:CECT/CEMRI显示三期均为无增强。完全消融及手术切除患者术后前两年每3个月复查一次,两年后每半年复查一次,复查检查项目包括肿瘤标记物,肝功能及普通超声检查,检查提示可疑复发时,进行CECT/CEMRI检查。肿瘤局部进展定义为完全消融后,随访过程中距离消融灶1.0 cm内再次出现肿瘤病灶(增强影像学上动脉期高增强,延迟期消退为低增强)。肝内新发病灶定义为随访过程中肝内出现肿瘤病灶且病灶≥1.0 cm。所有患者随访至2020年12月。
收集患者的性别、年龄、肝炎背景、肿瘤大小、术前Child-pugh分级、AFP水平、BCLC分期和术后肝内复发时间。将术后复发情况分为:①无复发组;②短期复发:有复发且复发时间≤24月;③长期复发:有复发且复发时间>24个月。
1.4 统计方法
采用SPSS 19.0统计学软件进行数据分析,计量资料以(±s)表示,符合正态分布的变量采用t检验,不符合正态分布的变量采用非参数检验(Mann-Whitney U秩和检验)。计数资料以频数或率(%)表示,采用χ2检验或Fisher精确检验。Cox regression回归分析筛选与肝内无瘤生存的相关危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组基本资料对比
共有132例患者纳入该研究,其中男115例,女17例;年龄21~79岁,平均(53.0±12.3)岁;病灶大小1.3~5.0 cm,平均(3.1±1.1)cm;Child-pugh A级128例,B级4例;无肝炎背景4例,乙肝124例,丙肝4例。消融组和手术组各66例,消融组患者38经病理确诊,28例经临床确诊,手术组患者均为病理确诊。消融组和手术组患者的病灶大小、BCLC分期、性别、年龄、肝炎背景、术前Child-pugh分级、AFP水平对比,差异无统计学意义(P>0.05)。见表1、表2。
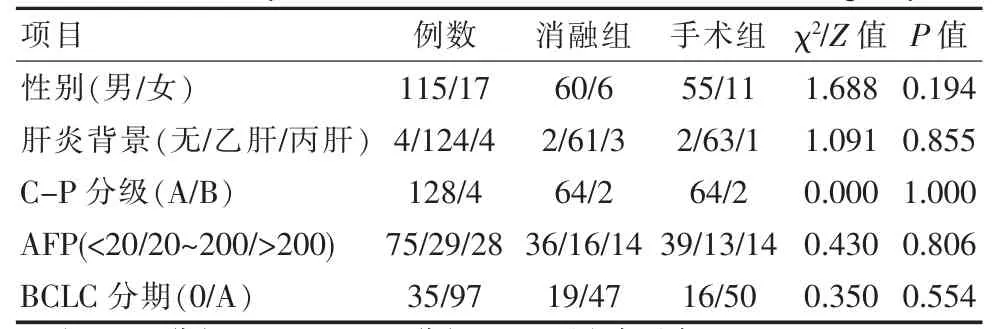
表1 两组计数资料对比Table 1 Comparison of count data between the two groups
表2 两组计量资料对比(±s)Table 2 Comparison of measurement data between the two group(±s)

表2 两组计量资料对比(±s)Table 2 Comparison of measurement data between the two group(±s)
?
2.2 生存曲线分析
直至随访结束,共有66例(66/132,50.0%)患者出现肝内新发病灶,中位肝内无瘤生存时间58.1个月(范围:3.1~96.3个月;75%四分位数:23.4个月),见图1。消融组、手术组分别有30例(30/66,45.5%)、36例(36/66,54.5%)患者出现肝内新发病灶,两组复发人数对比差异无统计学意义(χ2=1.091,P=0.296)。消融组、手术组中位肝内无瘤生存时间分别为58.8个月(范围:7.7~96.3个月;75%四分位数:25.2个月)、58.1个月(范围:3.1~81.2个月;75%四分位数:18.0个月),见图2。
2.3 两组患者术后复发情况对比
消融组复发率、复发时间与手术组对比,差异无统计学意义(P>0.05)。见表3。
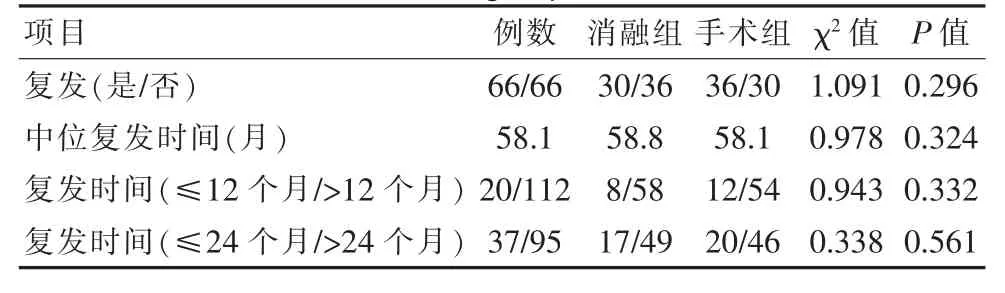
表3 两组患者术后复发情况对比Table 3 Comparison of postoperative recurrence between the two groups
2.4 术后肝内无瘤生存的相关危险因素分析
将性别、年龄、肝炎背景、肿瘤大小、术前Childpugh分级、AFP水平、BCLC分期均纳入分析。在所有HCC中,根治性治疗后肝内无瘤生存的相关危险因素为BCLC分期(Z=8.76,P=0.003,HR=5.66)。
HCC消融术后肝内无瘤生存的相关危险因素为肝炎背景(Z=7.02,P=0.008,HR=2.57)、BCLC分期(Z=4.39,P=0.038,HR=3.33)。HCC切除术后肝内无瘤生存的相关危险因素为AFP(Z=6.51,P=0.012,HR=1.20)、术前Child-pugh分级(Z=6.91,P=0.009,HR=8.97)、BCLC分期(Z=4.66,P=0.035,HR=10.99)。术后肝内无瘤生存的相关危险因素。见表4。
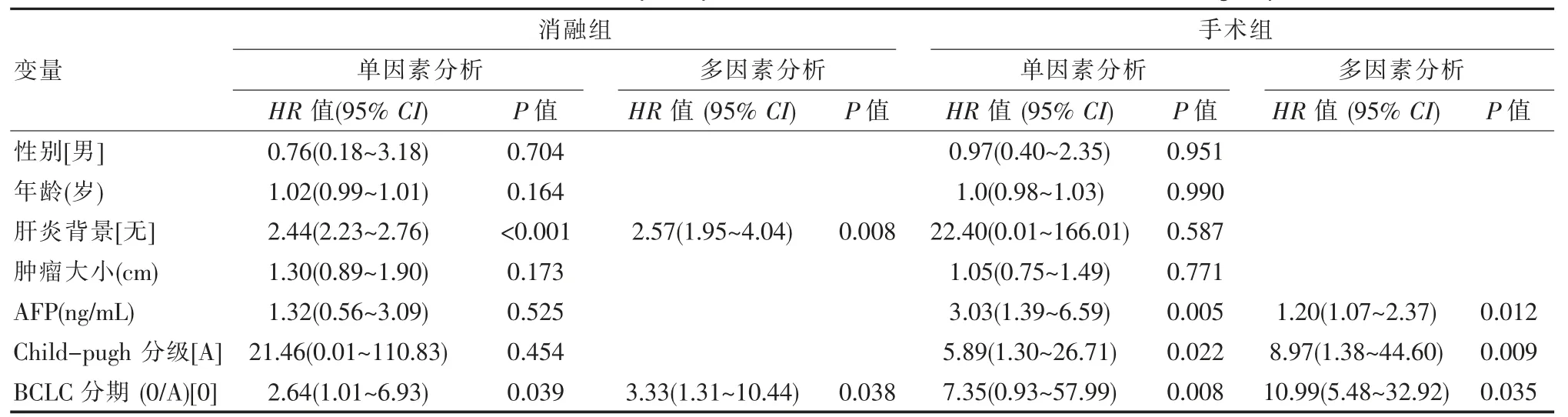
表4 两组术后肝内无瘤生存的相关危险因素Table 4 Related risk factors for postoperative tumor-free survival between the two groups
3 讨论
肝细胞癌(hepatocellular caicinoma,HCC)是常见的恶性肿瘤之一,其发病率在我国位于第3位,每年病死率在男性患者中排第2位,女性患者中排第6位,术后复发是导致患者死亡的主要原因[7-8]。因此分析早期预测HCC术后复发的相关危险因素,以对HCC提供针对性、个性化治疗及随访方案至关重要[9]。该研究显示,对于所有早期HCC而言,接受根治性治疗(手术或消融)后,其肝内无瘤生存的危险因素为BCLC分期,说明肿瘤分期对于HCC根治性治疗后预后的重要性。肿瘤的复发与转移是多种因素作用的结果,该研究同时也分析了其他临床指标以及不同治疗方式对术后复发的影响[10-12]。
对于不同治疗方式而言,其肝内无瘤生存的独立危险因素有所不同[13-15]。HCC消融术后肝内无瘤生存的危险因素为BCLC分期和肝炎背景,而HCC切除术后肝内无瘤生存的危险因素为AFP、术前Child-pugh分级和BCLC分期,这与既往的研究结果类似[16-17]。该研究显示,对于所有早期HCC而言,接受根治性治疗(手术或消融)后,其肝内无瘤生存的危险因素为BCLC分期,说明肿瘤分期对于HCC根治性治疗后预后的重要性。从该研究可以看到,根据不同治疗方式进行分组后,BCLC分期仍是消融或手术组术后肝内无瘤生存的危险因素,但在消融组中,肝炎背景也是术后肝内无瘤生存的危险因素,而对手术组的分析则发现AFP、术前Child-pugh分级也是术后肝内无瘤生存的危险因素,可见早期HCC接受不同根治性治疗后其术后复发的危险因素有所不同,提示在临床实践中,接受不同治疗方式的患者,需要关注的重点临床资料有所不同[13-14]。
该文研究结果显示:共有132例患者纳入该研究,消融组和手术组各66例,消融组和手术组患者的基线资料差异无统计学意义(P>0.05)。直至随访结束,共有66例(66/132,50.0%)患者出现肝内新发病灶,中位肝内无瘤生存时间58.1个月,消融组和手术组的中位生存时间分别为58.8个月和58.1个月,消融组和手术组肝内无瘤生存曲线差异无统计学意义(P=0.396)。HCC根治术后肝内无瘤生存的相关危险因素BCLC分期(Z=8.76,P=0.003,HR=2.66)。消融组术后肝内无瘤生存的相关危险因素为肝炎背景(Z=7.02,P=0.008,HR=2.57)、BCLC分期(Z=4.39,P=0.038,HR=3.33)。手术组术后肝内无瘤生存的相关危险因素为AFP(Z=6.51,P=0.012,HR=1.20)、术前Child-pugh分级(Z=6.91,P=0.009,HR=8.97)、BCLC分期(Z=4.66,P=0.035,HR=10.99),AFP水平是影响HCC根治术后复发的影响因素。这与商晓莎等[14]的研究“AFP≥200μg/L及CT征象(环形强化、肿瘤边缘不规则、TTPVI),是HCC患者术后早期复发的独立危险因素”结论一致(肿瘤病灶数目是BCLC分期的重要参考指标)。AFP水平是影响HCC根治术后复发的影响因素,这与该研究结论一致。HCC的复发与转移是多种因素作用的结果[15-16],该研究与多项早期研究的结论不同之处,主要原因为纳入数据分析的临床指标选取不同、以及HCC复发随访时间的不同所致。
可以看到,根据不同治疗方式进行分组后,BCLC分期仍是消融或手术组术后肝内无瘤生存的危险因素,但在消融组中,肝炎背景也是术后肝内无瘤生存的危险因素,而对手术组的分析则发现AFP、术前Child-pugh分级也是术后肝内无瘤生存的危险因素,可见早期HCC接受不同根治性治疗后其术后复发的危险因素有所不同,提示在临床实践中,接受不同治疗方式的患者,需要关注的重点临床资料有所不同[17]。该研究的不足在于:①该研究为回顾性研究,资料收集过程中的信息偏倚有可能会对结果产生影响;②该文纳入的患者肝功能分级几乎均为Child-pugh A级患者,这可能对分析与复发的关系造成影响。
综上所述,BCLC分期是HCC根治术后肝内无瘤生存的独立危险因素,不同治疗方式(消融或手术)其术后复发的危险因素有所不同。HCC消融术后肝内无瘤生存的危险因素为BCLC分期和肝炎背景,而HCC切除术后肝内无瘤生存的危险因素为AFP、术前Child-pugh分级和BCLC分期,可为临床实践提供参考。
