健康与患根腐病草莓根际、非根际及根内细菌群落多样性
2022-05-28戴瑞卿赖宝春曾天宝吴振强王家瑞
戴瑞卿,赖宝春,曾天宝,吴振强,王家瑞
(福建省漳州市农业科学研究所,福建 漳州 363005)
【研究意义】草莓(FragariaananassaDuch)为蔷薇科多年生草本植物,营养丰富、经济价值高,是我国重要的水果之一,近年来,草莓根部病害日益严重,草莓根腐病已成为最重要的病害之一,制约着草莓种植业的发展[1]。草莓根腐病是一种真菌引起的典型土传根部病害,引起该病的病原菌达20种之多,主要有丝核菌属(Rhizoctoniaspp)[2]、镰刀菌属(Fusariumsp.)[3]、拟盘多毛孢属(Pestalotiopsissp.)[4]、疫霉属(Phytophthorasp.)[5]等。病原真菌复合侵染引起的草莓根腐病发病率高,防治困难,对草莓的种植生产造成巨大的损失[6]。研究表明微生物肥料可有效改善土壤微生物区系,降低草莓根腐病的发病率,提高草莓的产量和品质[7]。杨敬辉等[8]从草莓根围分离筛选获得24株对草莓根腐病、草莓疫病和草莓枯萎病具有拮抗活性的细菌,其中包含芽孢杆菌、假单胞菌和伯克氏菌等优势种群。沈婷[9]研究发现生防放线菌B04对草莓根腐病具有较好的防治效果,通过施用生防菌剂B04,促使草莓根际土壤有益微生物多样性增加,抑制病原菌生长,降低草莓根腐病的发病率。因此,分析健康与患根腐病草莓根际土壤、非根际土壤及根内细菌群落结构与多样性,对研发草莓根腐病生防菌剂及促进草莓产业的健康发展具有重要意义。【前人研究进展】赵帆等[10]对不同地区草莓根际土壤微生物群落组成进行分析,草莓根际土壤的优势细菌门为变形菌门、厚壁菌门、放线菌门、酸杆菌门和绿弯菌门,根际土壤的理化指标均与优势菌门存在密切的关系。杨俊誉等[11]分析比较患白粉病与健康草莓根际土壤细菌群落结构与多样性,发现患白粉病草莓根际土壤细菌群落多样性显著低于健康草莓。肖蓉等[12]运用高通量测序技术比较分析患炭疽病与健康草莓根际土壤细菌群落多样性,发现健康草莓根际土壤细菌丰富度及多样性均高于患炭疽病草莓,健康土壤中的有益微生物群落相对丰度高于患炭疽病土壤。【本研究切入点】目前有关根腐病菌侵染草莓植株后,其根际土壤、非根际土壤及根内细菌群落结构与多样性的变化鲜见报道。高通量测序具有高通量、高灵敏度、高准确性等特点,是目前研究环境微生物多样性的重要技术手段,已广泛用于土壤、水体、肠道等微生态系统的微生物多样性研究,可以更加准确、全面地反映样本的微生物群落结构[13-15]。【拟解决的关键问题】本研究采用Illumina MiSeq高通量测序技术,对健康与患根腐病草莓根际土壤、非根际土壤及根内细菌群落结构与多样性进行系统分析,探明其与草莓根腐病发生的关系,为草莓根腐病的生物防治提供理论依据。
1 材料与方法
1.1 供试材料
于2020年3月从福建省漳州市颜厝镇草莓种植基地(39°91′1′′N,116°41′3′′E),选取草莓根腐病爆发严重的草莓田采集样品。样品分为6组,每组样品3次生物学重复:①患根腐病草莓根际土壤组DJ(编号为DJ1,DJ2,DJ3);②患根腐病草莓非根际土壤组DQ(编号为DQ1,DQ2,DQ3);③患根腐病草莓根内组DG(编号为DG1,DG2,DG3);④健康草莓根际土壤组HJ(编号为HJ1,HJ2,HJ3);⑤健康草莓非根际土壤组HQ(编号为HQ1,HQ2,HQ3);⑥健康草莓根内组HG(编号为HG1,HG2,HG3)。五点取样法采样,选取5株根腐病发病严重的草莓植株,去除植株残枝及地表土壤,再将草莓植株连同根部土壤一同拔出,去除植株主体土,抖落并收集须根2 mm范围的土壤样品,充分混匀,为患根腐病草莓根际土壤样品;于根际土壤相同位点采集5~20 cm的耕作层土壤,充分混匀,为患根腐病草莓非根际土壤样品;五点取样的患根腐病草莓根系表面泥土用无菌水洗净后,无菌纸吸干,用剪刀(酒精消毒)剪取草莓根内发病部位5 cm样品,充分混匀,为患根腐病草莓根内样品。参照上述方法选取健康草莓植株,分别采集健康根际土壤、健康非根际土壤和健康根内样品。所有样品置入低温保藏箱,并迅速带回实验室,-80 ℃冰箱保存、备用。
1.2 试验方法
1.2.1 样品DNA提取 样品DNA提取由生工生物工程(上海)股份有限公司提供。土壤DNA样品参照E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒(Omega,M5635-02)操作说明进行抽提。根内DNA样品参照DNeasy Plant miniKit试剂盒(Qiagen,69104)操作说明进行抽提。用琼脂糖凝胶电泳检测DNA完整性,Qubit 3.0 DNA检测试剂盒(Life,Q10212)定量检测DNA样本浓度。
1.2.2 16S rDNA文库构建及测序 以样品DNA为模板,采用16S rDNA V3~V4区的通用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)扩增目标片段。PCR扩增体系:2×Hieff Robust PCR Master Mix 15 μL,引物341F和805R(10 μmol/L)各1 μL,模板DNA 10~20 ng,加双蒸水至30 μL。PCR反应程序:94 ℃预变性3 min;5个循环(94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s),20个循环(94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s),最后72 ℃延伸5 min,10 ℃保存。使用AxyPrepDNA凝胶回收试剂盒(AXYGEN,AP-GX-50G)切胶回收PCR产物,用Qubit43.0荧光定量仪(Invitrogen,Q32866)进行16S rDNA文库浓度测定,按1∶1等量混合后,采用Illumina公司的Hiseq 2500 平台测序进行高通量测序。
1.2.3 测序数据处理与分析 对Illumina Miseq测序获得的序列进行质控和过滤:首先使用Cutadapt软件(version 1.18)去除引物接头序列,再根据PE reads之间的overlap关系,使用PEAR软件(version 0.9.8)将成对的reads拼接(merge)成一条序列,然后按照barcode标签序列识别并区分样品得到各样本数据,最后使用PRINSEQ软件(version 0.20.4)切除reads尾部质量值20以下的碱基,过滤掉低复杂度的序列。利用Usearch软件(version 11.0.667),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。采用RDP classifier贝叶斯算法(version 2.12)对97%相似度水平的OTU代表序列进行分类学分析,并在门纲目科属水平,统计各个样品的菌落组成。对样品进行Alpha多样性分析、物种组成及差异分析等。使用R软件绘制稀释曲线图、相对丰度热图、样本距离热图、PCoA图等。
2 结果与分析
2.1 数据质控及序列测序深度分析
原始数据经质控处理后,患草莓根腐病组的9个样本共获得606 491条高质量序列片段,单一样本序列数为51 086~80 087条,序列平均长度为417 bp;健康草莓组9个样品共获得639 908条高质量序列片段,单一样品序列数为58 375~76 361条,序列平均长度为415 bp。稀释曲线(Rarefaction curve)分析显示,本研究6组18个样品在测序深度为20 000时曲线达到平台,说明测序深度已反映了样品中95%以上的细菌种,可满足样品间细菌群落结构的对比分析(图1)。
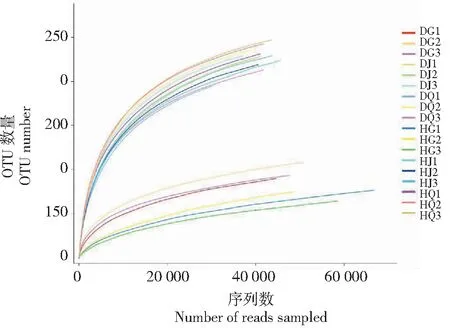
图1 稀释曲线
2.2 多样性指数分析
Ace、Chao1指数用来表示样品细菌群落丰富度;Shannon、Simpson指数用于表示样品细菌群落多样性;Shannoneven指数用于表示样品细菌群落均匀度;Coverage指数用于表示样品测序的覆盖度。其中,Simpson指数值越大,说明群落多样性越低,其余指数值越大,说明相应的群落丰富度、多样性和均匀度越高。
由表1可知,所有样品覆盖率指数(Coverage index)均在0.98 以上,说明本次测序结果能够代表样本的真实情况,测序结果合理。Alpha多样性指数分析表明,患根腐病组草莓根际土壤和根内样品细菌群落丰富度、多样性和均匀度均高于健康草莓,而患根腐病组草莓非根际土壤样品细菌群落丰富度、多样性和均匀度均低于健康草莓样品组。
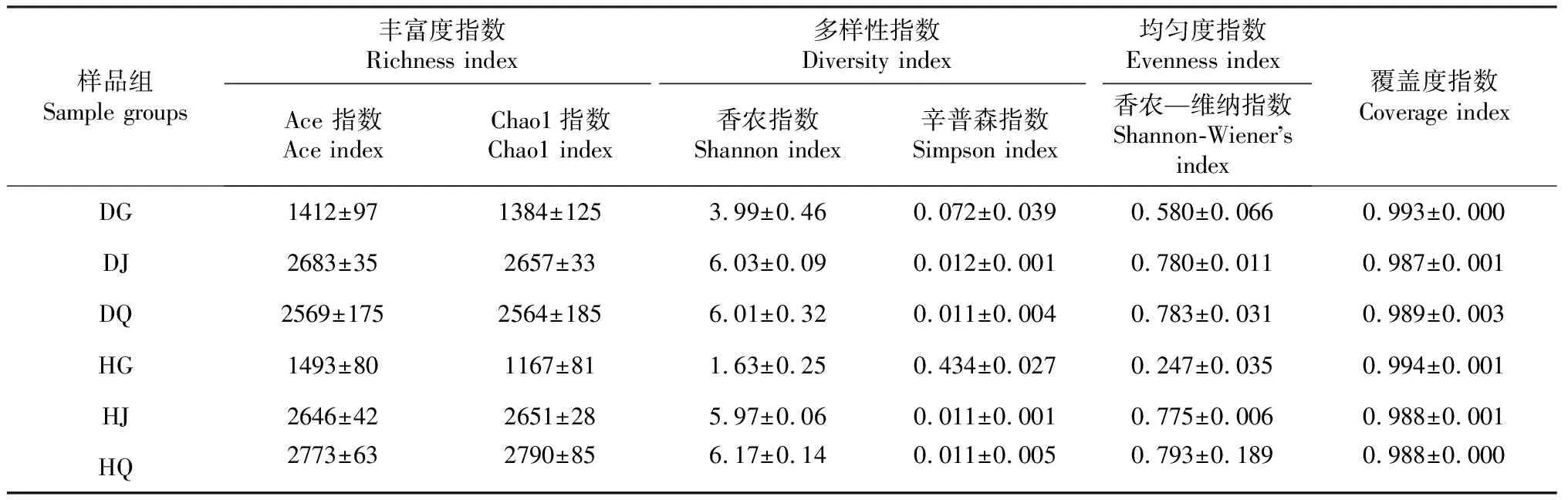
表1 不同组别细菌群落Alpha 多样性指数
2.3 OTU聚类分析
在97%相似度水平对样品序列进行OTU聚类,患根腐病草莓组样品共鉴定出细菌30个门、78个纲、131个目、233个科、483个属、3143个OTU(表2);健康草莓组样品共鉴定出细菌30个门、78个纲、131个目、238个科、489个属、3142个OTU。健康草莓组比患根腐病组多5个科,4个属,少1个OTU。
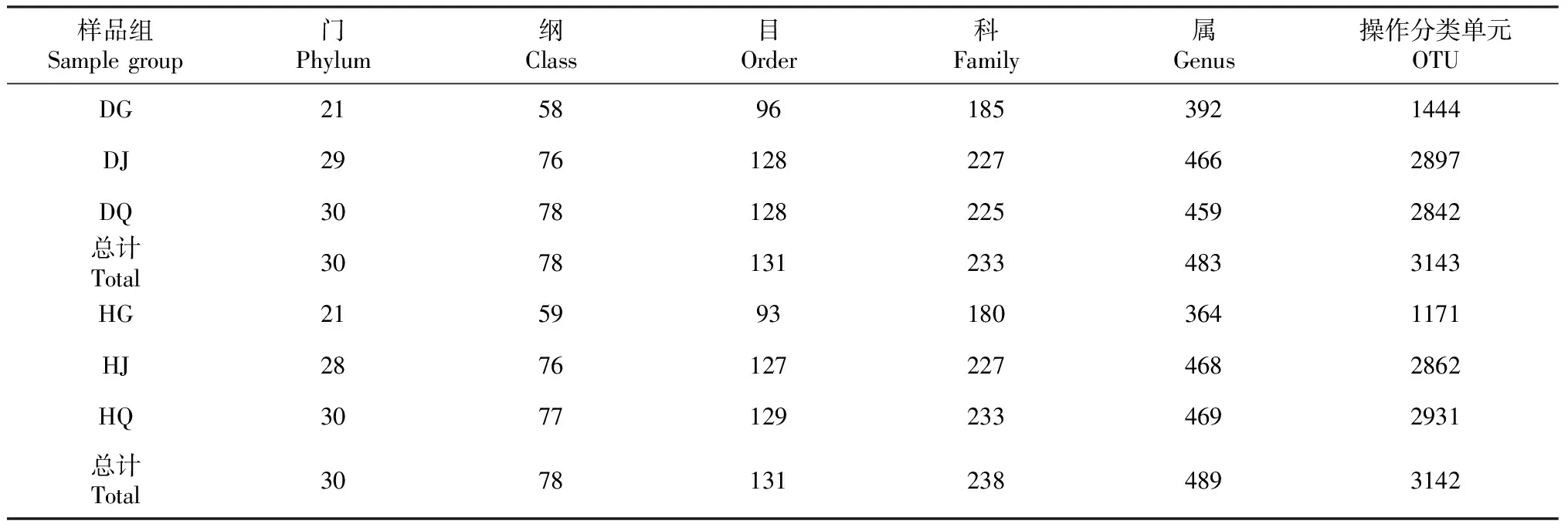
表2 健康与患根腐病草莓不同组别细菌群落不同分类水平数量
2.4 细菌群落组成和结构分析
在门水平,患根腐病组草莓根际土壤相对丰度最高的细菌门为变形菌门(Proteobacteria, 47.54%),其次是拟杆菌门(Bacteroidetes, 15.15%)、酸杆菌门(Acidobacteria, 10.57%)、放线菌门(Actinobacteria, 2.95%)、疣微菌门(Verrucomicrobia, 2.99%)、绿弯菌门(Chloroflexi, 3.05%)和芽单胞菌门(Gemmatimonadetes, 2.37%);患根腐病组草莓非根际土壤相对丰度最高的细菌门为变形菌门(43.03%)、其次是拟杆菌门(19.77%)、酸杆菌门(8.75%)、疣微菌门(4.46%)、绿弯菌门(4.35%)、芽单胞菌门(3.17%)和放线菌门(2.83%);患根腐病组草莓根内样品相对丰度最高的细菌门为变形菌门(54.50 %),其次是蓝细菌门(Cyanobacteria, 20.13%)、拟杆菌门(8.71%)和放线菌门(7.30%)。健康组草莓根际土壤相对丰度最高的细菌门为变形菌门(48.21%),其次是拟杆菌门(10.89%)、酸杆菌门(8.89%)、放线菌门(5.73%)、疣微菌门(4.01%)、芽单胞菌门(3.11%)、绿弯菌门(2.82%)和蓝细菌门(2.04%);健康组草莓非根际土壤相对丰度最高的细菌门为变形菌门(42.84%),其次是酸杆菌门(11.98%)、拟杆菌门(6.75%)、放线菌门(6.00%)、绿弯菌门(5.35%)、芽单胞菌门(4.40%)、疣微菌门(3.45%)和蓝细菌门(2.05%);健康组草莓根内样品相对丰度最高的细菌门为蓝细菌门(62.32%),其次是变形菌门(10.36%)和放线菌门(2.83%, 图2)。
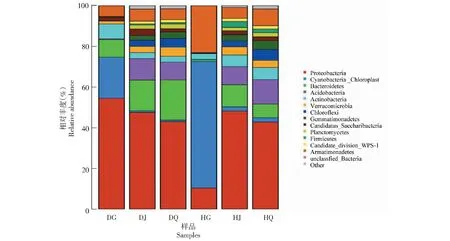
图2 不同组别样品门水平上的相对丰度
在属水平上,患根腐病组草莓根际土壤的主要菌属为鞘氨醇单胞菌属(Sphingomonas, 13.63%)、黄杆菌属(Flavobacterium, 5.86%)、新鞘氨醇杆菌属(Novosphingobium, 4.63%)和芽单胞菌属(Gemmatimonas, 2.36%);患根腐病组草莓非根际土壤的主要菌属为鞘氨醇单胞菌属(8.91%)、黄杆菌属(8.42%)、新鞘氨醇杆菌属(5.80%)、芽单胞菌属(3.17%)和假单胞菌属(Pseudomonas,2.39%);患根腐病组草莓根内样品的主要菌属为链形植物属(Streptophyta, 19.80%)、新鞘氨醇杆菌属(7.69%)、假单胞菌属(5.98%)和黄杆菌属(3.63%)。健康组草莓根际土壤的主要菌属为鞘氨醇单胞菌属(10.04%)、黄杆菌属(4.79%)、链霉菌属(Streptomyces, 4.17%)、新鞘氨醇杆菌属(4.10%)、芽单胞菌属(3.12%)、芽孢杆菌属(Bacillus, 2.58%)和伯克霍尔德菌属(Burkholderia)(2.12%);健康组草莓非根际土壤的主要菌属为鞘氨醇单胞菌属(9.57%)、伯克霍尔德菌属(5.16%)、芽单胞菌属(4.40%)、新鞘氨醇杆菌属(2.92%)和链霉菌属(2.25%);健康草莓根内样品的主要菌属为链形植物属(61.53%)、链霉菌属(1.75%)和黄杆菌属(1.27%, 图3)。
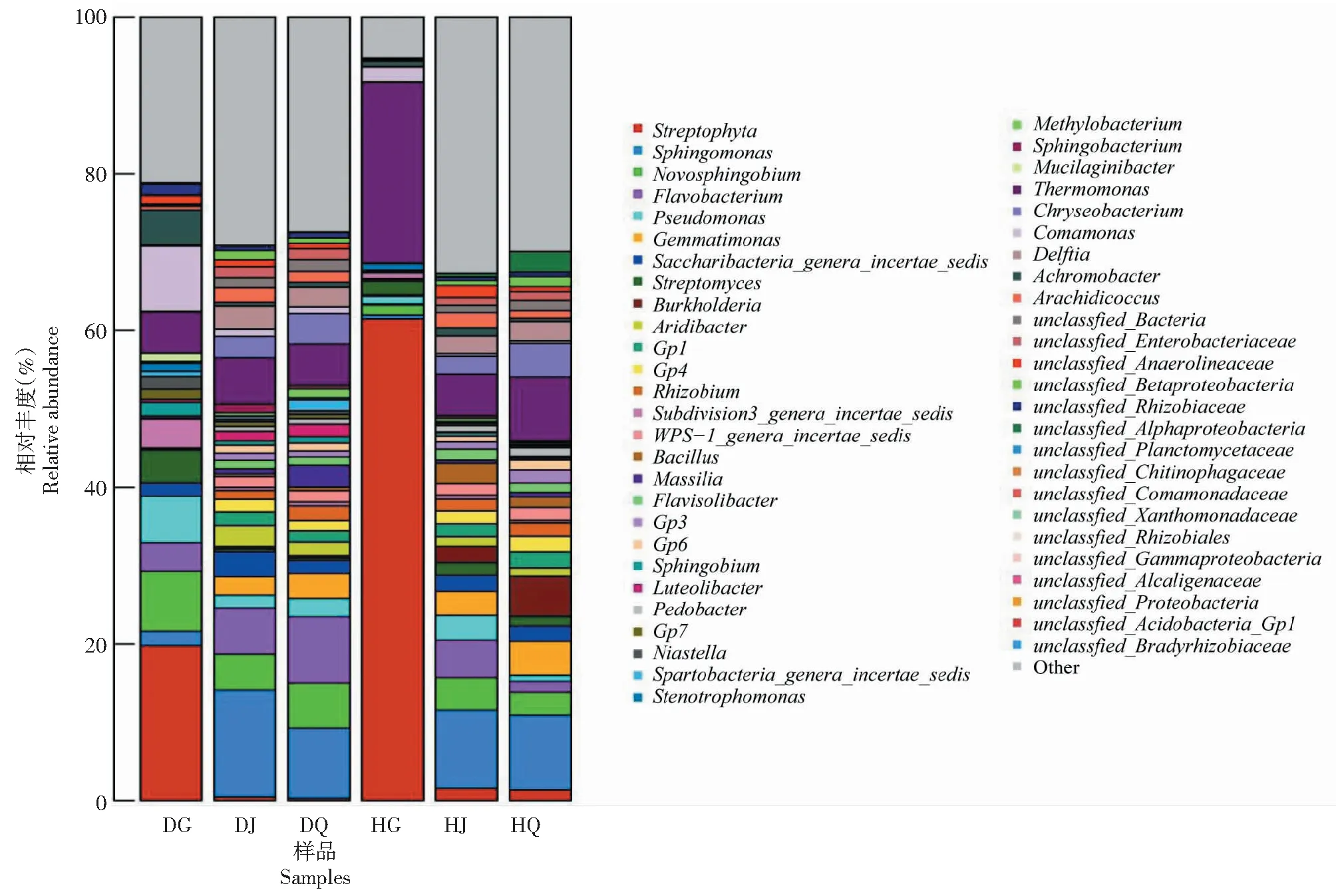
图3 不同组别样品属水平上的相对丰度
丰度热图可通过颜色的变化直观表示出属相对丰度的高低,绘制各样品前50个属的相对丰度热图,如图4所示。通过热图层级聚类树表明,健康草莓根内样品、患根腐病草莓根内样品及其他土壤样品三者的细菌群落结构存在显著性差异,因而被聚集为三大类。健康草莓根内样品HG1、HG2和HG3 3个样品细菌结构较为相似,聚为一类;同样,患根腐病草莓根内样品DG1、DG2和DG3 3个样品细菌结构较为相似,聚为一类;土壤样品中,健康草莓根际土壤HJ1、HJ2、HJ3和患根腐病草莓根际土壤样品DJ1、DJ2、DJ3 以及患根腐病草莓非根际土壤样品DQ2聚为一大类;健康草莓非根际土壤样品HQ1、HQ2、HQ3聚集为一类;而患根腐病草莓非根际土壤样品DQ1、DQ3单独归为一类。
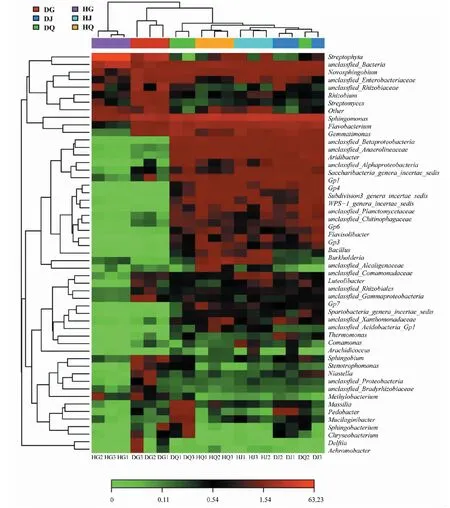
图4 属水平上的相对丰度热图
2.5 样本比较分析
通过绘制OTU水平上的样本距离热图,揭示样本间细菌群落组成的差异,如图5所示。根内样品与土壤样品的样本距离最远,表明土壤与根内样品细菌群落组成差异最大。健康与患根腐病草莓根内样品间差异较大,而健康与患根腐病草莓非根际土壤之间、根际土壤之间细菌群落组成差异较小。健康与患根腐病草莓根际土壤样品间、非根际土壤样品间细菌群落结构差异比根内样品小,二者的主要差异存在草莓根内。

图5 OTU水平样本距离热图
图6表明,发生根腐病后,草莓根内细菌群落产生明显的差异,在成分2作用下能够明显区分出健康与患根腐病草莓的根内样品,说明成分2是草莓根内细菌群落产生差异的主要因素。主成分1能够将草莓根内样品与根际、非根际土壤样品明显区分开,说明主成分1是造成草莓根内与根际、非根际土壤样品细菌群落结构与多样性差异的主要因素。健康与患根腐病草莓根内样品间细菌群落结构差异较大,而根际、非根际土壤样品之间细菌群落结构差异小,说明根腐病发生对于草莓根内细菌群落结构的影响较大。
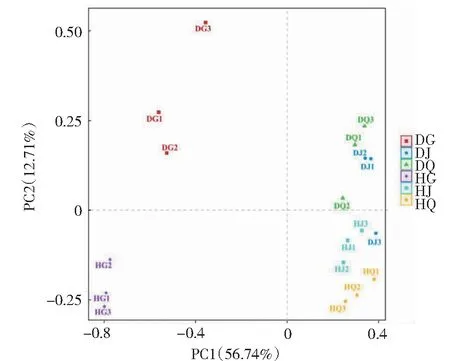
图6 OTU水平主成分分析
3 讨 论
本研究利用Illumina Miseq高通量测序技术,从患根腐病草莓根际土壤、非根际土壤及根内样品获得的高质量序列数为606 491条,比健康草莓样品低33 417条,说明患根腐病草莓根际土壤、非根际土壤及根内样品的细菌数量小于健康草莓样品。前人研究表明,病害的发生与微生物群落结构息息相关,生态系统微生物多样性与系统的结构组成和稳定性成正比,微生物多样性越高的生态系统,植株受到病害侵染的可能性就越低,越能延缓病害的发生[16-18]。本研究OTU聚类分析表明,患根腐病草莓根际非土壤样品细菌OTU种类降低,而根际土壤和根内样品细菌OTU种类升高。Alpha多样性分析表明,患根腐病草莓根际土壤和根内样品细菌群落丰富度、多样性和均匀度均高于健康草莓,说明发生根腐病后,可能导致草莓根际土壤结构及其根内组织被破坏,使外来细菌多样性增加,与前人研究一致[16-17]。患根腐病草莓非根际土壤样品细菌群落丰富度、多样性和均匀度均低于健康草莓,说明健康草莓非根际土壤细菌群落结构优于患根腐病草莓。已有研究表明,土壤微生物多样性对维持土壤健康和抑制植物病害极其重要,土壤微生物多样性的降低是土传病害发生的重要原因[19]。
细菌群落结构组成分析表明,健康与患根腐病草莓根际和非根际土壤的优势菌门均为变形菌门、拟杆菌门、放线菌门、酸杆菌门和绿弯菌门,与赵帆等[10]研究结果一致。患根腐病草莓根际土壤放线菌门相对丰比健康草莓降低2.78%,拟杆菌门相对丰度增加4.26%;患根腐病草莓非根际土壤放线菌门相对丰度比健康草莓降低3.17%,拟杆菌门相对丰度增加13.02%。放线菌门在生态系统中广泛分布,在生物地球化学循环中起着重要的作用,不仅可以抑制植物根际病原菌的生长,还具有聚合物降解,产生多种胞外酶,促进植物生长的作用,其含量高低可作为土壤健康状况的评价指标[20-22]。拟杆菌门是引起土壤烃类污染的主要菌群,其相对含量增加可能引起土壤环境抵抗力下降,增加植物病害发生率[23]。患根腐病后草莓根际和非根际土壤中放线菌门相对丰度降低,拟杆菌门相对丰度增加,表明根腐病菌侵染会引起草莓根际和非根际土壤健康状况下降。健康与患根腐病草莓根内样品的优势菌门主要是变形菌门和蓝细菌门,患根腐病草莓根内变形菌门相对丰度比健康草莓根内增加44.14%,蓝细菌门相对丰度比健康草莓降低42.19%,与前人研究结果一致[17]。变形菌门是最为普遍的细菌种类,同时也包含大量的植物病原菌[22];蓝细菌门分布广泛,种类繁多,为根瘤菌的三大菌门之一,能与植物共生,提高植物根系的固氮能力[24-25]。患根腐病后草莓根内变形菌门和蓝细菌门相对丰度差异显著,表明根腐病菌侵染可能会引起草莓根内有益菌数量下降,病原菌数量增加。
在属水平上,健康与患根腐草莓根际土壤、非根际土壤之间细菌群落差异明显,患根腐病草莓根际、非根际土壤中的新鞘氨醇杆菌属和黄杆菌属相对丰度均高于健康草莓,链霉菌属、伯克霍尔德菌属和芽孢杆菌属的相对丰度均低于健康草莓。土壤中存在许多有益细菌,如链霉菌属具有广谱的抗菌活性[26-27],伯克霍尔德菌属[28-29]在促进植物生长、生物防控及生物降解等方面具有重要作用,芽孢杆菌属能提高土壤氮、磷、钾等养分和有机质的含量,具有促进植物生长、防治植物病虫害的作用[30-31]。本研究中,健康草莓根际、非根际土壤的链霉菌属、伯克霍尔德菌属和芽孢杆菌属的相对丰度均高于患根腐病草莓,说明土壤中有益细菌数量与草莓生长状况密切相关。健康与患根腐病草莓根内样品之间细菌群落差异显著,患根腐病草莓根内的新鞘氨醇杆菌属和假单胞菌属的相对丰度均高于健康草莓,链形植物属的相对丰度比健康草莓降低41.74%。研究表明,三七根腐病由多种病原菌复合侵染引起,其主要病原细菌为假单胞菌属[32]。链形植物属能够适应极端环境,在高温、极寒等逆境中生存,具有多种重要的生态功能[33]。本研究发现患病草莓根内链形植物属相对丰度显著低于健康草莓,而假单胞菌属相对丰度显著高于健康草莓,说明根腐病菌的侵染可能会影响草莓根内有益细菌数量和病原菌数量的变化。
本研究通过Illumina高通量测序技术,明确了根腐病发生对草莓根际、非根际土壤及根内细菌群落结构和多样性的影响,为草莓根腐病的生物防治提供理论依据。草莓根腐病的发生与其根际、非根际土壤及根内细菌群落结构的变化关系密切,尤其是对草莓根内细菌群落结构有较显著的影响,患根腐病草莓根际、非根际土壤及根内有益细菌数量较少,而健康草莓各样品有益细菌较多。链形植物属在健康草莓根内的相对丰度显著高于患根腐病草莓,而假单胞菌属相对丰度显著低于患病草莓,这两个属可能对草莓根腐病的发生有着重要的意义。在后续工作中将从草莓根内组织分离链形植物属和假单胞菌属,研究链形植物属能否促进草莓生长,假单胞菌属是否对草莓致病。链霉菌属、伯克霍尔德菌属和芽孢杆菌属等有益菌属相对丰度在患根腐病草莓土样中显著降低,其可能对草莓根腐病的防治有重要的作用,在后续工作中将进一步从土壤中分离这类有益细菌,并研究其对草莓根腐病菌的生防作用。
4 结 论
草莓植株发生根腐病后,根际土壤和根内细菌群落丰富度和多样性均有提高,而非根际土壤细菌群落丰富度和多样性下降。健康与患根腐病草莓根际、非根际土壤及根内细菌群落组成差异性显著,其中链形植物属、链霉菌属、伯克霍尔德菌属和芽孢杆菌属等可能是防治草莓根腐病的重要菌属。
