斗米虫对腹泻个体血液酶活性及肠道菌数的影响*
2022-05-28何振宇周卫青刘立伟郭钊翔莫云海徐华潮
何振宇,周卫青,刘立伟,郭钊翔,莫云海,徐华潮
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 311300;2.浙江省淳安县林业局,浙江 淳安 311700;3.浙江自然博物院,浙江 杭州 311300)
森林资源是中国生态资源重要的组成部分,第9 次森林资源普查结果显示:中国森林覆盖率达22.9%,森林总面积2.2×108hm2[1]。森林资源包含林地资源、土壤资源和昆虫资源等[2]。其中,昆虫资源具有物种丰富度高、数量多和利用价值好等特性[3]。药用昆虫资源作为昆虫资源的重要分支,具有良好的研究价值和开发前景[4],如蜂类的蜂毒肽与茶多酚的纳米复合物具有协同抗肿瘤作用[5];土鳖虫的活性肽具有降血脂作用[6]。
斗米虫是桑天牛(Apriona germari)和锈色粒肩天牛(A.swainsoni)的全虫幼虫,在中国分布广泛,是常见并具有较强危害的蛀干害虫,但更是一种优良的药用昆虫[7]。早在《中华本草》中就记录了斗米虫具有透疹、增强筋骨和治疗劳伤的药用价值;明朝李时珍所著《本草纲目》典籍中载录食用此虫可治疗小儿疳积和肝硬化等疾病。已有研究显示:斗米虫有一定的体外抗肿瘤活性且具有潜在的免疫调节功效[8];侯沛颖等[9]发现斗米虫蛋白对4T1 荷瘤小鼠有较好的抗肿瘤作用。此外,斗米虫繁殖能力较强,具有人工室内养殖的基础[10]。因此,斗米虫是较为理想的药用昆虫。
病原性腹泻是困扰各年龄段人群的常见疾病[11]。这种病症常因大肠杆菌和沙门氏菌等病菌侵袭肠道引发腹泻,进一步引起水电解质失调、营养不良和心慌气短的症状[12]。一般通过施用抗生素达到治疗目的,其治疗时间短,且效果较为显著[13],但长期滥用抗生素药物会出现很多弊端,如病原物的耐药性增强及污染环境等[14]。
金鑫鑫等[15]研究发现:黄金虫(Musca domestica)虫粉对小鼠肠道炎症有治疗效果;周琼等[16]研究发现:美洲大蠊粉(Periplaneta americana)对小鼠腹泻肠道修复有较好效果。另外,在浙江和江西等地有不少腹泻患者服用斗米虫后病情恢复速度明显加快的案例。因此,本研究在小鼠感染大肠杆菌(Escherichia coli)引发腹泻的基础上,通过在基础饲粮中添加斗米虫,并通过统计其结肠、回肠和盲肠中存在的大肠杆菌总数以及肠道内总菌量,并测定其机体内具有增强创伤伤口愈合能力和确保细胞膜结构完整的抗氧化酶和消化系统内有关酶的活性[17],确定斗米虫对提高试验小鼠抵抗力以及治疗肠道消化分解食物和吸收养分能力的作用,以期为进一步开发利用斗米虫食药用功能提供理论基础。
1 材料与方法
1.1 试验材料
雄性昆明种小鼠(SPF 级),体质量(20±2)g,3~4 周龄,由南京博恩生物技术有限公司提供。大肠杆菌购自美国组织培养库。超氧化物歧化酶(SOD)活性检测试剂盒(NBT 法)购自中国上海碧云天生物技术有限公司;乳酸脱氢酶(LDH)试剂盒购自南京建成生物科技有限公司;VRBMUG琼脂、脂肪酶(LPS)活性检测试剂盒、过氧化氢酶(CAT)测定检测试剂盒和过氧化物酶(POD)活性检测试剂盒购自北京索莱宝科技有限公司;谷胱甘肽硫转移酶(GST)活性检测试剂盒购自艾博抗上海生物贸易公司;淀粉酶(AMS)活性检测试剂盒购自北京雷根生物技术有限公司。琼脂和蛋白胨均由南京博恩生物技术有限公司提供。将基础饲粮(表1)磨碎,分别添加12%、8%和4%的斗米虫粉制作成混合饲粮,将混合饲粮制作成饲粮小球对小鼠进行饲喂。
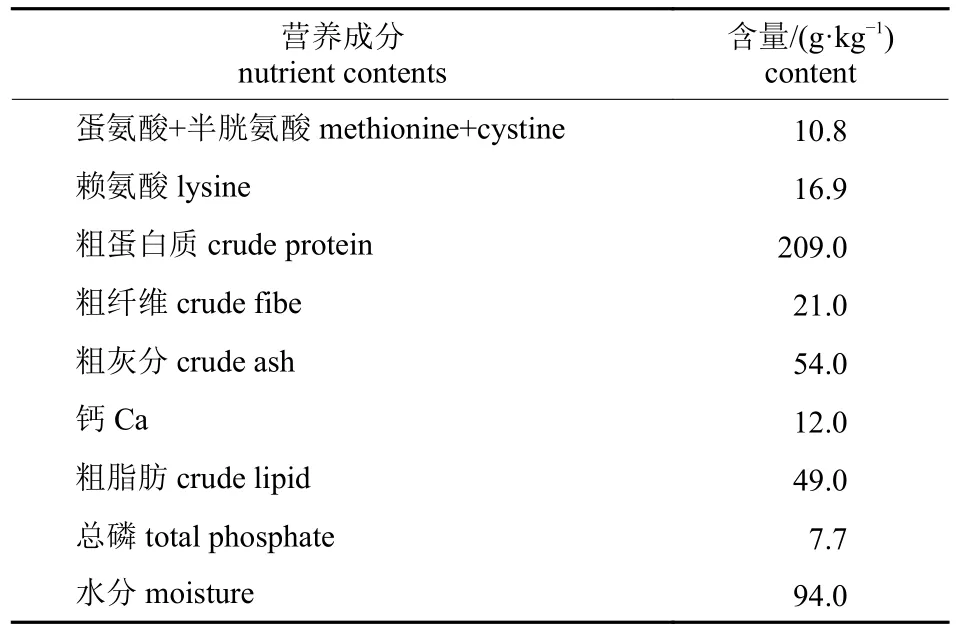
表1 小鼠基础饲粮营养成分Tab.1 Nutrient contents of mouse basal diet
1.2 斗米虫粉的制备
斗米虫 120 条(经浙江农林大学徐华潮教授鉴定为桑天牛幼虫),体质量1.6~2.0 g,虫龄5~6 龄,属于老熟幼虫,寄生于云实树干中,购自江西上饶斗米虫养殖基地。将其放入-80 ℃冰箱中低温冷冻处死,随即置于冷冻干燥机脱水干燥至恒质量,然后在研钵内加入液氮磨成粉末状备用[18]。
1.3 动物分组与处理
选定健康正常的试验小鼠40 只,通过随机组合的方式分成5 组,每组小鼠4 只,5 组分别各设置相同的重复小鼠各4 只。其中,模型组、12%斗米虫粉组、8%斗米虫粉组和4%斗米虫粉组持续5 d 腹腔内注入3.00×108CFU/mL 大肠杆菌菌液建模(注入剂量为0.02 mL/g),空白组小鼠腹腔注入相同剂量的灭菌生理盐水。腹泻构造期间每组都喂食基础饲粮;腹泻模型构造完成后进行为期2 周的混合饲粮喂食,用斗米虫粉治疗小鼠期间,12%斗米虫粉组、8%斗米虫粉组和4%斗米虫粉组试验小鼠分别喂食斗米虫粉加入量12%、8%和4%的混合饲粮2 g,空白组和模型组试验小鼠喂食2 g 的基础饲粮(风干水平);之后自由取食基础饲粮。
1.4 指标测定
治疗期完成后,分别从各组的2 个重复中选取4 只健康状况基本一致的小鼠,用适量乙醚将其麻醉,使用2 mL 针筒注射器刺穿其心脏进行采血,血液存入2 mL 无菌EP 管内,迅速在4 000 r/min下离心10 min,取血清置于4 ℃冰箱内,待用相关试剂检测盒测定血清中淀粉酶(AMS)、脂肪酶(LPS)、乳酸脱氢酶(LDH)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)和过氧化氢酶(CAT)活性。采集血液完成后,解剖分离小鼠肠道,依据解剖学原理按顺序截断并获取回肠、盲肠和结肠,用无菌手术刀刮落并收集肠道内容物,分别存入2 mL无菌EP 管内,全部置于-80 ℃超低温冰箱内完全冷冻保存待测。大肠杆菌和总菌分别使用VRB-MUG 琼脂培养基和普通琼脂培养基培养计数,测定具体方法及操作步骤参照周琼等[16]的研究。
1.5 数据统计与分析
所有数据均使用“平均值±标准差”表示,组间统计学差异采取one-way ANOVA 和Tukey’s 检验,P<0.05 认为有显著性差异
2 结果与分析
2.1 斗米虫对小鼠肠道菌数的影响
2.1.1 对大肠杆菌菌落数量的影响
由表2 可知:模型组小鼠结肠、盲肠和回肠中大肠杆菌菌落数量均显著高于空白组和斗米虫粉试验组(P<0.05),其中,模型组中的盲肠肠道中的大肠杆菌数量最高,达到20.24×106CFU/mL。试验小鼠3 个肠道中大肠杆菌菌落数量都随斗米虫粉添加量的增加而呈现出不同程度的下降;12%斗米虫粉组小鼠3 个肠道中大肠杆菌数量与空白组差异均不显著(P>0.05),且显著低于4%斗米虫粉组(P<0.05)。在盲肠中,8%斗米虫粉组的大肠杆菌菌落数量与12%斗米虫粉组差异不显著(P>0.05),但在回肠和结肠中两者差异显著(P<0.05)。可见,12%斗米虫粉对肠道大肠杆菌数量的抑制效果最显著。
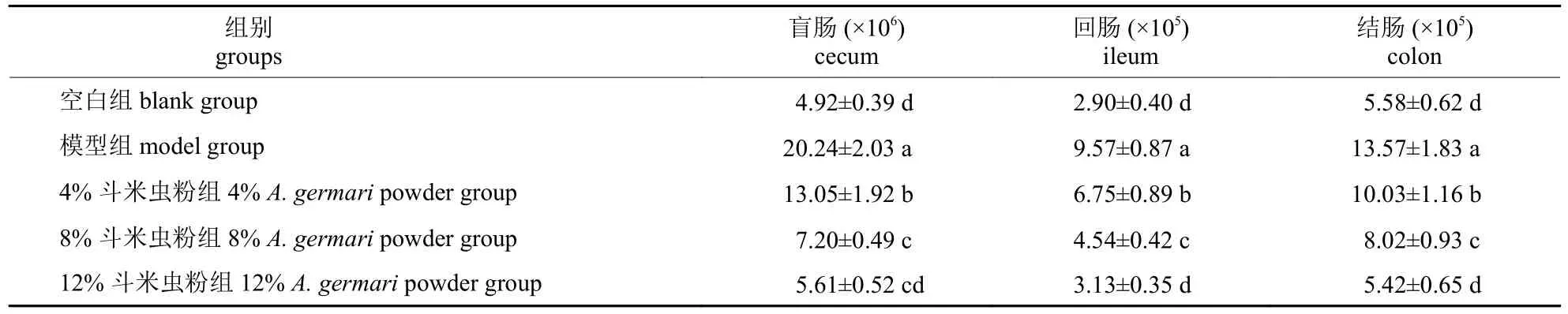
表2 斗米虫粉对腹泻小鼠肠道大肠杆菌数量的影响Tab.2 Effects of Apriona germari powder on the intestinal Escherichia coli count of diarrhea mice CFU/mL
2.1.2 对小鼠肠道总菌菌落数量的影响
由表3 可知:模型组小鼠结肠、盲肠和回肠内的总菌菌落数量均显著高于空白组和斗米虫粉试验组(P<0.05),且盲肠内的总菌菌落数量达52.36×106CFU/mL,是空白组的6.41 倍。试验小鼠3 个肠道内总菌菌落数量均随斗米虫粉添加量的增加呈现不同程度的下降;12%斗米虫粉组小鼠3 个肠道内总菌菌落数量与空白组差异均不显著(P>0.05),但显著低于 4% 斗米虫粉组(P<0.05)。在回肠中,8%斗米虫粉组的总菌菌落数量与12%斗米虫粉组差异不显著(P>0.05),但在盲肠和结肠中两者差异显著(P<0.05)。可见,12%斗米虫粉对总菌数量的抑制效果最显著。
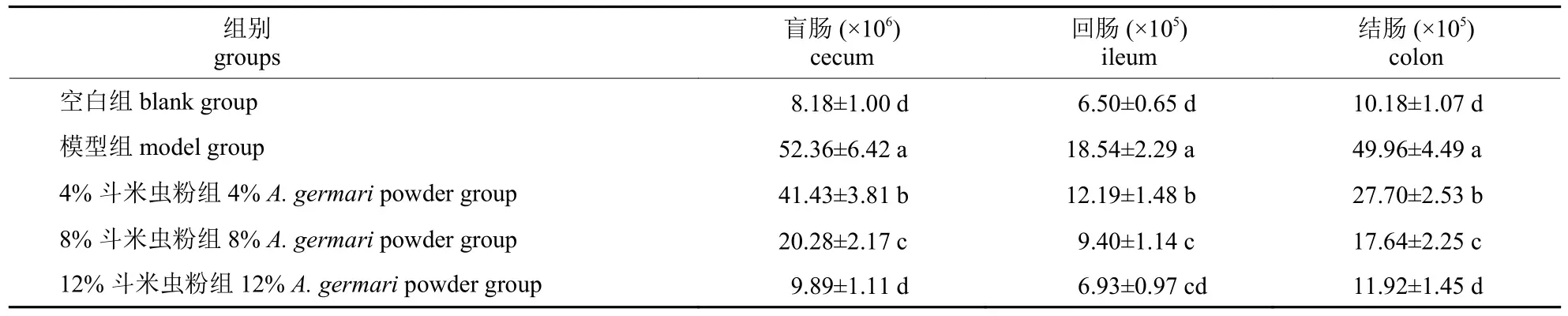
表3 斗米虫粉对腹泻小鼠肠道总菌菌落数量的影响Tab.3 Effects of A.germari powder on the intestinal total bacteria count of diarrhea mice CFU/mL
2.2 斗米虫粉对腹泻小鼠血清相关酶活性的影响
2.2.1 对抗氧化酶活性的影响
由图1 可知:模型组小鼠血清内SOD、CAT、POD 和GST 等4 种抗氧化酶的活性均显著低于空白组和斗米虫粉组(P<0.05),且4 种抗氧化酶活性均随斗米虫粉添加量的增加而呈现不同程度的上升。12%斗米虫粉组的SOD、CAT 和POD活性与空白组之间差异均不显著(P>0.05),但均显著高于4%斗米虫粉组(P<0.05);12%斗米虫粉和8%斗米虫粉组的SOD 和CAT 活性均无显著差异(P>0.05),但12%斗米虫粉组的POD 和GST 活性均显著高于8%斗米虫粉组(P<0.05)。可见,12%斗米虫粉组抗氧化酶活性上升效果最显著。

图1 斗米虫粉对腹泻小鼠血清中抗氧化酶活性的影响Fig.1 Effects of Apriona germari powder on the serum antioxidant enzymes activities of diarrhea mice
2.2.2 对消化相关酶活性的影响
由图2 可知:模型组小鼠血清内LDH、LPS和AMS 等3 种消化相关酶活性均显著低于空白组和斗米虫粉组(P<0.05),且3 种消化相关酶活性随斗米虫粉添加量的增多而呈现不同程度的上升。12%斗米虫粉组的3 种消化相关酶活性均与空白组无显著差异(P>0.05),且均显著高于4%和8%斗米虫粉组(P<0.05)。可见,12%斗米虫粉组消化相关酶活性上升效果最显著。
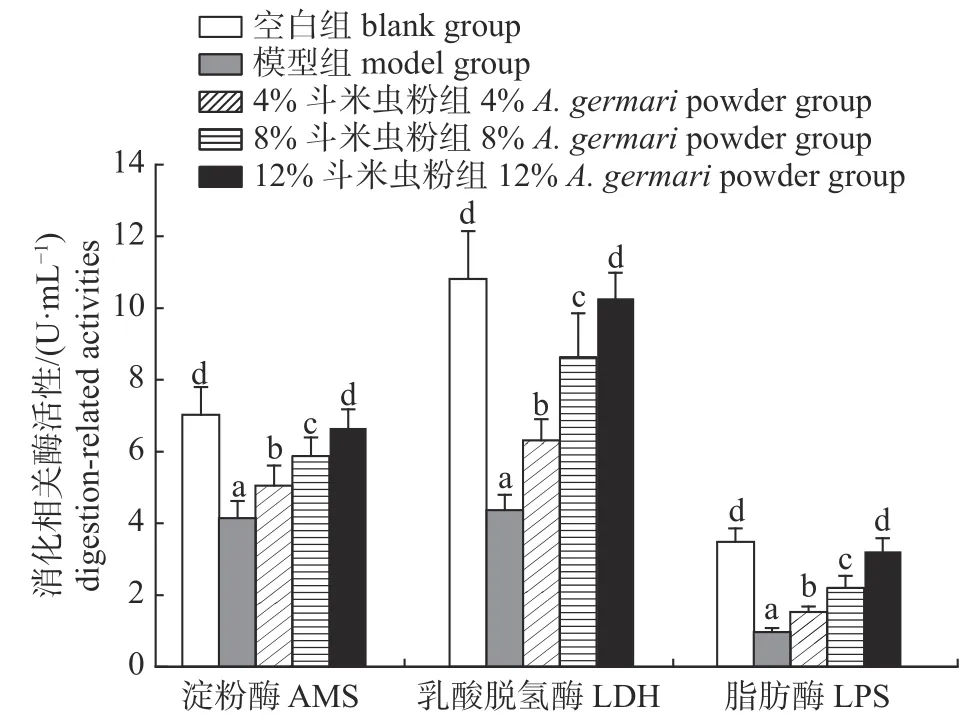
图2 斗米虫粉对腹泻小鼠血清中AMS、LDH 和LPS 活性的影响Fig.2 Effects of A.germari powder on the serum AMS,LDH and LPS activities of diarrhea mice
3 讨论
研究发现:病原性腹泻是一种具有传染性的疾病,也是导致动物幼体健康状态不佳的重要病因[19]。大肠杆菌作为引发动物幼年个体发生病原性腹泻的病原体,通过在动物机体肠道内迅速繁殖产生有害肠毒素,扰乱肠道内正常菌群;同时大肠杆菌外壳含有较多脂多糖,能穿越机体肠道黏膜并进入血液循环系统,显著降低血液中SOD活性,致使肠道中丙二醛含量显著上升,进而减弱机体抵抗能力,并最终导致炎症发生,引发一系列腹泻症状[20-21]。本研究通过对腹泻小鼠饲喂斗米虫粉,检测小鼠肠道内大肠杆菌与总菌数量,发现斗米虫粉可有效抑制大肠杆菌生长并降低其数量。在有关昆虫抑制大肠杆菌研究中,阿斯玛[22]发现厩螫蝇(Stomoxys calcitrans)抗菌蛋白提取液对大肠杆菌生长具有抑制作用;安洪勇[23]发现蝇蛆抗菌肽能有效降低小鼠大肠杆菌数量。在有关中药抑制大肠杆菌研究中,侯欣颖等[24]研究发现黄连解毒汤对大鼠肠道大肠杆菌生长具有抑制作用。本试验结果与上述研究结论基本一致,说明斗米虫对小鼠肠道内的大肠杆菌具有较好的抑制作用。
当动物机体发生病原性腹泻时,体内极易产生较多的巯基和超氧自由基,对机体本身造成危害,而抗氧化酶可以通过转换上述毒害物质或降低其毒性来保护机体免受伤害。作为动物机体内重要的抗氧化酶,GST 能够对大量活性肽和酶巯基起到保护作用;SOD 能把超氧自由基转化为H2O2,再经过与CAT 联合作用将H2O2分解成无毒的H2O,重构成完整闭环的防氧化链,达到保护机体的作用[17]。本研究表明:饲喂斗米虫粉可显著提高小鼠血清中4 种抗氧化酶活性,提高其抗氧化性能。程逍妹等[25]研究发现:饲料中加入蝇蛆蛋白可提高凡纳滨对虾的免疫能力;刘黎等[26]研究发现:饲粮中添加蝇蛆粉对青鱼的非特异性免疫和抗氧化性具有提升作用;WAN 等[27]研究发现:蚕提取物可显著提升大鼠血清中SOD 活性。本研究结果与上述研究结论相类似,说明斗米虫可提高小鼠抗氧化性能。
动物个体腹泻时易引发功能性消化不良和新陈代谢缓慢等病症,这多与个体内部消化相关酶LPS、AMS 和LDH 活性下降有关[28]。本研究表明:饲喂斗米虫后,小鼠血清中AMS、LPS 和LDH活性增加,说明斗米虫对其肠道消化功能具有较好的改善作用,同时抗氧化酶活性增强可提高肠道免疫力。张玉栋等[17]发现:蝇蛆粉可显著提升腹泻小鼠肠道消化酶和抗氧化酶活性,提高小鼠消化机能和抗氧化机能。本研究对小鼠抗氧化酶与消化相关酶活性的研究结果与上述研究结果基本一致,但是其相关作用机理及更高剂量下的治疗效果有待进一步研究。
4 结论
斗米虫能显著抑制肠道内大肠杆菌的繁殖,且能有效降低其菌落数量,还可提高血清中抗氧化酶的活性以及消化吸收功能相关酶的活性。斗米虫对由大肠杆菌引发的腹泻病症具有治疗效果。本研究为阐释斗米虫治疗腹泻功效提供理论依据,也为药用斗米虫系列产品的开发利用提供数据支撑。
