一株黄瓜枯萎病拮抗细菌的筛选鉴定及抑菌作用初探*
2022-05-28刘晓辉高晓梅孙玉禄
敖 静,李 杨,刘晓辉,高晓梅,孙玉禄
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
黄瓜枯萎病是主要由尖孢镰刀菌(Fusarium oxysporum)侵染引起的土传真菌病害,可侵染多种植物寄主,病菌通过分泌降解酶和菌毒素等侵染作物的维管束系统,导致作物出现萎蔫和腐烂等症状[1-2],可引起作物和花卉枯萎病,严重时造成植株死亡,从而使作物大量减产,影响农业发展[3-5]。尖孢镰刀菌的菌丝和孢子可存留在土壤或作物种子上越冬,在土壤和空气中能存活10 年以上[6]。目前,农业生产中主要通过化学药剂防治尖孢镰刀菌,如利用唑类、甲酯类和酰胺类等药物对种子进行消毒,或对作物植株进行灌根等处理以抑制病原菌生长[7-8],但长期大量施用化学药品不仅会污染作物、土壤和水系,产生病原菌耐药性的风险,还会直接影响人类健康[9-10]。目前,生物防治是应用前景广、成本较低且绿色无污染的技术[11]。本研究以尖孢镰刀菌黄瓜转化型为研究对象,通过从设施温室土壤中筛选出高效拮抗菌株并研究其抑菌作用,旨在为进一步探究拮抗菌的生防作用机制提供理论依据。
1 材料与方法
1.1 材料
病原菌:尖孢镰刀菌(F.oxysporum)黄瓜转化型,由辽宁省微生物科学研究院分离。
1.2 拮抗菌的筛选和鉴定
1.2.1 拮抗菌筛选
于辽宁省朝阳市喀左县六官营子乡东前沟村(N41.16°,E119.68°)种植黄瓜的设施温室中采集土壤样品,将其混匀后称取1.0 g 放至99 mL无菌水中,振荡约30 min。梯度稀释至10-5倍,吸取100 μL 均匀涂布于含病原菌的平皿中,28 ℃培养24 h,将能产生抑菌圈的菌株分离纯化,即得到初筛菌株。利用平板对峙法[12]测定抑菌率,筛选出抑菌率较高的拮抗菌株。抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.2 生理生化鉴定及16S rDNA 序列比对
采用划线法将所得拮抗菌株接种到LB 固体培养基[13]平皿上,观察菌落形态及其显微形态,并进行生理生化试验。16S rDNA 扩增引物序列为:F:5′-AGAGTTTGATCCTGGCTCAG-3′和R:5′-CTACGGCTACCTTGTTACGA-3′。反应体系总体积50.0 μL,包括:上、下游引物各1.5 μL,细菌基因组1.0 μL,10×Buffer 5.0 μL,Taq聚合酶1.0 μL,dNTP 1.0 μL,ddH2O 39.0 μL。反应条件为:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,35 个循环;72 ℃ 7 min。PCR 产物经1%琼脂糖凝胶电泳后送至上海派森诺生物技术有限公司完成测序。将16S rDNA 序列与Gen-Bank 数据库中的核苷酸序列进行同源性分析,利用MEGA 软件进行比对及构建发育进化树。
1.3 抑菌作用研究
1.3.1 挥发性物质对病原菌菌丝的影响
采用平皿倒扣法,一个平皿加入PDA 培养基,并于中心接种直径为5 mm 的尖孢镰刀菌菌块,另一个平皿加入LB 固体培养基,将拮抗菌种混悬液(调节密度为108CFU/mL)均匀涂布,2 个平皿倒扣用封口膜封口,并用保鲜膜密封,以空白LB固体培养基平皿为对照。28 ℃培养,观察处理组病原菌生长情况,每个处理重复3 次[14]。
1.3.2 拮抗菌对病原菌菌丝形态的影响
采用平板对峙法,将直径为5 mm 的尖孢镰刀菌菌饼接种至PDA 培养基平皿中心,在距离中心2.5 cm 处接种拮抗菌菌块,挑取靠近拮抗菌一侧的病原菌菌丝,在显微镜下观察其形态变化。将靠近拮抗菌一侧的病原菌菌丝转接到新的PDA 培养基上,28 ℃恒温培养,观察其是否有再生长能力,每24 h 测量菌落直径大小,以未经对峙处理的病原菌菌丝为对照,每个处理组设置3 个重复[15]。
1.3.3 胞外物质对病原菌及孢子萌发的影响
将拮抗菌接种到100 mL LB 液体培养基中,37 ℃、180 r/min 培养24 h 得到种子液;将种子液按2%的比例接到LB 液体培养基中,37 ℃、180 r/min 培养24 h,低温5 000 r/min 离心10 min,弃去下沉菌体,再用0.22 μm 滤膜过滤,即得到无菌发酵液。将培养5 d 的病原菌菌丝用去离子水洗脱,再用6 层纱布过滤,10 000 r/min 离心5 min,弃去上清液,收集孢子,用去离子水制备孢子混悬液,调节其密度为106个/mL,备用。
将1 mL 病原菌孢子混悬液与10 mL 融化冷却至约45 ℃的PDA 培养基混合摇匀后倒入平皿中冷却,采用牛津杯法,向牛津杯中加入100 μL无菌发酵液,以LB 液体培养基为空白对照,将平皿置于(28±1)℃培养24 h,观察是否有抑菌圈出现,并测量抑菌圈大小,每个处理设置3 个重复[16]。精确吸取0.50 mL 孢子混悬液与同体积无菌发酵液混合,将混合液体滴于凹玻片,然后放于平皿中,加盖保湿培养,恒温箱设置28 ℃,分别于2、4、6、8 和10 h 检测孢子萌发数,以无菌水为对照,每个处理组设置3 个重复[17]。
1.4 HPLC 分析条件
采用Agilent 1260 高效液相色谱分析仪和Venusil XBP C18 色谱柱(4.6 mm×250 mm,5 μm)进行HPLC 分析,流动相由色谱纯乙腈(A)和纯化水(B)组成,梯度洗脱程序见表1。进样量20 μL,流速1.0 mL/min,波长220 nm,收集各峰成分并进行抑菌试验。

表1 梯度洗脱程序Tab.1 Gradient elution program
2 结果与分析
2.1 拮抗菌筛选结果
土壤样品中共分离出细菌菌株32 株,其中有8 株(XN-1~XN-8)对尖孢镰刀菌有抑菌作用。由表2 可知:XN-3 的抑菌率最高,为71.81%,故选择XN-3 进行下一步试验。
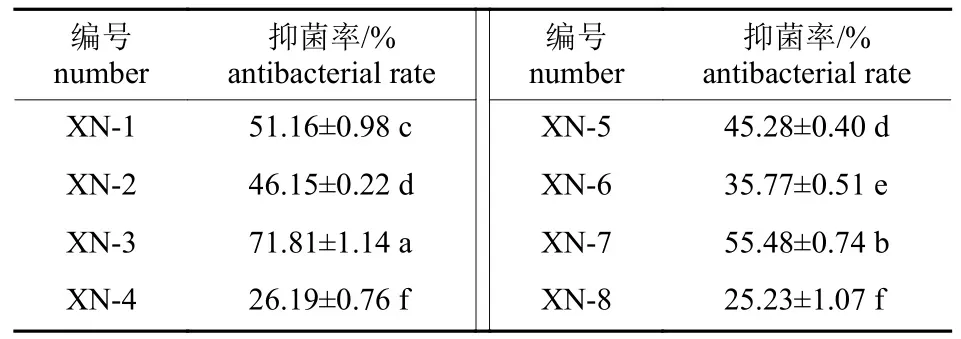
表2 菌株XN-1~XN-8 测定抑菌率结果Tab.2 Results of XN-1-XN-8 antibacterial rate
2.2 形态学及生理生化特征
由图1 可知:XN-3 单菌落呈白色,近圆形,表面半干燥,有隆起褶皱,显微镜下菌体呈杆状,产椭圆形芽孢,革兰氏颜色试验呈阳性。通过生理生化试验结果(表3)并结合《常见细菌系统鉴定手册》[18]和《伯杰细菌鉴定手册》[19],将XN-3 鉴定为芽孢杆菌属。

图1 XN-3 在LB 培养基(a)和光学显微镜下(b)的形态特征Fig.1 The morphological characteristics of XN-3 in LB medium(a)and light microscope(b)
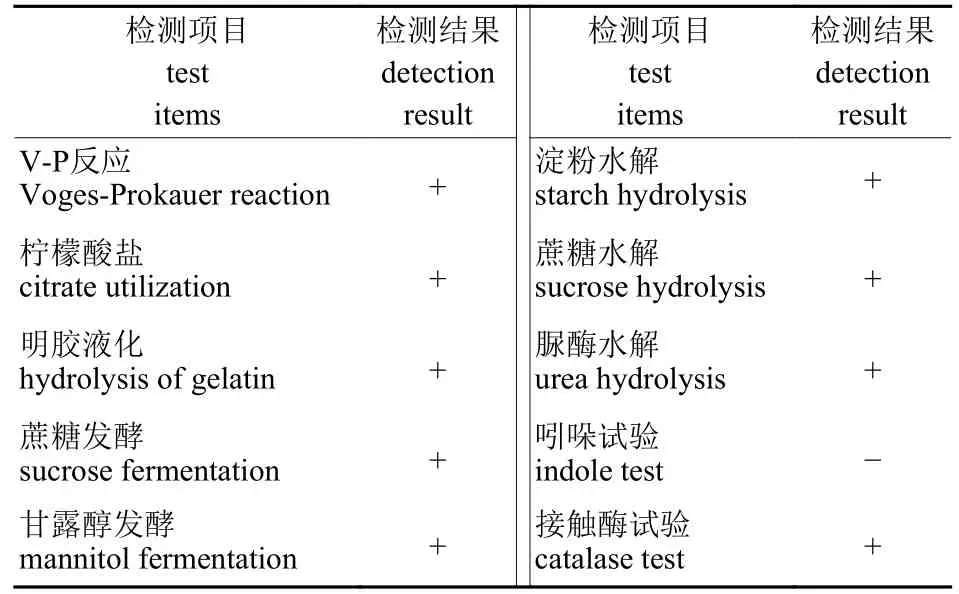
表3 细菌XN-3 生理生化特征Tab.3 The physiological and biochemical characteristics of XN-3
2.3 分子生物学鉴定
将16S rDNA 序列与GenBank 数据库中的核苷酸序列进行同源性分析,结果显示菌株XN-3 与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)16S rDNA 序列的同源相似性最高,为99%。由图2 可知:菌株XN-3 与解淀粉芽孢杆菌位于同一分支,结合菌体形态特征及生理生化鉴定结果,可确定XN-3 为解淀粉芽孢菌,将其核酸序列上传至Genebank,获取登录号为:OK465112。

图2 XN-3 的16S rDNA 系统发育进化树Fig.2 The 16S rDNA phylogenetic evolution tree of XN-3
2.4 抑菌作用
2.4.1 挥发性物质对病原菌菌丝的影响
由图3 可知:对照组菌丝生长状态较好,菌丝较长,且气生菌丝生长旺盛;处理组菌丝卷曲,长度变短,说明XN-3 能够产生对病原菌菌丝生长有抑制作用的挥发性气体。

图3 对照组(a)和处理组(b)的菌丝形态比较Fig.3 Comparison of mycelium morphology of control group(a)and treatment group(b)
2.4.2 拮抗菌对病原菌菌丝的影响
由图4 可知:对照组菌丝粗细均匀,表面光滑,有弹性,菌丝内原生质均匀分布,有少量孢子产生;处理组菌丝膨大、变弯变短,粗细不均匀,菌丝分节现象明显,顶端出现不规则分支,分枝菌丝生长受阻,有厚垣孢子生成。

图4 光学显微镜下对照组(a)和处理组(b)的菌丝形态比较Fig.4 Comparison of mycelium morphology of control group(a)and treatment group(b)under light microscope
由图5 可知:在72 h 内,处理组菌落直径分别为10.06、21.00 和35.00 mm,均小于对照组,说明处理组菌丝生长初期受限,但并未完全失去生长能力;随着菌丝生长,96 h 后对照组和处理组菌落直径基本一致。

图5 菌丝生长情况比较Fig.5 Comparison of mycelial growth
2.4.3 胞外物质对病原菌及孢子萌发的影响
由表4 可知:无菌发酵液可对病原菌产生抑菌作用,抑菌圈直径为18.23 mm,说明XN-3 胞外物质对病原菌有抑制作用;同时,处理组孢子萌发率明显降低,对照组孢子完全萌发时,处理组孢子萌发率仅为10.23%,说明XN-3 无菌发酵液对病原菌孢子萌发有明显的抑制作用。

表4 XN-3 无菌发酵液对病原菌孢子萌发的影响Tab.4 Effect of XN-3 aseptic fermentation broth on spore germination of pathogenic bacteria
2.5 HPLC 分析结果
由图6 可知:无菌发酵液共分离出2 个峰,保留时间分别为29.728(A-1)和35.858 min(A-2);峰面积分别为116 444 和198 887。收集出峰成分进行平板抑菌试验,结果(图7)显示:峰A-2 中成分有抑菌圈出现,具有较明显抑菌作用。

图6 无菌发酵液HPLC 色谱图Fig.6 HPLC chromatogram of sterile fermentation liquid

图7 峰A-1(a)与峰A-2(b)成分的抑菌作用Fig.7 Fungicidal activity of the components of peak A-1(a)and peak A-2(b)
3 讨论
尖孢镰刀菌是土传病原真菌,且分布广泛,在设施农业生产中很难防治,现已成为植物病理中的第三大土传病原真菌[6],长期以来,过度的化学防治已造成严重的环境污染甚至影响人类健康,因此,应用绿色生物防治技术,筛选尖孢镰刀菌高效拮抗菌株、明显其抑菌成分、探究其作用机理并研究其田间防治效果具有重要的理论和实践意义。本研究以尖孢镰刀菌引起的黄瓜枯萎病为靶标进行高效拮抗菌的筛选,得到1 株抑菌率高达71.81%的细菌菌株XN-3,经鉴定为解淀粉芽孢杆菌,而解淀粉芽孢杆菌对尖孢镰刀菌具有明显的抑菌作用,这与张美君等[20]的研究结论一致。此外,解淀粉芽孢杆菌是一种具有广泛抑菌作用的生防菌,有研究发现其对橡胶树褐根病菌(Phellinus noxius)、橡胶疫霉(Phytophthora heveae)、小孢拟盘多毛孢(Pestalotiopsis microspora)和尖孢炭疽病菌(Colletotrichum acutatum)等多种病原真菌具有较好的抑菌效果[21],因此,对XN-3 的研究具有更广阔的应用价值,这也是本研究的重要意义所在。
本研究表明:XN-3 能够产生有抑菌作用的挥发性物质。有研究显示:解淀粉芽孢杆菌能够产生抑制青霉菌的羟基丁酮以及2-癸酮等11 种挥发性有机物(VOCs),这些有机物都可以有效抑制香蕉枯萎病菌菌丝生长及孢子萌发[22-23]。郝象瑢等[24]利用GC-MS 研究解淀粉芽孢杆菌LJ02 产生的挥发性气体对多种果类致病菌的作用,特别是对黑腐皮壳菌(Valsa mali)、草莓灰霉病菌(Botrytis cinerea)和枣浆胞病菌(Alternariaspp.)有显著抑制效果,抑菌率均大于50%。本研究显示:XN-3 可使病原菌菌丝卷曲,长度变短,显微形态出现菌丝膨大和弯曲不均,分枝菌丝生长受阻,这些病原菌菌丝形态的变化可能是由于XN-3 产生的抑菌物质破坏了病原菌菌丝细胞;利用HPLC 分析技术,通过收集分离出的各峰组分,在峰A-2 中发现对尖孢镰刀菌具有明显抑菌作用的成分。权春善等[25]和王军华等[26]研究发现:解淀粉芽孢杆菌对病原菌菌丝细胞有强烈的破坏作用;ARREBOLA 等[22]研究发现:解淀粉芽孢杆菌PPCB004 对青霉属真菌的菌丝延伸有强烈的抑制作用,能抑制其生长速度;刘超等[27]研究发现:解淀粉芽孢杆菌BA-26 发酵液组分中的抗菌物质对灰葡萄孢(Botrytis cinerea)孢子萌发抑制作用较强。这些研究均验证了解淀粉芽孢杆菌的广谱抑菌作用,同时也说明解淀粉芽孢杆菌发酵产物中的抑菌成分是可被分离的,为微生物发酵生物农药的研发提供可能性,但在本研究中XN-3 抑菌物质的含量、种类及具体的抑菌机理尚不明确,有待进一步探索和研究。
本研究筛选出1 株抑菌率较高的解淀粉芽孢杆菌XN-3,可为今后植物病害绿色防治提供菌种种质资源,通过对其抑菌作用的初探,为进一步研究生防机制奠定基础,为针对尖孢镰刀菌引发的植物病害研发绿色生物农药提供依据和方向。
4 结论
本研究在设施农业土壤中分离筛选出8 株黄瓜枯萎病的高效拮抗菌菌株,其中,抑菌率最高的菌株XN-3 鉴定为解淀粉芽孢杆菌(B.amyloliticus)。XN-3 能够产生有抑菌作用的挥发性物质,能够抑制病原菌菌丝生长,且胞外物质能够有效地抑制病原菌孢子萌发,其发酵液组分A-2 中有明显抑菌作用的成分。
