不同梯度氮磷钾施用量对云南植烟土壤细菌群落结构与多样性的影响
2022-05-28王志远阮彦楠陈检锋赵文军付利波
王志远,阮彦楠,王 伟,陈检锋,赵文军,陈 华,付利波
(1.云南省农业科学院农业环境资源研究所,昆明 650205;2.昆明学院,昆明 650205;3.红塔烟草(集团)有限责任公司原料部,云南 玉溪 653100)
【研究意义】烟草是中国的一种重要经济作物,其在经济发展中起着关键作用。云南省是中国主要烟草产区之一,烟草也逐步成为云南省的一个支柱产业[1]。相关研究表明,合理的施肥措施是提高烟叶产量和品质的关键核心技术,在一定的生态环境和品种条件下,合理施肥能提高烟叶地上部分有机物的合成量,形成合理的C/N比[2-3],因此掌握烟草合理的施肥措施,是提升云南省烟草产量和品质的重中之重。【前人研究进展】云南植烟土壤因长期的不合理的施肥方式造成了云南植烟土壤的一系列生产问题,特别是造成了土壤养分失调、土壤生物代谢过程受阻等问题抑制了烤烟生长,从而导致烟叶品质下降。可以看出长期不合理施肥严重影响云南省烤烟生产的可持续发展[4-6]。王日俊等[7]研究表明,合理施肥能使烤烟的平均产量增加4.68%,并显著提升了上等烟叶比例13.55%,所以合理的施肥措施可以提高烟叶产量和品质。土壤微生物是土壤生态过程的核心和重要组成部分,在Balvanera等[8]的研究中,微生物的多样性对大多数的生态系统有积极的影响,包括在土壤生态系统中。土壤微生物结构和功能可以有效地反映土壤质量的变化、衡量土壤可持续发展,是评价土壤质量及土壤生态系统可持续发展的重要指标[9]。Fierer等[10]发现,土壤微生物可以增加土壤肥力,提高作物的产量,并改善陆地生态系统。土壤微生物在土壤有机物质的转化分解[11]、养分元素的循环与利用[12]、土传病害抑制等方面发挥着重要的作用。在Hartmann[13]的研究中,采用有机耕作和施肥的方式可以提高土壤微生物的丰富性,增加有机质的分解和土壤肥力,并改变了土壤微生物群的结构。土壤微生物是土壤肥力的关键驱动因子,前人研究发现长期合理施肥和土壤管理增加土壤细菌多样性,改善了土壤养分质量,支持了富营养化生态系统[14],因此土壤微生物群落结构和功能多样性信息对于揭示科学施肥措施与土壤肥力和作物生产力提高的作用机制具有重要意义。【本研究切入点】通过16S rRNA 高通量测序技术能检测土壤样品中微生物群落组成及其相对丰度,相较于传统的微生物多样性研究方法,高通量测序技术具有测出的数据量大、速度快,能够直接反映出土壤DNA的丰度,低成本等优势[15]。【拟解决的关键问题】本研究通过研究不同施肥条件下烟田土壤中细菌群落结构组成差异,试图从土壤微生物多样性的角度解释不同施肥处理下土壤细菌群落结构的变化,以期为云南省烟草产区土壤的可持续耕作管理提供科学依据。
1 材料与方法
1.1 试验材料
试验地于2019年在云南省澄江县龙街镇后香村(东经102°52′55″,北纬24°38′58″),海拔1698 m。供试土壤为水稻土,试验烤烟品种为当地主栽品种K326,种植规格为行距120 cm,株距60 cm。试验所用肥料:氮肥为硝酸铵钙(含N 15.5%),磷肥为过磷酸钙(含P2O516%),钾肥为硫酸钾(含K2O 50%)。
1.2 试验设计
在种植烤烟前,将同一试验地分为3个大区,每个大区700 m2,试验前对大区进行裂区处理,每个大区裂为10个小区,设置10个处理(表1),采用随机区组分别设置3次重复,其他生产技术按照当地农业部门推荐技术操作。
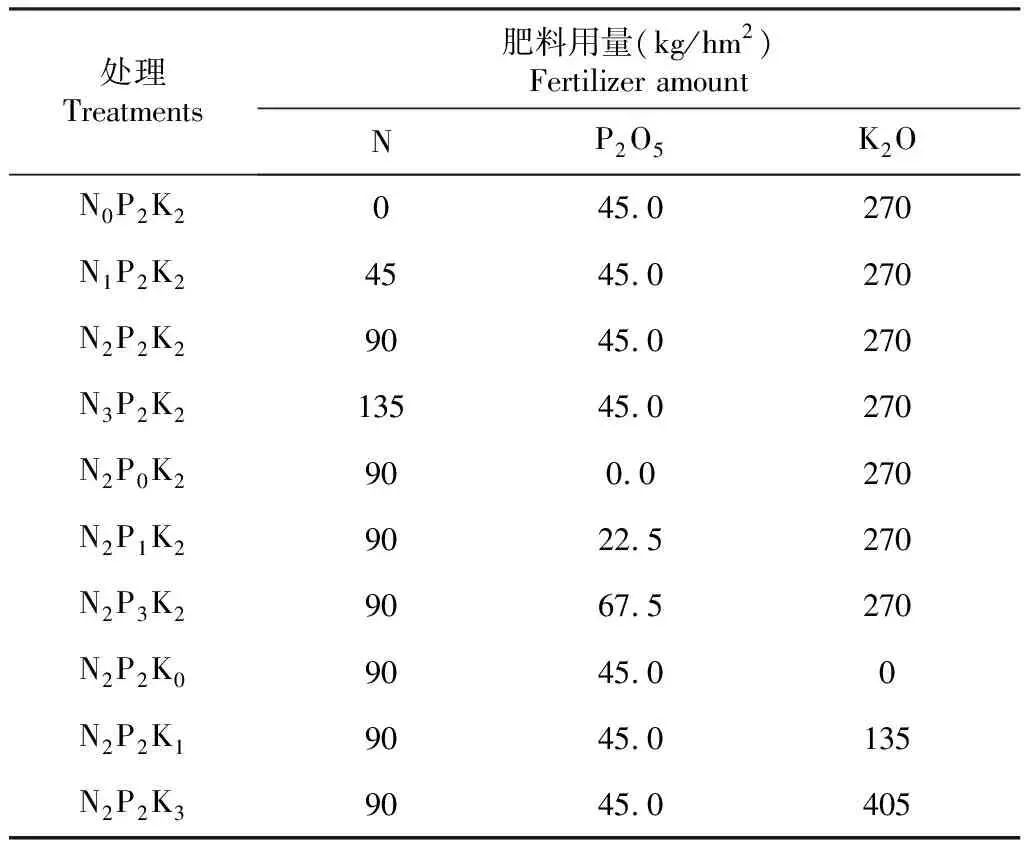
表1 试验设计
1.3 土壤样品采集
2019年在云南省澄江县龙街镇后香村烤烟实验田采集烟叶收获后(70 d)土壤样品,采样时去除表层0~2 cm的土壤,拔出烟株,收集粘附在根系上的0~4 cm的土壤,再分别对每个小区随机取5个烟株样点混合为1个样品,低温下保存并及时运回实验室。将采集的土壤样品过10 mm筛,去除试验土壤中的烟草根系残体和未分解完全的秸秆残体,再将处理好的土壤放入取样袋中,于-80 ℃低温冰箱下保存待用。
1.4 土壤样品总DNA提取和16S rRNA的PCR扩增
1.4.1 土壤样品总DNA提取 土壤总DNA使用Fast DNA Spin Kit for Soil(MP Biomedicals,Santa Ana,CA,USA)试剂盒进行土壤DNA提取,提取步骤依照试剂盒说明进行,每样品3次平行,将已提取的DNA保存在-20 ℃冰箱内以待后续测试。
1.4.2 细菌16S rRNA的PCR扩增 以提取的土壤微生物总DNA为模板,将细菌16S rRNA基因在V3~V5区的特异性基因经PCR扩增,并将扩增的产物克隆到载体上,对阳性克隆子进行挑选培养并测序;所得序列与NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行同源性比对分析,用紫外分光光度计测定其DNA浓度,制成标准品。用无菌水稀释标准品至1 ng/μL,并将其作为模板放在荧光定量仪上进行PCR扩增,建立反映定量PCR的Ct阈值与质粒拷贝数浓度对应的标准曲线。通过检测不同处理DNA样品经PCR扩增后得到的Ct值,进而得出特异性基因片段拷贝数目。
1.5 数据统计与分析
1.5.1 微生物数据分析 通过软件 UCULT(3.1.0)对获得的每个样品16S rRNA 有效序列比对结果并进行聚类,将相似度>97%的有效序列归为同一个 OTU(Operational taxonomic units,操作分类单位)。对得到的OUT数据集基于 R 3.6.3 软件的phyloseq包和microbiome包进行细菌群落多样性分析。α多样性指数可以反映土壤微生物群落变化和物种的丰度和多样性[16]。土壤中观测到的细菌OTU数量,可以描述土壤中检测到的细菌物种的丰度,Shannon 指数可以描述土壤中微生物群落的多样性,指数越小群落的物种多样性越小,反之则越大,Simpson 指数可以描述土壤微生物群落中常见的物种优势程度,即物种均匀度[17-18]。本研究中关注的α多样性是指对物种多样性进行分析,包括观测到的OUT数量(Observed)、Simpson以及Shannon 3个指数[19-20]。通过以上3个指数评价烟田细菌的群落多样性。
1.5.2 不同施肥处理的差异分析 通过线性模型检验不同施肥梯度下土壤细菌群落多样性的差异效应及交互作用。P×K互作处理为氮施用量为90 kg/hm2时不同磷、钾梯度,包括P0K2、P1K2、P2K0、P2K1、P2K2、P2K3、P3K2;N×K互作处理为磷施用量为45 kg/hm2时不同氮、钾梯度,包括N0K2、N1K2、N2K0、N2K1、N2K2、N2K3、N3K2;N×P互作处理为钾施用量为270 kg/hm2时不同氮、磷梯度,包括N0P2、N1P2、N2P0、N2P1、N2P2、N2P3、N3P2;其中P0=0 kg/hm2,P1=22.5 kg/hm2,P2=45 kg/hm2,P3=67.5 kg/hm2;K0=0 kg/hm2,K1=135 kg/hm2,K2=270 kg/hm2,K3=405 kg/hm2;N0=0 kg/hm2,N1=45 kg/hm2,N2=90 kg/hm2,N3=135 kg/hm2。采用的统计分析软件为 R studio 3.6.3,所用的数据分析包为nlme。
2 结果与分析
2.1 不同氮、磷、钾梯度下优势细菌种群相对丰度比较
图1表明,细菌在门水平上有21个种群,其中7个优势种群(每个种群相对丰度>1%)依次为变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),放线菌门(Actinobacteria),拟杆菌门(Bacteroidetes),芽单胞菌门(Gemmatimonadetes),绿弯菌门(Chloroflexi),厚壁菌门(Firmicutes)。
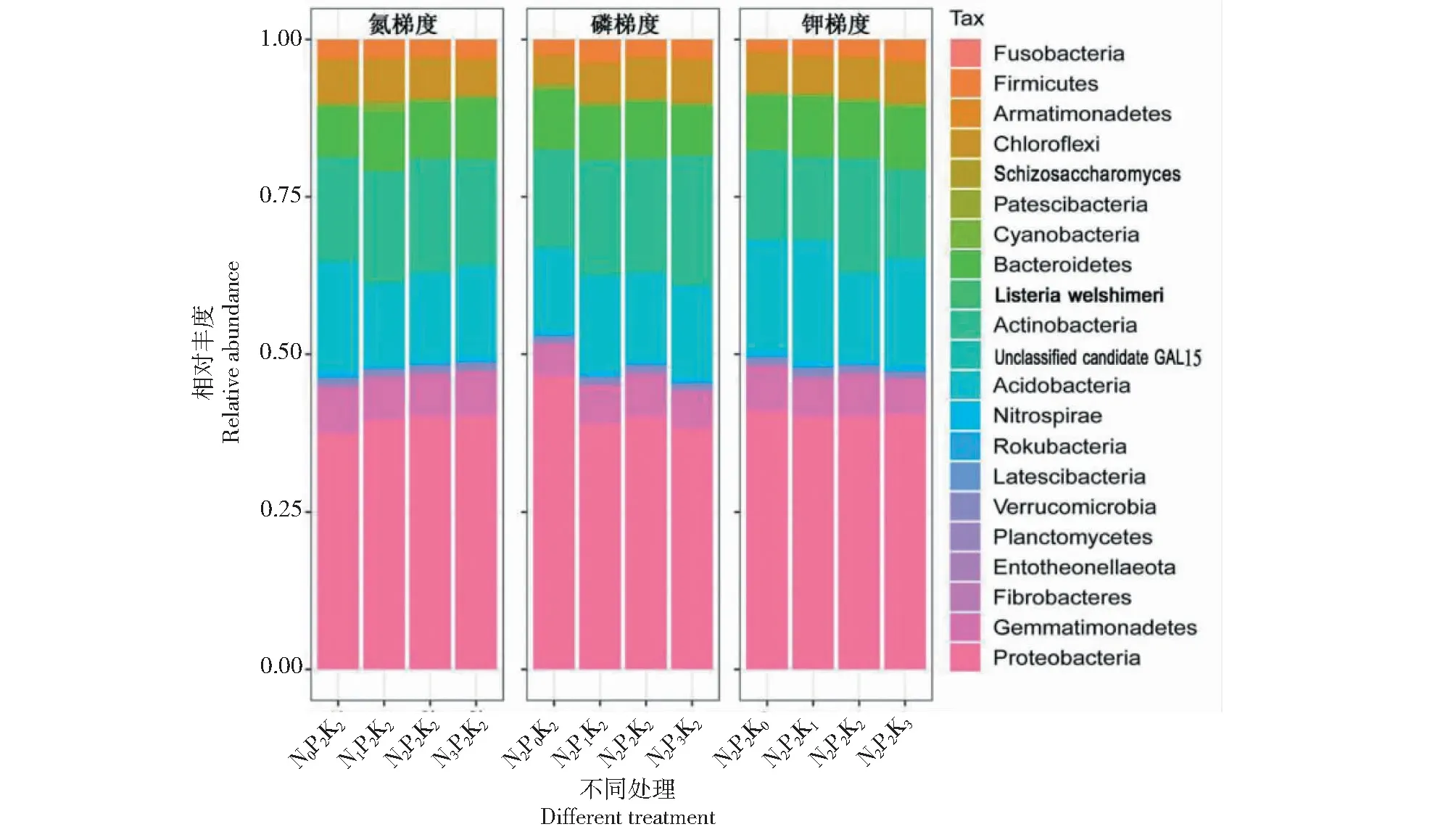
图1 不同氮、磷、钾梯度下细菌门水平相对丰度
在氮梯度(N0、N1、N2、N3)处理中,变形菌门相对丰度分别为37.50%、39.51%、39.98%和40.05%,酸杆菌门为17.32%、12.74%、13.72%和14.42%,放线菌门为16.62%、17.93%、18.23%和16.92%,拟杆菌门为7.98%、9.37%、8.88%和9.56%,芽单胞菌门为7.37%、6.88%、6.95%和7.27%,绿弯 菌门为6.92%、6.79%、6.42%和5.66%,厚壁菌门为3.00%、2.88%、2.68%和2.91%;在不同氮梯度处理下,变形菌门,拟杆菌门和放线菌门相对丰度上升,分别上升至39.51%~40.05%、8.88%~9.56%和6.92%~18.23%;而酸杆菌门,芽单胞菌门,绿弯菌门和厚壁菌门相对丰度下降,分别下降至12.74%~14.42%、6.88%~7.27%、5.66%~6.79%和2.68%~2.91%。
在磷梯度(P0、P1、P2、P3)处理中,变形菌门相对丰度分别为46.40%、38.85%、39.98%和38.29%,酸杆菌门为13.20%、15.16%、13.72%和14.65%,放线菌门为15.68%、18.40%、18.23%和20.69%,拟杆菌门为9.34%、8.41%、8.88%和7.88%,芽单胞菌门为5.30%、6.30%、6.95%和6.75%,绿弯菌门为4.56%、6.19%、6.42%、5.99%,厚壁菌门为2.36%、3.52%、2.67%和3.00%;在不同磷梯度处理下,酸杆菌门,放线菌门,绿弯菌门,芽单胞菌门和厚壁菌门相对丰度上升,分别上升至13.72%~15.16%、18.23%~20.69%、5.99%~6.42%、6.30%~6.95%和2.67%~3.52%;而变形菌门和拟杆菌门相对丰度下降,分别下降至38.29%~39.98% 和7.88%~8.41%。
在钾梯度(K0、K1、K2、K3)处理中,变形菌门相对丰度分别为40.94%、40.01%、39.98%和40.36%,酸杆菌门为17.67%、19.24%1、3.72%和17.03%,放线菌门为14.16%、13.19%、18.23%和14.13%,拟杆菌门为8.60%、9.54%、8.88%和9.83%,芽单胞菌门为7.27%、6.27%、6.95%和6.49%,绿弯菌门为6.20%、5.81%、6.42%和5.77%,厚壁菌门为1.88%、2.49%、2.67%和3.27%。在不同钾梯度处理下,拟杆菌门,厚壁菌门相对丰度上升,分别上升至8.88%~9.83%和2.49%~3.27%;而变形菌门,芽单胞菌门相对丰度下降,分别下降至39.98%~40.36%和6.27%~6.95%;而在酸杆菌门,放线菌门和绿弯菌门中相对丰度有上升也有下降,但相对丰度也在0.22%~4.07%波动。
2.2 不同氮、磷、钾梯度下细菌群落α多样性指数
由图2可知,不同氮梯度和不同钾梯度条件对土壤细菌的3个多样性指数的影响相较于不同磷梯度处理下影响较低。不同磷梯度条件下,在磷施用量为67.5 kg/hm2时,土壤微生物3个α多样性指数分别为OUT=1494(P=0.067),Shannon=5.98(P=0.016)和Simpson=0.9891(P=0.043),显著低于其他处理组;在不施磷处理的条件下各指数也相对较低,分别为OUT=1512(P=0.067),Shannon=6.05(P=0.016)和Simpson=0.9919(P=0.043)。在磷施用量为45 kg/hm2条件下,观察到OUT=1530(P=0.067),数值最高;在施磷22.5和45 kg/hm2条件下,Shannon和Simpson指数差异不明显。
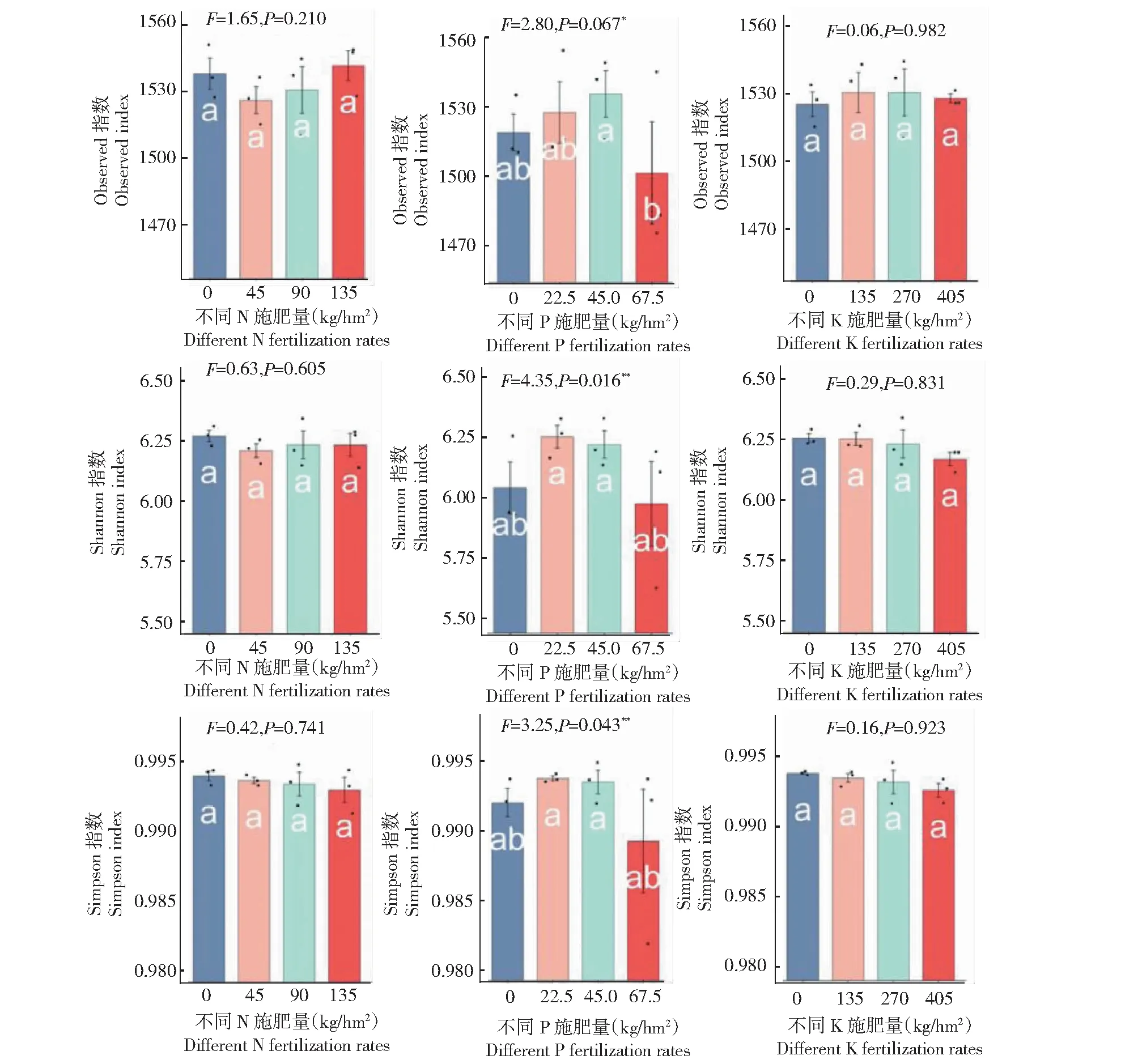
图中小写字母表示处理间差异,*表示P<0.05,**表示P<0.1
2.3 不同养分互作条件下优势种群变形菌门α多样性比较
图3表明,在N=90 kg/hm2的处理中,不同磷、钾组合梯度下发现,磷、钾不同养分梯度组合可显著改变土壤优势种群变形菌门的Shannon指数和Simpson指数;其中当磷和钾(P2K3)的施用量分别为45和405 kg/hm2时,Shannon指数和Simpson指数分别为4.640(P=0.049)和0.967(P=0.053),显著低于其他处理组;当磷和钾(P1K2)的施用量分别为22.5和270 kg/hm2时,Shannon指数和Simpson指数分别为4.87(P=0.049)和0.976(P=0.053)。在P=45 kg/hm2的处理中,不同氮、钾组合梯度下,未发现显著改变土壤优势种群变形菌门的α多样性指数的效应,但是当氮和钾(N2K3)施用量分别为90和405 kg/hm2时,变形菌门的Shannon指数和Simpson指数分别为4.640(P=0.370)和0.967(P=0.444),相对低于其他处理组。
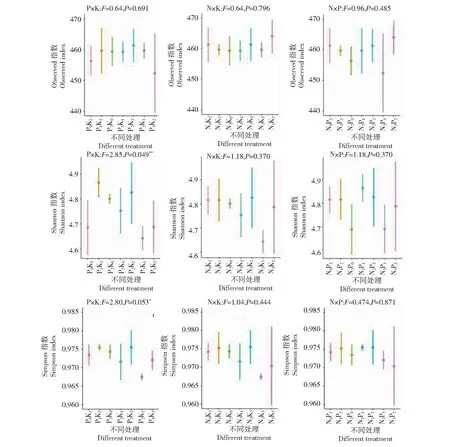
图3 不同养分互作条件下优势种群变形菌门α多样性
3 讨 论
在自然生态系统中无人为干扰的条件下,土壤生物在维持土壤养分动态循坏平衡中发挥着重要的作用[21]。在农田生态系统中由于人类的集约化耕作措施的影响,想维持土壤中养分平衡,施用有机肥、无机肥或有机无机混合肥是最有效并快速补充土壤养分的重要方法[22]。化肥能为作物提供大量的N、P、K用于合成植物生长所需的营养物质,不同的施肥量往往对土壤中微生物的影响也不同,烟田施用肥料的种类和用量,均会对土壤性质和微生物群落组成和结构功能产生影响[23]。研究表明,氮和钾对烤烟产量及品质具有非常重要的影响[24],因此植烟土壤中氮和钾通常残留量很大;本研究虽然设置了不同量梯度的氮和钾处理,可能由于残留因素,不同氮和钾梯度处理对土壤细菌3个多样性指数影响表现无明显差异,但不同磷梯度处理对土壤细菌3个多样性指数的影响具有一定的差异。
土壤微生物多样性与群落结构和生态功能稳定性之间总体上存在线性关系,一般情况下,土壤微生物丰度越高、群落组成结构越复杂,土壤微生态的功能稳定性越强[8],不均衡的施肥会导致土壤有效养分失衡,生产力下降,从而抑制土壤微生物活性,不利于参与土壤养分循环的微生物繁殖,进而导致土壤微生物多样性的下降[25]。土壤微生物丰度下降,导致土壤性质和土壤微生物群落对环境的应变能力降低、土壤微生态的稳定性下降,而当土壤微生物群落的丰度较高时,能够“持有”和“表达”不同的功能过程,群落才能更好适应环境,进而维持其功能[26-27]。在本研究不同养分互作条件下优势种群变形菌门α多样性比较中,发现在N=90 kg/hm2的处理中,不同磷、钾组合梯度可显著改变土壤优势种群变形菌门的Shannon指数和Simpson指数,说明在N=90 kg/hm2基础上,磷、钾的不同养分梯度均能显著改变土壤微生物群落丰度。
通过研究不同施肥条件下烟田土壤中细菌群落结构组成差异,试图从土壤微生物多样性的角度解释不同施肥处理下土壤细菌群落结构的变化。玉钰等[28]研究表明,在烟田长期施用有机肥或有机无极混合肥会明显提高土壤质量,增加土壤细菌丰富度,维持烟田土壤质量和微生物结构。反之,土壤微生物的组成结构和丰度也映土壤质量。微生物的群落丰度越高,土壤的物质代谢越快,土壤质量越好。有研究表明,土壤微生物群落多样性与土壤养分含量呈正相关[29],而土壤微生物的组成结构也反映土壤质量,在烟田土壤微生物组成中,细菌数量占绝对优势,其次是放线菌,真菌数量最少[30],本次试验占比最多的细菌优势门类为变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),放线菌门(Actinobacteria),拟杆菌门(Bacteroidetes),芽单胞菌门(Gemmatimonadetes),绿弯菌门(Chloroflexi),厚壁菌门(Firmicutes),这些优势群落占所有有效序列的90%以上,这与杨帅等[31]的在不同轮作方式下烟田土壤细菌群落组成类似。土壤真菌群落主要由子囊菌、担子菌和接合菌构成,子囊菌为优势菌群[32]。本次试验未研究云南植烟土壤真菌群落结构与多样性,但有研究表明,土壤真菌群落对烤烟产量有显著的负效应,真菌群落丰度和群落多样性对烟草有一定的负影响[33]。综上所述,烟田合理的施肥制度能增加有益细菌并降低病原真菌的丰度和群落多样性,这些复杂的土壤微生物组成结构和丰度共同作用于土壤物质代谢循环,反映土壤质量,最终影响烟草产量和品质。
试验通过16S rRNA 高通量测序技术检测云南植烟土壤微生物群落组成及其相对丰度,克服了传统微生物多样性研究方法的局限性,能更迅速、直接、低成本反映出土壤DNA的丰度[15]。这些研究有助于明确如何通过合理施肥来管理土壤微生物,增加土壤微生物群落多样性,相关研究表明,适宜施肥方式可以有效改善烟田土壤微生物,稳定土壤结构和土壤微生态环境,提高烟草产量和品质[34],最终促进种地与养地相结合的烟田资源可持续利用提供依据。
4 结 论
本研究表明,在烟草根际土壤中,不同梯度施用量的氮、磷、钾在提高土壤养分的同时,也提高了土壤微生物的丰富度,氮、磷、钾不同养分梯度组合显著改变了土壤优势种群变形菌门的多样性。在烟田中不同施肥处理条件下土壤细菌域有7个优势种群,依次为变形菌门,酸杆菌门,放线菌门,拟杆菌门,芽单胞菌门,绿弯菌门,厚壁菌门,这些优势群落占所有有效序列的90%以上,相对于不同氮、钾梯度施用量,不同磷梯度的养分用量对烟田土壤细菌群落的多样性具有显著影响。在不同梯度施肥作用条件下,施肥改变了土壤的主要化学性质,进而导致了土壤细菌群落结构的改变,合理的施肥制度能很好的保持土壤微生物群落生态系统,促进种地与养地相结合的烟田资源可持续利用。
