鼻咽癌T1 mapping对临床分期的价值及与EGFR、Ki-67指数相关性研究
2022-05-28邓凌达郭保亮杜勇兴胡秋根
邓凌达,郭保亮,杜勇兴,胡秋根
作者单位:南方医科大学顺德医院(佛山市顺德区第一人民医院)放射科,佛山528306
鼻咽癌是一种头颈部常见的恶性肿瘤,具有较明显的区域聚集性,在我国南部、东南亚和北非发病率较高[1]。鼻咽癌对放化疗敏感[2],但仍有部分晚期患者会出现肿瘤复发,给临床带来了严峻的考验。准确的鼻咽癌分期对于临床上制订治疗方案尤为重要,鼻咽癌N 分期用于评估淋巴结转移风险,T分期用于评估肿瘤周围组织受侵犯情况,提示局部复发风险,近年来,各种用于鼻咽癌临床分期及预后研究的MRI功能成像,比如扩散峰度成像[3]、三维准连续动脉自旋标记[4]及体素内不相干运动扩散加权成像[5]易受诸多因素限制,T1 mapping通过便捷、无创性地实现T1 值量化,可非侵入性地对生物组织特性进行定量分析[6]。T1 值具有较好的稳定性及可靠性[7],可以反映肿瘤细胞密度、含水量、多肽和蛋白质等大分子组织含量以及微坏死成分等[8],而引入对比剂后的T1post主要受肿瘤血流灌注、血管通透性及肿瘤细胞密度等因素影响[9],由此得到的T1 值差值是生物组织特性的综合反映。T1 mapping的应用研究已从心血管成像[10-11]扩展到其他部位,如肝功能的测定[12-13]以及宫颈癌组织学特征的诊断价值[14],而T1 mapping 与鼻咽癌的相关研究未见报道,本研究旨在探讨T1 mapping 与鼻咽癌分期及表皮生长因子受体(epidermal growth factor receptor,EGFR)和Ki-67指数的相关性,无创性预测鼻咽癌分期及增殖程度,为个体化治疗方案的制订和预后的预测提供依据。
1 材料和方法
1.1 研究对象
本研究为回顾性研究,收集2021 年3 月至11 月在南方医科大学顺德医院就诊的鼻咽癌患者病例。纳入标准:(1)经病理首次确诊的鼻咽癌患者;(2)临床、MRI、病理资料完整。排除标准:(1)曾在头颈部接受过放射治疗或化疗者;(2)过去5年内有任何其他恶性肿瘤者;(3)严重的神经或精神疾病患者。依据中国鼻咽癌分期2017 版指南[15],鼻咽癌临床分期包括0 期(TisN0M0)、Ⅰ期(T1N0M0)、Ⅱ期(T0-1N1M0,T2N0-1M0)、Ⅲ期(T0-2N2M0,T3N0-2M0)、ⅣA期(T4N0-3M0,T0-3N3M0)和ⅣB期(任何T、N 和M1)。将入组的病例分为高、低分期2 个组别,其中临床Ⅰ、Ⅱ期及T1、T2期和N0、N1期归入低分期组,临床Ⅲ、Ⅳ期及T3、T4期和N2、N3期归入高分期组。本研究经南方医科大学顺德医院伦理委员会批准,免除受试者知情同意,批准文号:202100917。
1.2 扫描方法及技术参数
应用Siemens Magnetom Skyra 3.0 T 磁共振扫描仪和8 通道相控阵头颈线圈。MRI 扫描范围从颅底至第一胸椎水平。扫描序列包括:平扫T1WI:TR/TE 774 ms/11 ms,FOV 200 mm×200 mm,层厚3 mm,层间距0.3 mm;T2WI及FSE T2WI压脂序列:TR/TE 5860 ms/76 ms,FOV 200 mm×200 mm,层厚3 mm,层间距0.3 mm。增强扫描:经肘静脉高压注射器注入钆喷酸葡胺(Gd-DTPA,马根维显,德国Bayer 公司),剂量为0.2 mL/kg。T1 mapping 采用多翻转角成像技术,主要参数:双翻转角(3°、15°),TR/TE 5.59 ms/2.46 ms,层厚3 mm,FOV 200 mm×200 mm,矩阵224×320。注射对比剂后约5 min 再行T1 mapping序列的扫描。
1.3 图像分析
将图片数据导入SYNGO Via 后处理工作站进行分析,由2 名放射科医师(有2 年以上工作经验)协商,在对患者的临床病理资料不知情的情况下,取最大横截面瘤体实性成分,避开出血、坏死液化区,手动绘制感兴趣区(region of interest,ROI),同时在病灶同侧C3 水平胸锁乳突肌手动勾画ROI,测量增强前后的T1值,得出增强前肿瘤区T1值(T1pre)、增强后肿瘤区T1 值(T1post)、增强前后肿瘤区T1 差值(ΔT1)、增强前肿瘤区与同侧胸锁乳突肌区T1 差值(ΔT1preS)及增强后肿瘤区与同侧胸锁乳突肌区T1差值(ΔT1postS)。
1.4 EGFR与Ki-67指数表达的免疫组化检测与结果判读
48 例鼻咽癌组织标本首先脱蜡、水化,EDTA 法修复抗原,接着切成4 μm 切片。由2 名高年资病理医师采用双盲法进行阅片,在每个组织切片上随机选择5 个视野,每个视野计数100 个肿瘤细胞。采用迈新生物技术公司生产的商品化试剂盒进行Ki-67单抗的免疫组织化学染色,记录5个高倍镜视野下阳性染色细胞的平均百分比;EGFR 免疫组织化学染色则采用德国默克制药生物科技公司生产的商品化试剂盒进行,染色分级为0~3+。0:<10%的癌细胞细胞膜染色不完整或较弱;1+:≥10%的癌细胞细胞膜染色不完整或较弱;2+:>10%的癌细胞细胞膜呈中度染色且<10%的癌细胞细胞膜染色强而完整;3+:≥10%的浸润性癌细胞细胞膜染色强、完整、均匀[16]。
1.5 统计学方法
用SPSS 25.0统计学软件分析数据,采用Kolmogorov-Smirnov法检验计量资料是否符合正态分布,符合正态分布数据以均数±标准差表示。采用两独立样本t检验比较高、低分期间T1 值差异有无统计学意义,并用受试者工作特征(receiver operating characteristic,ROC)曲线评估诊断效能。T1 值与Ki-67 表达分数的相关性采用Pearson 相关分析,T1 值与EGFR 的相关性采用Spearman 相关分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 一般情况
本研究纳入的病例均为未分化型非角化癌,其中男34 例,女14 例,年龄(52±13)岁;Ki-67 表达分数(52±22)%;EGFR染色阴性8例,弱阳性(1+) 12例,阳性(2+) 10例,强阳性(3+) 18 例;低分期组:临床分期Ⅰ+Ⅱ期19 例、T 分期T1+T238 例、N 分期N0+N118 例;高分期组:临床分期Ⅲ+Ⅳ期29 例、T分期T3+T410例、N分期N2+N330例。鼻咽癌MRI及病理图像见图1。

图1 男,42 岁,鼻咽癌T2N2M0期,临床Ⅲ期。1A~1E:左侧咽隐窝消失,鼻咽顶后壁及左侧壁软组织增厚,呈均匀等T1 信号(1A),DWI 可见弥散受限(1B),增强扫描明显强化(1C)。T1 mapping 伪彩图示T1 值高的区域偏暖色调,着色偏红色,T1pre为2509.60 ms(1D),T1post为759.88 ms(1E)。1F:病理切片HE 染色,细胞核呈蓝色,细胞浆呈红色(40×);1G:表皮生长因子受体(EGFR)染色分级3+,细胞膜呈黄褐色,染色强、完整、均匀(40×);1H:Ki-67 免疫组化表达分数90%,细胞核呈黄褐色(40×)。注:T1pre、T1post表示增强前肿瘤区T1值、增强后肿瘤区T1值。
2.2 T1 mapping与鼻咽癌分期的关系
鼻咽癌高分期组的T1pre、ΔT1、ΔT1preS均值均比低分期组的高,T1post及ΔT1postS均值却恰好相反,T1pre、ΔT1、ΔT1preS对于临床分期、N 分期差异有显著的相关性(P<0.05),ΔT1preS对T分期差异没有统计学意义(P=0.197),T1post及ΔT1postS对鼻咽癌分期差异没有统计学意义(P>0.05),见表1。
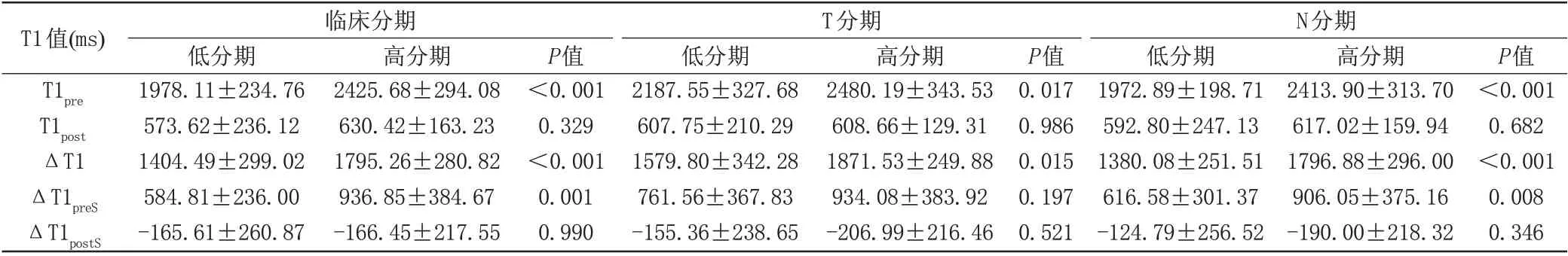
表1 T1值与肿瘤分期的关系
2.3 T1 mapping对于肿瘤分期的诊断效能
T1pre、ΔT1、ΔT1preS这三个参数中,T1pre用于评估临床分期、N 分期的AUC 最大,分别为0.927、0.913 (P<0.05),但对于T分期,ΔT1的AUC最大,为0.779 (P<0.05),如图2。T1值鉴别肿瘤分期的特异度、敏感度如表2。
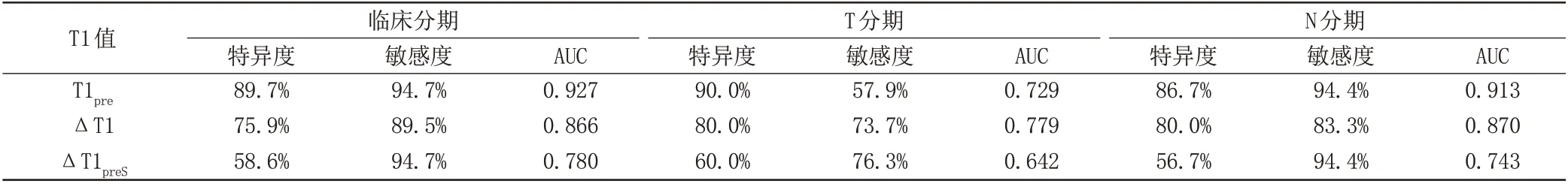
表2 T1值鉴别肿瘤分期效能

图2 鼻咽癌高低分期组间T1 值ROC 曲线图。2A、2B、2C 分别表示T1 值与临床分期、N 分期、T 分期的ROC曲线。
2.4 T1 mapping与EGFR和Ki-67指数的相关性
Spearman相关性检验结果显示,T1pre、ΔT1、ΔT1preS与EGFR呈正相关(r=0.61、0.39、0.46),Pearson 相关性分析显示三者与Ki-67指数同样呈正相关(r=0.54、0.45、0.42),见图3。
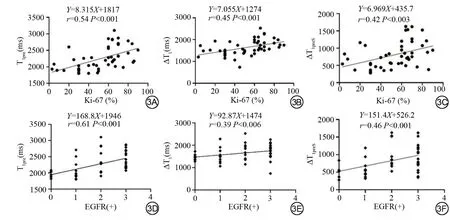
图3 T1 值 与EGFR 和Ki-67 指 数 的相关性。3A、3B、3C 分别表示T1pre、ΔT1、ΔT1preS 与Ki-67 的相关性;3D、3E、3F 分别表示T1pre、ΔT1、ΔT1preS与EGFR 的相关性。注:T1pre表示增强前肿瘤区T1值;ΔT1表示增强前后肿瘤区T1差值;ΔT1preS表示增强前肿瘤区与同侧胸锁乳突肌区T1差值。
3 讨论
准确的鼻咽癌临床分期、EGFR 和Ki-67 表达水平被认为是预测鼻咽癌局部复发、转移和预后的有效指标[17-19],本研究首次结合T1 mapping 探讨鼻咽癌分期及EGFR、Ki-67 指数的相关性,对于无创性预测鼻咽癌分期及增殖程度有一定的临床指导价值。
3.1 T1值预测鼻咽癌分期的分析
本研究结果表明,高分期组的ΔT1preS均值均比低分期组的高,而ΔT1postS均值却恰好相反,可能是由于随着肿瘤分期提高,细胞间质中微血管增多,T1 值变化明显[20]。增强前,高分期的肿瘤T1 值增高,同时由于肿瘤内未成熟的微血管增多,局部含水量增加,对比剂滞留时间延长,因此增强后高分期的肿瘤T1 值降低,而同侧胸锁乳突肌细胞间质中微血管数量变化不及肿瘤组织明显,T1值变化也不及肿瘤区明显,所以注入对比剂前后,两者的差值会出现相反的结果。低分期组别的T1pre、ΔT1、ΔT1preS均值均比高分期组的低,且差异具有统计学意义,可能因为鼻咽癌是一种未分化的、均质的实体瘤,肿瘤内部细胞密度高,坏死的成分比例低,而且随着肿瘤分期的提高,细胞增殖变得更加频繁,大分子蛋白过度表达,细胞密度愈加密实,所需要的血供增多,相应血流灌注水平也相应提高,这与朱娟等[21]、Ai 等[22]的研究结果一致。另外,本研究发现,T1pre对于鼻咽癌临床分期及N分期的鉴别效能最高,AUC分别是0.927 和0.913。因此,T1 mapping 可以非侵入性地反映肿瘤细胞密实程度及血流灌注状态,为鼻咽癌临床分期提供一定指导意见。
3.2 T1值预测鼻咽癌增殖程度的分析
本研究发现,T1pre与EGFR、Ki-67指数均呈中度正相关(r=0.61、0.54,P<0.05)。由于高分期的肿瘤体积大而不规则,与低分期肿瘤相比,具有不同的灌注特性及更强的侵袭性。高分期的肿瘤细胞增殖快,细胞密度大,侵袭性强,EGFR 和Ki-67 表达水平增高;同时,高分期肿瘤内未成熟血管生成增多,多肽、蛋白质等大分子含量增多,T1pre值相应增大。部分学者[16,23]认为,EGFR 的升高、Ki-67 的高表达与诱导肿瘤内血管形成、微血管密度增加密切相关,其表达变化可一定程度反映肿瘤的增殖活性,在多种肿瘤中均可见表达,如肺癌[24]、鼻咽癌[25]等,与本次的研究结果相似。Ki-67的高表达还与放疗抵抗、侵袭性有关,是预测鼻咽癌患者预后的可靠指标。所以,T1 mapping 通过侧面反映鼻咽癌组织的EGFR 和Ki-67 表达水平,可以提示一定的生物学特性,无创评估肿瘤组织侵袭性和增殖潜能,一定程度上提示患者预后水平。
3.3 研究的局限性及展望
本研究仍存在一定的不足:(1)研究中样本量偏小,后续将进一步扩大样本量,提高结果的准确性。(2)纳入研究的病例均为未分化型非角化癌,缺乏其他病理类型,需进一步扩大样本量。(3)患者未知的心排血量可能会影响肿瘤区T1 值测量的准确性,因此纳入ΔT1 减少测量误差。T1 值对于鼻咽癌患者的近期疗效及预后有待进一步研究。
综上所述,T1 mapping 作为一项无创性的MRI 技术,可以方便快捷地测量病变的T1值,就本研究而言,T1pre对鼻咽癌临床分期及N 分期的诊断效能、与EGFR 和Ki-67 相关性检验结果均高于ΔT1、ΔT1preS,可以一定程度上避免鼻咽癌患者对外源性对比剂过敏的现象。所以T1pre对鼻咽癌的临床分期、增殖程度等具有重要的指导意义,有利于个体化治疗方案的制订,降低肿瘤复发及转移的风险,提高患者的预后。
作者利益冲突声明:全部作者均声明无利益冲突。
