阿尔茨海默病默认网络和海马功能连接研究:一项基于SDM的Meta分析
2022-05-28陆冠琴张守字李锐
陆冠琴,张守字,李锐*
作者单位:1.中国科学院心理健康重点实验室(中国科学院心理研究所),北京100101;2.中国科学院大学心理学系,北京100049;3.北京老年医院精神心理科,北京100095
阿尔茨海默病(Alzheimer′s disease,AD)是老年群体中常见的一种神经退行性疾病,其神经病理学改变主要体现为神经纤维缠结和淀粉样蛋白沉积[1]。随着影像学技术的发展,正电子发射计算机断层扫描(positron emission computed tomography,PET)、磁共振成像(magnetic resonance imaging,MRI)、功能磁共振成像(functional magnetic resonance imaging,fMRI) [尤其是静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)]等成像技术被广泛应用于AD 脑成像研究。影像学研究认为AD是一种“失连接综合病”[2,3],表现为脑网络静息态功能连接(resting-state functional connectivity,rsFC)的异常[4],尤其是高级认知网络[5,6]。
默 认 网 络(default-mode network,DMN)是AD 病理特征的核心网络[7],该网络主要包括后扣带回(posterior cingulate cortex,PCC)、内 侧 前 额 叶(medial prefrontal cortex,MPFC)、楔前叶和顶下小叶等区域,并与海马、海马旁回等内侧颞叶系统存在连接。Greicius 等[8]基于独立成分分析(independent component analysis,ICA),首次发现AD 患者DMN rsFC存在异常,表现为PCC 和海马之间的rsFC 下降,提示DMN异常的脑活动变化是早期识别AD的生物学标志。随后近二十年神经影像学研究围绕AD开展了大量研究,这些研究为AD 患者基于DMN 和海马为种子点的rsFC 异常提供了丰富的证据[9-13]。许多研究表明在正常衰老和AD 的过渡阶段-轻度认知障碍(mild cognitive impairment,MCI)中DMN rsFC 已发生异常,主要表现为rsFC 下降[14-16],然而也有研究证实了他们还存在不同的rsFC 模式。例如Qi 等[17]基于ICA 发现MCI患者的双侧楔前叶、PCC、右侧顶下小叶rsFC下降,而MPFC、顶下小叶、颞中回rsFC增加。Gardini等[18]发现MCI 患者PCC 与MPFC 之间rsFC 增加。通过对DMN脑区的进一步划分,有研究表明AD 患者DMN 脑区也存在不同的rsFC 模式。例如Damoiseaux 等[19]基于ICA发现AD患者DMN后部rsFC下降,而DMN前部rsFC增加。Chiesa等[20]对携带AD遗传风险的个体研究结果也表明DMN 后部rsFC 下降,而DMN 前部和外部的rsFC增加。
海马是连接大脑内侧颞叶系统前颞区域(anterior-temporal,AT)和后内侧区域(posterior-medial,PM)的重要脑区[21-22]。AT 主要包括外侧颞叶皮层、外侧眶额皮层和杏仁核;PM 包含DMN 部分区域、丘脑和枕叶[23-24]。大多数的研究表明,MCI 和AD 患者海马和PM 网络中的DMN 区域(如PCC)之间rsFC 下降[25-26]。但Gardini 等[18]探讨MCI 患者语义记忆障碍与脑网络rsFC 之间关系的研究表明,PCC 与海马之间的rsFC增加。Miller等[27]基于认知任务,发现MCI患者海马的激活程度先增加后下降,并认为该模式的拐点可作为认知行为异常的标志。这些研究结果的不一致性反映了AD 发生发展过程中,全脑rsFC 基于DMN 及海马为种子点发生变化的复杂性,因此对其rsFC 的变化模式仍需进一步明确。
DMN 及海马受损与AD 患者认知损害的严重程度有关,MPFC、PCC 及海马等脑区在情景记忆的编码和提取等认知过程中起关键作用[7,28]。DMN 连接异常与AD 病程之间有较强的相关性[29]。PCC、楔前叶及海马为功能易损区,其rsFC下降及内侧颞叶、眶额结构的萎缩可识别转归为AD 的MCI 患者[30],Ibrahim 等[31]基于机器学习方法发现DMN 的节点可区分AD 和MCI 患者。此外,AD 最早的临床阶段表现为主观认知下降,该阶段患者双侧海马尾部的灰质体积显著减少,且伴随着rsFC 下降[32],rsFC 改变可能是认知下降的早期迹象[33-35],Xu 等[36]采用机器学习方法发现DMN 和双侧海马间异常的连接模式可有效识别患者主观认知下降。因此,研究DMN 及海马对于理解AD 的早期识别标志具有重要意义。
MCI 和AD 患者的DMN 和海马的连接模式复杂而多变。虽然目前尚未发现DMN连接指标可以作为MCI或AD 患者确切的生物标志物[37],但rsFC 仍有望用于AD 的早期诊断[38]。AD 患者DMN 和海马区域异常的连接模式是目前研究普遍的共识,但异常模式具体表现为rsFC 降低和增加同时存在。其次,目前还没有大量的研究表明这些改变是如何随着疾病的发展而变化[39],同时也缺乏在大尺度脑网络水平上总体描述MCI 和AD 影响脑网络连接的研究[38]。因此,DMN 和海马区域与AD 病程相关的连接模式仍需进一步探究。以往关于AD、MCI患者研究结果的不一致性可能是受到单个研究的被试数量较少、特定实验操作等原因的影响。基于此,本研究采用标记差异映射分析(signed differential mapping,SDM)进行Meta 分析,在增加研究被试数量的同时对以往的研究结果进行二次系统地分析,以此来发现AD 和MCI 患者rsFC 的变化特征,增加以往研究结果的可信性,并为AD的早期识别或早期干预提供影像学依据。
1 方法
1.1 文献选取
系统检索了PubMed、Web of Science 数据库,文献发表时间为2000 年1 月至2020 年9 月。检索关键词 包 括“mild cognitive impairment”“MCI”“Alzheimer”“Alzheimer′s”“AD”“older”“elderly”“aging”and“functional magnetic resonance imaging”“functional MRI”“fMRI”and“rest”“resting”and“connectivity”。纳入标准:(1)基于种子点分析全脑rsFC 的研究;(2)报告AD、MCI 患者与健康对照组(healthy controls,HC)之间存在显著的rsFC 差异;(3)报告组间比较具有统计意义的空间坐标[使用蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)或Talarach 空间坐标系]。排除标准:(1)使用基于rs-fMRI 以外的神经成像方法,如任务态、PET;(2)基于种子点分析全脑rsFC以外的方法;(3)缺乏年龄相匹配的HC;(4)缺乏基线数据比较的纵向研究;(5)仅报告组内比较结果的研究;(6)未提供组间比较具有统计意义的空间坐标。
1.2 数据分析
采用SDM软件对纳入的文献进行Meta分析,即提取研究中AD、MCI患者相对于HC组rsFC有显著性差异的脑区坐标和t值,如纳入的研究结果为z值或P值,需要将其转换为t值(使用www.sdmproject.com/utilities/?show=Statistics)。本研究采用无阈值簇群增强(threshold free cluster enhancement,TFCE)对rsFC有显著差异的区域进行校正。
2 结果
2.1 纳入分析的文献
运用以上关键词进行主题检索,共检索到5234 篇文献。排除重复文献947 篇,根据标题、摘要排除被试非AD、MCI 患者、非rsFC 等3809 篇,通过全文精读排除442 篇(其中综述169 篇,非种子点分析193 篇,无对照组、无统计学意义的空间坐标等80篇)。根据以上步骤排除后剩36篇文献,通过参考文献补充了7篇文献。
由于有文献未报告种子点所在的脑网络,我们将其按照Yeo的7个脑功能网络模板[40]进行归类。关于AD 文献25 篇,MCI 文献共有18 篇。其中,研究AD DMN 文 献 有5 篇、边 缘 网 络6 篇(海 马4 篇、杏 仁 核2 篇)、额顶网络3 篇,突显网络2 篇,背侧注意网络2 篇,腹侧注意网络2 篇,其他5 篇;研究MCI DMN 3篇、边缘网络4篇(海马1篇、梭状回2篇、丘脑1篇)、额顶网络4 篇、突显网络3 篇、背侧注意网络2 篇,腹侧注意网络2 篇。基于DMN、海马与AD 关系密切,我们将其作为种子点探讨其在AD和MCI中rsFC的变化情况。最终纳入Meta 分析文献12 篇,其中研究AD 9 篇(以DMN 脑区为种子点5 篇,以海马为种子点4篇),MCI 3篇(均以DMN脑区为种子点),见表1、图1。纳入研究均通过同行评议。
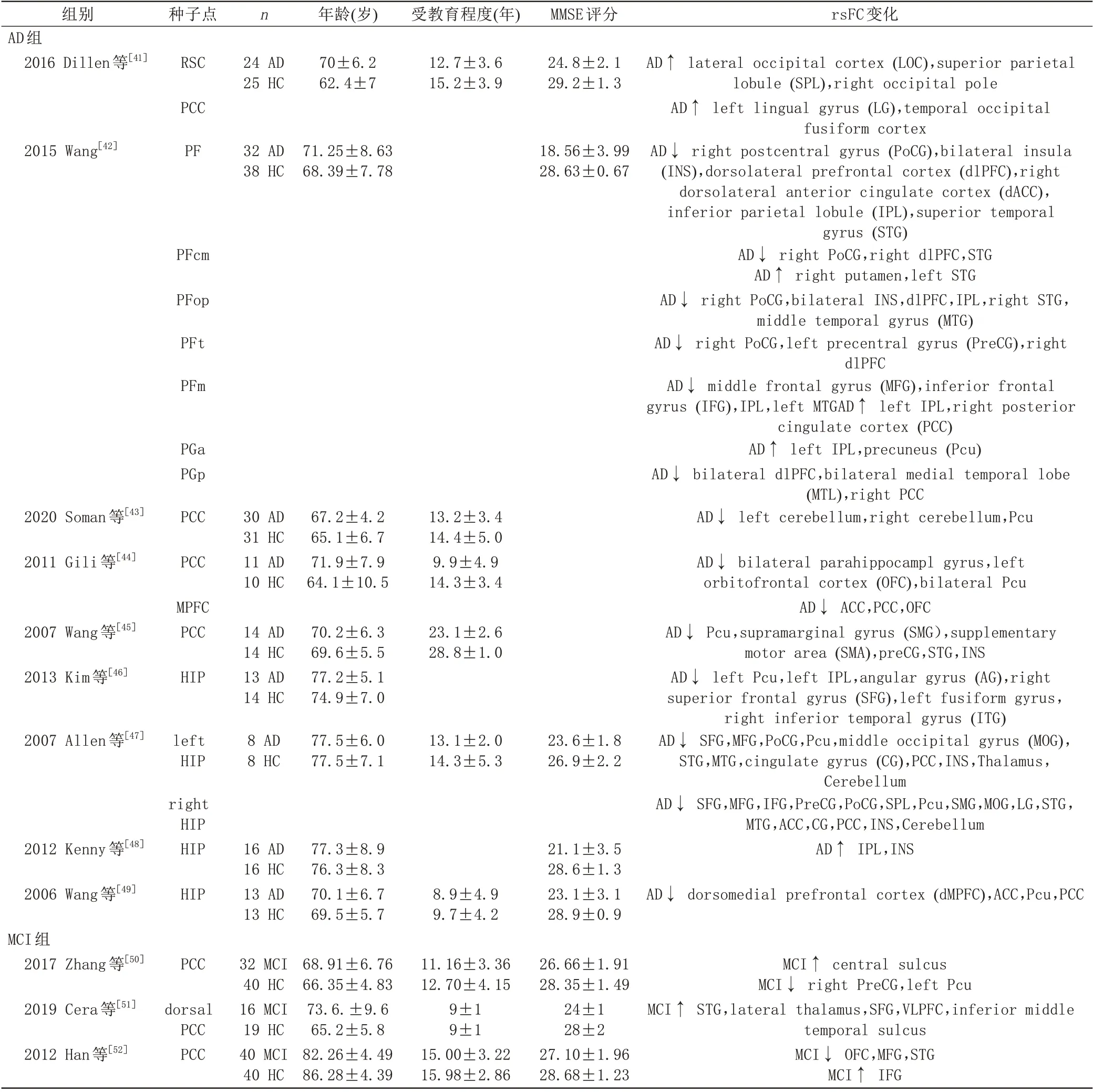
表1 AD、MCI组Meta分析纳入文献情况Tab.1 Study include in the Meta-analysis in AD and MCI
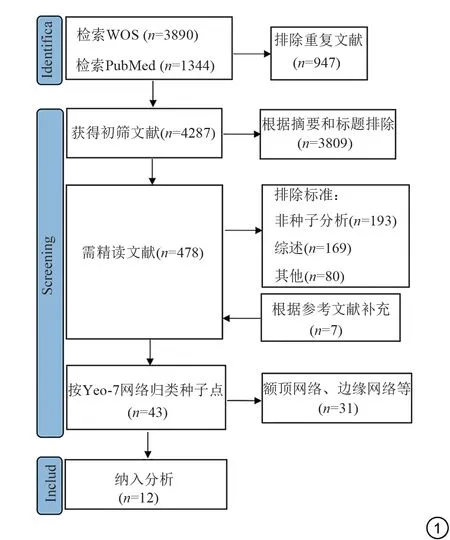
图1 研究筛选过程。Fig.1 Study selection process.
2.2 Meta分析结果
以海马为种子点,AD 较HC 组MPFC rsFC 显著下降(P<0.05,TFCE 校正;图2A)。在未校正水平(P<0.05)下,AD 右侧角回和楔前叶等DMN 脑区的rsFC 也出现下降(表2、图2B)。
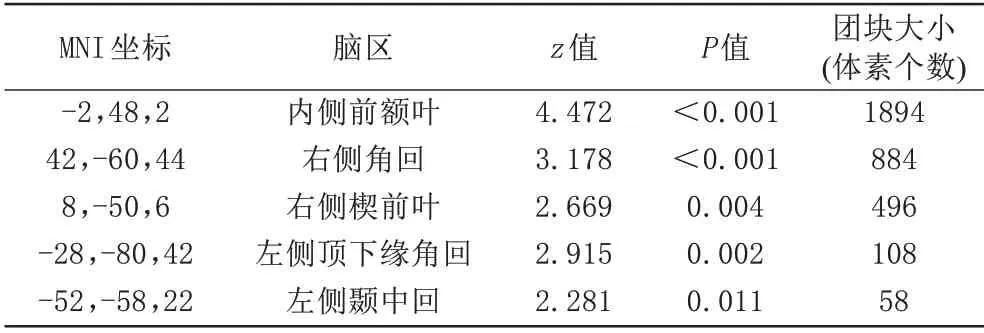
表2 AD以海马为种子点rsFC改变的区域Tab.2 Altered regions of rsFC with hippocampal as the seed in AD

图2 阿尔茨海默病组以海马为种子点静息态功能连接降低的脑区。2A:P<0.05,无阈值簇群增强(TFCE)校正;2B:P<0.05,未校正。 图3 阿尔茨海默病组以默认网络为种子点静息态功能连接降低的脑区(P<0.05,未校正)。 图4 轻度认知障碍组以默认网络为种子点静息态功能连接改变的脑区降低(蓝色),静息态功能连接增加(红色) (P<0.05,未校正)。Fig. 2 Brain regions of Alzheimer's disease show decreased rsFC with hippocampal as the seed. 2A: P<0.05, corrected with threshold free cluster enhancement(TFCE);2B:P<0.05,uncorrected.Fig.3 Brain regions of Alzheimer's disease show decreased rsFC with default-mode network as the seed (P<0.05,uncorrected).Fig. 4 Brain regions of mild cognitive impairment show decreased rsFC (blue) and increased rsFC (red) with default-mode network as the seed (P<0.05,uncorrected).
以DMN 脑区为种子点,在TFCE 校正水平下未发现显著结果。在未校正水平(P<0.05)下,AD 患者左侧中央沟盖、右侧海马旁回等脑区的rsFC 较HC 组下降;MCI 患者较HC 组的右侧PCC rsFC 下降,而右侧中央前回rsFC增加(P<0.05;表3,图3、4)。
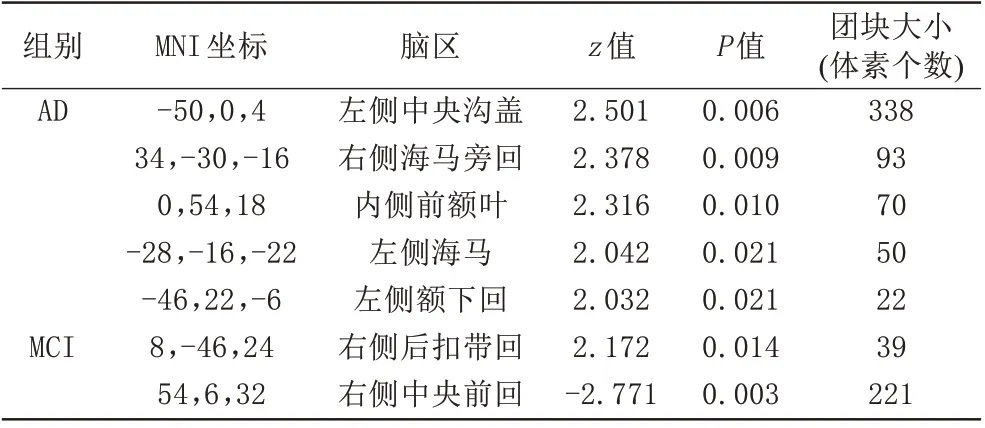
表3 AD、MCI以DMN为种子点rsFC改变的区域Tab.3 Altered regions of rsFC with DMN as the seed in AD and MCI
3 讨论
基于DMN 和海马脑区在AD 病理生理机制中起关键作用,我们将其作为种子点,对MCI、AD患者的rsFC变化进行了Meta 分析。以海马为种子点,AD 患者DMN 前部区域MPFC rsFC 显著下降;角回、楔前叶等DMN后部区域rsFC下降。以DMN脑区为种子点,AD患者MPFC、中央沟盖、海马和海马旁回等区域rsFC 下降;MCI 患者PCC rsFC 下降,而右侧中央前回rsFC 增强。本研究结果明确了DMN 和海马在AD 和MCI 的不同变化模式,可为AD 的识别和干预效果评估提供影像学参考。
3.1 AD患者脑网络rsFC变化
海马与MPFC 之间rsFC 显著下降是AD 患者的重要特征。MPFC 与认知加工密切相关,其rsFC 异常先于其他脑区的结构性病理改变[53],这为研究者将MPFC 的异常变化作为潜在的生物标志提供了依据。如Josef Golubic等[54]基于脑磁图识别AD患者的研究表明,MPFC 的激活异常有望成为诊断AD 的生物学标志。此外,海马和MPFC在处理信息中分别扮演“驱动”和“聚集”枢纽的角色。海马是影响脑功能活动的重要驱动力,而MPFC 是汇聚信息的重要整合力[55],两者之间的通路对记忆、学习等高级认知功能起关键作用[56-57]。我们的结果发现AD 患者海马和MPFC 之间rsFC 显著下降,表明该rsFC 异常是AD患者认知受损的重要特征。
AD患者海马与角回、楔前叶等DMN后部区域之间的rsFC 下降,这一发现与Li 等[58]先前的Meta 分析结果一致。本研究结果支持了先前认为其易受病理学影响的研究[59]。AD 的病理学研究表明,神经纤维缠结最早发现于内侧颞叶结构,海马是首先受到影响的大脑区域之一[60],其rsFC强度与内侧顶叶的tau蛋白积累相关[61]。DMN 也容易受到tau 蛋白的影响,该脑区与tau病理聚集的脑区相重叠[62]。PET研究也表明AD 患者早期的DMN rsFC 就已受到脑病理改变的影响,其rsFC下降与淀粉样蛋白沉淀有关[63-64]。随着淀粉样蛋白的累积,DMN rsFC 先增加后降低[65],而Jones 等[66]通过研究AD 不同阶段(前临床期、前驱期及临床期) DMN 的子系统表明,DMN 后部rsFC 下降先于淀粉样蛋白沉淀,提示DMN 后部rsFC 异常可能是AD潜在的生物学标志。此外,Zhao等[67]分析DMN与认知之间关系的研究表明,与HC组相比,AD患者楔前叶rsFC降低,且与简易精神状态检查量表(MMSE)评分显著正相关。Wang等[68]基于多种rs-fMRI的研究表明,角回rsFC 变化在ROC 曲线分析中表现最佳,能有效预测AD患者。
DMN 与海马旁回、中央沟盖间rsFC 下降,这一发现支持了海马旁易受病理学影响的研究。Ge 等[69]基于PET 的研究表明,与淀粉样蛋白阴性组相比,AD 患者海马旁回tau 蛋白沉淀显著增加。Park 等[70]研究也发现AD患者中央沟盖rsFC降低。
3.2 MCI患者脑网络rsFC变化
MCI 和AD 患者的连接模式不一致,具体表现为MCI 患者PCC rsFC 下降而中央前回增加。PCC 是AD早期最脆弱的脑区之一[71],其rsFC 异常为更好地理解MCI 患者的大脑机制提供一个新思路[51],如PCC 可能是监测AD 进展的影像学标志[72]。Ibrahim 等[31]基于机器学习分析MCI 患者DMN 连接模式的研究表明,PCC 与前扣带回之间的rsFC 下降。Sörensen 等[73]基于PET 的研究也表明,PCC 的脑糖代谢模式有望预测转归为AD的MCI患者。
MCI 患者DMN 与中央前回之间rsFC 增加可能是代偿脑机制起作用的结果。中央前回与感觉运动、注意等认知过程有关。Min 等[74]基于脑功能局部一致性(regional homogeneity,ReHo)分析,发现遗忘型MCI 患者中央前回、额下回等区域的ReHo 增强。Behfar 等[75]基于脑区体积变化及图论分析表明,MCI患者中央前回、额中回等脑区虽然局部萎缩,但其与认知相关的脑区rsFC 增加,提示该现象可能是代偿机制作用的结果。Lenzi 等[76]通过注意任务发现MCI患者中央前回的激活高于HC 组,且该脑区的激活程度与神经心理学评分强相关,提示中央前回激活增加可能与代偿机制相关。Wang 等[77]通过个体代谢连接组学表明,中央前回、楔前叶及额下回等脑区的代谢异常可有效识别转归为AD 的MCI 患者。我们基于Meta 分析的结果进一步明确中央前回可能是参与MCI 代偿机制的重要区域。这些代偿机制通过调用其他脑区参与认知活动来减缓与脑损伤相关的认知缺陷,但随着病情的加重,发挥代偿的脑区最终也会受损,甚至无法发挥作用。因此,某些脑区表现出rsFC异常增加的现象在AD后期阶段可能会消失。
3.3 局限性
本研究存在一定的局限性。首先,本研究采用了较为严格的排除标准,导致最终纳入分析的文献数量较少,削弱了rsFC的变化发现。MCI患者以海马为种子点文献数量只有1 篇,故未将其纳入Meta 分析。由于文献数量较少,未能实现按照Yeo 的7 个脑功能网络作为种子点分析全脑的rsFC。MCI 和AD 患者通常伴随着认知能力的下降,而认知能力与注意网络、突显网络、额顶网络关系密切,后续的研究可以进一步扩大脑网络将其作为对象进行探讨,为确定AD 不同阶段特有的rsFC 变化模式提供影像学依据。其次,本研究纳入的研究全部集中在rsFC上,而多参数MRI的结合可以提高诊断MCI和AD的准确性。近年来,动态功能连接在区分健康人群和AD 患者研究方面取得了重要进展[78]。结构磁共振成像和功能磁共振成像的结合可以提供大脑结构和功能变化的信息,进一步分析脑影像变化与认知表现之间的相关关系等,这些方法均有助于疾病的识别和预测。
本研究基于Meta 方法对MCI 和AD 患者以DMN 和海马为种子点的rsFC改变进行了系统量化分析。结果表明,海马与MPFC之间rsFC显著下降是AD患者重要的脑影像特征。MCI患者DMN脑区与右侧中央前回间的rsFC 增加,提示该现象可能是代偿机制作用的结果。
作者利益冲突声明:全体作者均声明无利益冲突。
