基于图论分析对自闭症谱系障碍儿童脑功能网络异常拓扑学属性的研究
2022-05-28李玉爽敖亚雯赵益林杨华光查云飞
李玉爽,敖亚雯,赵益林,杨华光,查云飞
作者单位:武汉大学人民医院放射科,武汉430060
自闭症谱系障碍(autism spectrum disorder,ASD),又称孤独症,是一种常见的高度遗传的异质神经发育障碍性疾病[1]。ASD 患者的临床表现差异很大,主要表现为社会性交流交往障碍、重复刻板的兴趣与行为等。ASD 儿童往往不能正常生活,不仅危害自身健康发展,还给家庭和社会带来了沉重的负担。静息态功能磁共振成像技术的发展为无创探究ASD儿童脑部结构和功能异常提供了新的方法[2]。在此基础上,采用图论分析方法,构建了一个由许多节点(脑区)和边(脑区之间的结构和功能连接)构成的结构复杂的脑网络模型,不仅可以描绘脑区之间的相互连接情况,还可以通过检测和定量分析各脑网络特征属性变化探究中枢系统的微观变化。ASD 背后的功能机制目前尚不清楚,先前有大量证据表明ASD患者的大脑网络存在异常,主要表现在异常的区域内静息状态功能连接,如语言功能网络[3],社交功能网络[4]以及默认模式网络(default mode network,DMN)[5]等。他们只是从局部结构和功能改变上探讨ASD 的神经生物学基础,然而,脑区结构或功能异常可以映射到网络层面上,因此,从全脑功能网络层面上分析ASD 的异常改变将更有助于理解ASD 的病理生理机制。并且,之前的研究结果既有发现ASD的大脑功能连接增加,也有发现连接减弱的,大脑功能连接的结果不一致性可能与选取样本的年龄有关[6],也可能与研究的样本量有关[7]。本研究从国际自闭症脑成像交换数据库(Autism Brain Imaging Data Exchange,ABIDE)中选取足量的样本,利用图论分析的方法研究ASD 儿童(8~18 岁)全脑功能网络拓扑结构,使结果更具有说服力,为临床提供参考。
1 资料与方法
1.1 一般资料
本研究的数据来源于ABIDE (http://preprocessedconnectomes-project.org/abide)。该数据库包含了36 个国际站点的1060 例ASD 患者和1166 正常发育(typically developing,TD)者的脑功能成像及结构像数据,这些对象的年龄为6~65 岁。本研究中,ASD组的入组条件:(1)依据第4版《美国精神障碍诊断和统计手册》标准诊断为ASD;(2)年龄8~18 岁;(3)总智商评分≥70 分;(4)右利手;(5)影像学数据来自于睁眼状态时扫描。TD 组的入组条件:(1)性别及年龄与ASD 组相匹配;(2)总智商评分≥70 分;(3)右利手;(4)影像学数据来自于睁眼状态时扫描;(5)既往无神经或精神疾病如重度抑郁症、精神分裂症、癫痫或创伤性脑损伤等病史。本研究最终纳入符合条件的来自4 个站点(NYU、SDSU、PITT、UCLA)的130 例被试者,包括65 例ASD 儿童(男50 例、女15 例)以及65 例TD 儿童(男51例、女14例)。ABIDE数据库中的每个数据贡献者都通过了机构审查委员会的批准,所有的受试者(或其监护人)都签署了知情同意书。
1.2 临床量表评估
两组儿童均接受韦氏量表(Wechsler,1999)智商评估,得到言语智商(verbal intelligence quotient,VIQ),操作智商(performance intelligence quotient,PIQ) 和智商总量表(full-scale intelligence quotient,FIQ)的分值。本研究纳入的ASD儿童曾接受过孤独症诊断访谈量表修订版(autism diagnoses interview-revised,ADI-R,Lord,1994)评估[8],ADI-R主要通过评估ASD的社会交往、言语交流和重复刻板行为这3 个核心特征来确诊被评估者是否患有ASD。ADI-R量表评分方法因项目不同而异,一般按0~3分划分为4 个等级,其中0 分表示无异常;1 分为介于有或无此类症状之间;2分或3分表示此类症状存在,但在程度上存在差异。
1.3 图像预处理
采 用DPABI 工 具 包(4.1 版 本;http://rfmri.org/DPABI)基于Matlab 2011 a (MathWorks, Natick,MA, USA)平台对原始MRI 图像进行预处理。(1)将图像格式转换成NIFITI 格式;(2)剔除前10 个时间点;(3)时间层校正;(4)头动校正:将头动旋转角度>1.5°,平移>1.5 mm 的图像去除,计算每个被试的平均逐帧位移量(framewise displacement,FD),移除FD 大于0.5 mm 的时间点,并移除此时间点后面一个和前面两个时间点。本实验两组FD [ASD:(0.190±0.073);TD:(0.219±0.226);P=0.321]之间的差异无统计学意义,可排除头动对图像结果的影响[9];(5)将T1 加权像配准到功能像,并分割成灰质、白质、脑脊液,并去除协变量,如Friston 24 头动参数、线性趋势、全脑体积均值、脑白质及脑脊液信号;(6)校正的图像配准到SPM 12 (http://www.fil.ion.ucl.ac.uk)提供的标准模板,并采用全宽半高为8 mm 的高斯平滑核对图像进行平滑;(7)去线性漂移;(8)低频滤波(0.01~0.08 Hz)。
1.4 数据分析
采用Gretna (www.nitrc.org/projects/gretna/)软件依据AAL (anatomical automatic labeling)模板构建脑功能网络并分析其拓扑学指标。该图谱将大脑划为90个区,每个区域视为一个网络节点,提取每个区域所有体素的平均时间序列,计算每对节点平均时间序列之间的Pearson相关系数,得到一个90×90的相关系数矩阵,对相关系数r进行Fisherr到z变换,制作出大脑功能连接网络的模型。脑区相互之间功能连接强度的绝对值定义为“边”,将网络中实际存在的边的数量占最大可能边的数量的比例定义为网络稀疏度(sparsity,S)。本研究中选择在0.01<S<0.34,步长0.01 的情况下计算ASD 组和TD 组的拓扑学指标,主要包括几个常见的全局/节点参数:聚类系数(clustering coefficient,Cp)、特征路径长度(Characteristic path length,Lp)、标准化的聚类系数(γ)、标准化的特征路径长度(λ)、小世 界 指 数(σ)、全 局 效 率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)、节点效率(nodal efficiency)。其中σ=γ/λ,当满足γ>1、λ≈1、σ>1 时,表示该网络符合小世界的高效网络特性。
1.5 统计学分析
采用SPSS 22.0 软件对临床基本资料进行统计学分析。使用Shapiro-Wilk测试对所有数据进行正态分布测试。如果数据通过正态性检验,使用参数检验法,数据没有通过正态性检验,则使用非参数检验法。双样本t检验用来比较两组间在年龄是否有差异。统计ASD组的临床测评分数的均数及标准差。采用双样本t检验来比较两组间全脑及局部脑功能连接网络拓扑属性相关参数的差异,并进行FDR 校正。软件BrainNet Viewer 可以呈现节点中拓扑学属性存在显著差异的情况。P<0.05 表示差异具有统计学意义。
2 结果
2.1 临床基本资料比较
ASD 组的男女性别比为3.3∶1,TD 组的男女性别比为3.6∶1,两组在性别、年龄、FIQ、VIQ、PIQ 等方面的差异无统计学意义(P均>0.05) (表1)。
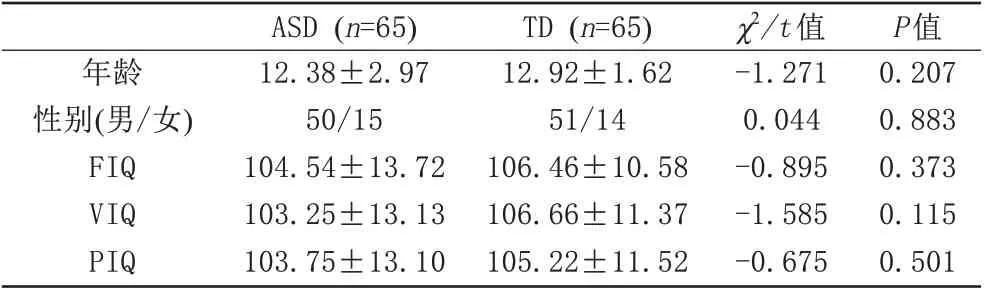
表1 两组人口统计学及临床基本资料Tab.1 Demographic and clinical characteristics of the two groups
2.2 两组全脑水平拓扑学指标改变
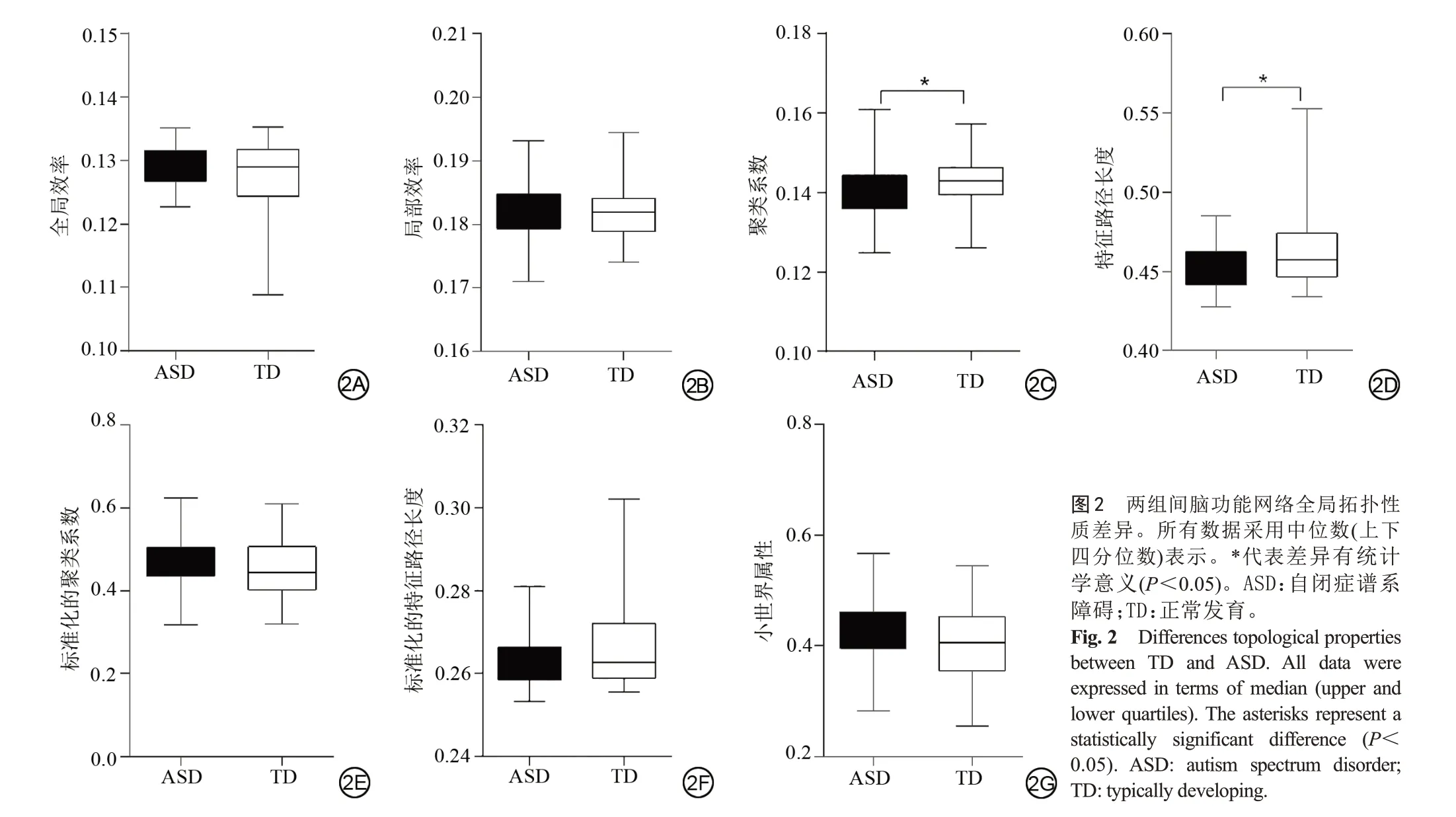
本研究中我们发现两组被试在整个稀疏度阈值范围内(0.1~0.34)均满足小世界网络属性,即γ>1,λ≈1(图1);然而,与TD 组相比,ASD 组的小世界网络属性出现改变。具体来说,ASD 组的Cp及Lp的曲线下面积明显低于TD组,差异具有统计学意义(P均<0.05);两组的Eglob、Eloc、γ、λ和σ大致相同,差异无统计学意义(P均>0.05) (图2,表2)。

图1 脑功能网络的小世界属性参数随稀疏度变化曲线图。ASD:自闭症谱系障碍;TD:正常发育。Fig. 1 The curve of the small world attribute parameters of the brain function network with sparsity. ASD: autism spectrum disorder; TD:typically developing.
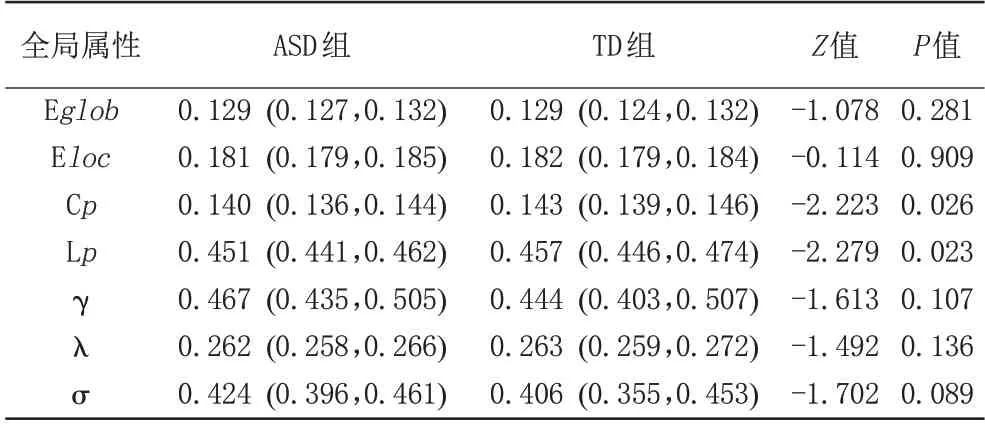
表2 两组全局网络属性比较Tab.2 Between-group comparison in global network metrics
2.3 两组节点水平拓扑学指标改变
与TD组相比,ASD组节点水平分析结果显示在双侧前扣带回、双侧尾状核、双侧海马、右侧顶下小叶这些脑区的节点效率减低(P<0.05) (表3、图3)。
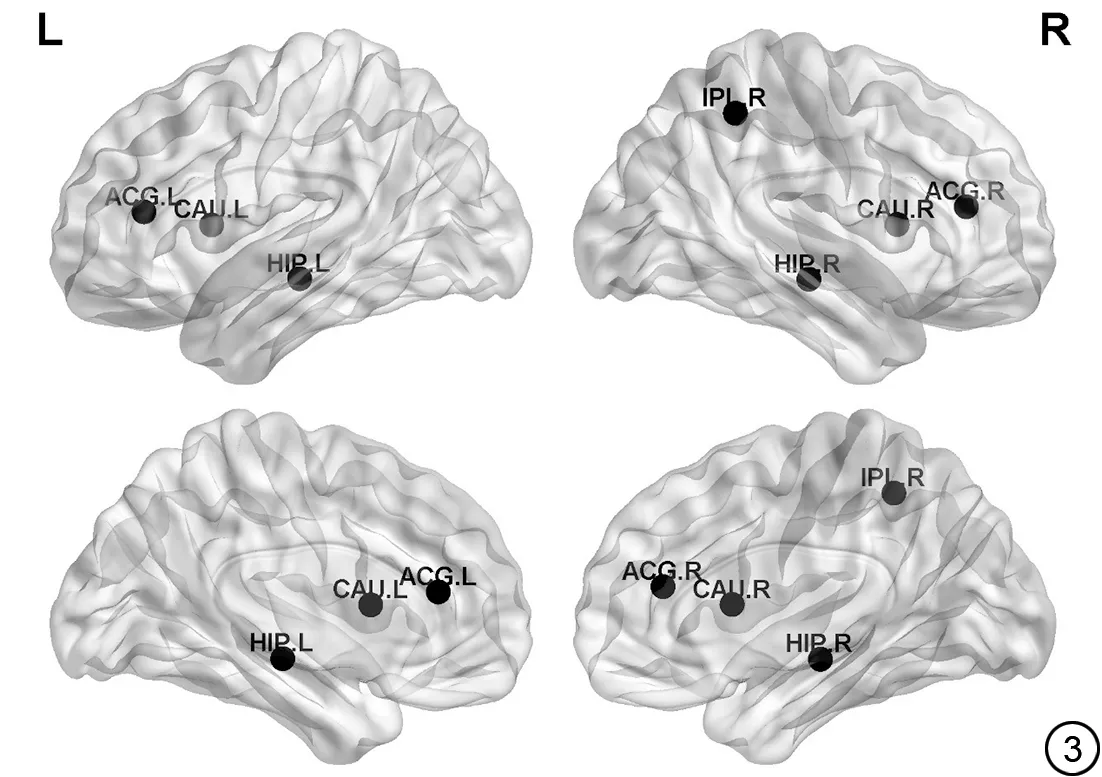
图3 自闭症谱系障碍组中节点属性改变存在显著差异的脑区。黑色表示属性减低。ACG:前扣带回及旁扣带脑回;IPL:顶下小叶;HIP:海马;CAU:尾状核。Fig. 3 Brain regions with significant differences in node attribute changes in autism spectrum disorder groups. Black balls represent the areas of decreased nodal efficiency. ACG: anterior cingulate gyrus and paracingulate gyrus; IPL: apical and inferior lobule; HIP: hippocampi.CAU:caudate nucleus.

表3 自闭症谱系障碍组较正常发育组节点效率减低的脑区Tab.3 Brain regions which autism spectrum disorder group had lower node efficiency than typically developing group
3 讨论
本研究采用图论的方法研究ASD 组和TD 组全脑功能网络拓扑结构的差异。结果表明虽然ASD 组和TD 组都仍具有小世界网络属性,但是与TD 组相比,ASD 组全局/局部水平大脑网络拓扑学属性都发生了异常改变,具体表现为ASD组的Cp以及Lp降低,说明有向随机网络转变的趋势,其功能整合能力增强,功能分化能力降低,并且在双侧前扣带回、尾状核、海马及右侧顶下小叶等这些脑区出现了脑功能网络节点效率降低。这些结果为我们探索ASD 的病理生理机制以及解释ASD 的神经基础症状提供了有价值的见解。
3.1 ASD 组与TD 组全脑功能网络全局属性指标的结果分析
大脑作为一个大尺度网络,是对神经元、神经元集群或脑区之间活动交互整合的直观描述[10],具有复杂高效的脑部结构及功能。图论分析方法为大脑网络的研究提供了可视化的途径[11]。大脑被模拟为由数百个相互作用的区域组成的网络,构成几个集合和分离的系统。大脑中的功能整合是指快速结合来自不同大脑区域的特定信息的能力[12],一般是通过估计大脑各区域之间交流的容易程度来衡量的,通常是基于路径的概念。路径是由不同的节点和线组成的,它是一对对大脑区域之间信息流动的潜在路径。因此,路径的长度代表了大脑区域间功能整合的潜力,Lp是指网络中所有节点对的路径长度的平均值,一般Lp越短,意味着信息可以在短时间内迅速传递至远距离点,功能整合能力越强。大脑的功能分离是指在大脑区域内部发生特殊处理信息的能力,一般通过计算网络中三角形的数量来量化,单个节点周围三角形的比例被称为聚类系数,网络的平均聚类系数代表平均单个节点周围的聚类连接的流行程度[11],也代表了近距离传递信息的能力。当网络中显示出相对较高的Cp和较短的Lp时,意味着不仅可以支持特定的模块化信息和全局信息快速的处理,还可以最大限度地提高大脑网络的效率,大脑网络表现的这种强大的局部和全局效率水平,即小世界网络属性[13]。本研究中,ASD组和TD组都具有小世界网络属性,这与Fang 等[14]的研究一致,说明两组在功能分化和信息整合之间均保持相对平衡的状态,但是ASD组表现出的较短的Lp和Cp,说明ASD儿童的脑网络有由小世界网络向随机网络转变的趋势。本研究发现,ASD 组的Lp比TD 组低,说明与TD 组相比,ASD组功能整合能力增强,远距离传递信息的能力较强,有研究采用弥散张量成像评估ASD 患者结构网络时也得出了相似的结论,他们推测这种异常可能与ASD患者脑白质超连接有关,特别是在涉及基底神经节和旁边缘-边缘系统的网络中,与重复和刻板行为以及学习和记忆障碍相关[15]。另外,本研究结果显示,ASD 组的Cp也较TD 组的减少,与Peters 等[16]的研究结果相同,表明ASD 组脑区内部之间的连接程度降低,可能是ASD 患者交流障碍的原因。有研究发现,与正常发育的个体相比,ASD 儿童在大规模大脑网络内表现出高度连接性,并且网络间连接性降低[9],这也和我们得出的结论一致。然而Chen 等[5]的研究却发现ASD组并没有表现出强烈的网络效率变化,Lp和Cp和与TD组大致相同,这可能与样本量有关。另外,目前对S值的选择尚无参考标准。在本研究中,我们使用0.01<S<0.34,间隔为0.01,这种阈值策略创建的网络可以估计小世界具有稀疏性质和最小数目的伪边[17]。
3.2 ASD 组与TD 组全脑功能网络节点属性指标的结果分析
本研究还发现,与TD 组相比,ASD 组在双侧前扣带回、尾状核、海马及右侧顶下小叶等这些脑区全脑功能网络节点效率降低。节点效率是指网络中某一点与其他节点之间连接的可能性,用来反映节点在网络传输中的作用。前扣带回皮层是边缘系统的重要组成部分之一,涉及广泛的行为和认知过程。据报道前扣带回皮层中谷氨酸(glutamate)和谷氨酰胺(glutamine)的浓度降低,与ASD 患者更严重的交流障碍症状显著相关[18]。尾状核是纹状体的一部分,有研究认为ASD 的重复行为的严重程度与纹状体生长有关,而与体积本身无关[19]。此外有研究发现尾状核的镜像同伦连接减弱,这可能与双侧尾状核沟通不良有关[20],本研究结果中发现的ASD 儿童大脑双侧尾状核节点效率降低,可能与此相关。许多研究认为ASD 中海马结构的扩张是ASD 症状的前兆或结果[21],体积增加可能是由于病理发育增加或经验依赖功能。一些研究表明非典型的前额叶-海马体和后顶叶-海马体网络异常可能与ASD 相关的记忆缺陷有关[22]。研究发现ASD 青少年的检索收益明显低于TD同龄人,ASD 青少年左海马体与左顶下小叶之间以及左海马体与后扣带回皮质之间的连接强度与成功检索分数呈显著负相关[23],海马偏侧化的非典型发育可能与ASD个体在社交、沟通和行为不灵活方面的问题有关。顶下小叶是大脑中发育成熟最晚的脑区之一,这导致其解剖结构具有高度的易变性。顶下小叶是行动观察网络中的一个关键节点,该网络被认为支持模仿行为,当其受损时,可能导致ASD 核心社交和交际特征的损害[24]。有趣的是,研究发现右侧顶下小叶连接与实践能力相关,特别是右侧中央顶下小叶与左侧顶内沟的连接,延伸到顶上小叶和左侧楔前叶[25]。右侧中央顶下小叶-左后扣带回功能连接减少也与ASD 儿童较弱的实践和社交技能有关。后扣带回被认为是DMN中的枢纽,而默认网络同时具有小世界的特性,DMN 参与处理关于我们自己和他人的信息,其功能障碍可能表现为与其他大脑系统的交互作用。关于自己和他人的信息整合的中断可能是ASD 患者社交障碍的一个原因,因此ASD 儿童右侧中央顶下小叶-左后扣带回连接性降低可能会影响动作和身体知识的协调和映射,进一步破坏实践和社交技能的形成,未来还需要进一步的研究来得到验证。
3.3 局限性
我们的研究有一些局限性:(1)本研究选取的样本量相对较小,可能对统计分析的结果产生影响;(2)本研究中没有对ASD患者进行性别区分,还需要进一步认识性别差异在脑功能影像中的表征;(3)我们只使用AAL模板来构建脑功能网络,但使用不同的模板可能会影响我们结果的一致性,需要进一步研究确定哪种模板最适合描述ASD 儿童的网络拓扑结构;(4) ASD儿童的脑功能会随着年龄增长而变化,未来还需要继续探讨不同年龄段ASD患者大脑网络的变化。
3.4 小结
总之,本研究发现,和TD组相比,ASD组全脑功能网络虽然仍具有小世界网络属性,但Cp和Lp降低,有向随机网络转变的趋势,其功能整合能力增强,功能分化能力降低,并且在双侧前扣带回、尾状核、海马及右侧顶下小叶等脑区脑功能网络节点效率降低。这些发现揭示了ASD 儿童脑功能网络拓扑结构的异常改变,有助于我们理解ASD 的病理生理机制,为临床早期发现和治疗提供有效的神经影像学标记物。
作者利益冲突声明:全体作者均声明无利益冲突。
