磁共振弹性成像评价胰腺导管腺癌病理分级及生存期
2022-05-28宋奇科钟时玲刘媛媛杨锐石喻
宋奇科,钟时玲,刘媛媛,杨锐,石喻
作者单位:中国医科大学附属盛京医院放射科,沈阳110004
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是全球最致命的恶性肿瘤之一,患者5年生存率仅9%左右[1]。是人类最坚硬的实体肿瘤之一,其特征是伴有显著的促纤维组织增生反应[2]。研究证明,从胰腺上皮内瘤变到导管腺癌的进展过程中,病灶硬度逐渐增加,硬度还与肿瘤大小成比例增加,表明硬度的增加是PDAC 进展中的持续过程[3]。磁共振弹性成像(magnetic resonance elastography,MRE)是一项通过动态机械波定量测量组织弹性或硬度的成像方法,可无创性地获得活体的实时机械力学参数,实现影像触诊,目前已经用于评价慢性肝炎、肝纤维化及鉴别胰腺良恶性肿瘤[4-8]。与高、中分化PDAC 肿瘤相比,低分化PADC 肿瘤细胞周围的基质更致密、胶原纤维更厚,内部张力更高,预后更差[9]。既往研究表明[10],MRE 弹性值与更具侵袭性的组织学肿瘤分级及预后密切相关。然而,并没有探讨弹性值评价不同PDAC 组织病理学分级的价值。因此,本研究的目的是探讨术前MRE 所测弹性值评价PDAC 组织病理学分级及评估预后的价值。
1 资料与方法
1.1 一般资料
2014 年1 月至2016 年12 月,本研究前瞻性招募计划接受胰腺癌切除术的患者。纳入标准:(1)术前经CT/MR 检查高度怀疑或经组织病理学检查证实胰腺癌;(2)签署书面知情同意书,同意并接受进行MRE成像检查。排除标准包括:(1)患者磁共振弹性图质量不佳;(2)患者肿瘤直径小于0.5 cm;(3)有胰腺外其他恶性肿瘤病史;(4)有新辅助放疗或化疗病史,术前有胆道引流或胆道支架植入;(5)经病理证实为非PDAC 的肿瘤。根据美国癌症联合委员会(American、Joint Committee on Cancer,AJCC)第八版分期系统,从术后病理报告中提取肿瘤位置、病理大小和分级、切缘等信息[11]。本研究经我院伦理委员会批准(2014PS103K),所有受试者均签署知情同意书。
1.2 仪器与方法
本研究采用GE 3.0 T Signa Excite HD 超导型MR成像系统,8通道相控阵Torsopa体部线圈,联合阵列空间敏感编码技术(array spatial sensitivity encoding technique,ASSET),扫描MRE 序列及常规T1WI、T2WI和脂肪抑制序列。MRE扫描所用的主动及被动刺激器均由美国Resoundant 公司提供,将主动刺激器置于扫描室外部,产生40 Hz的低频声波。被动刺激器为定制的长方形木板,以腹带紧密贴合于受试者上腹部剑突下,以塑料连接管连接两端;长方形板贴于腹部一侧质软,远离腹部一侧为质硬的反衬板,可将机械波均匀反射入腹部。MRE 扫描采用自旋回波-平面回波成像(spin-echo-echo planar imaging,SE-EPI),TR 1375 ms,TE 39.4 ms,层数32 层,层厚3.5 mm,FOV 380 mm×380 mm,矩阵96×96。MRE 采用屏气扫描,共5 次屏气,前4 次屏气22 s,第五次屏气11 s。MRE 软件自动完成图像重建,若重建图像质量不佳,则重新扫描。
1.3 图像后处理及弹性值的测量
采用Mayo Clinic 研发的专用弹性处理软件AW 4.4 工作站对图像进行后处理,由获得的波形图通过直接反演拟合算法生成胰腺弹性图。由两名经过培训、分别有6 年及8 年腹部影像诊断经验的放射科医师综合术前T1WI、T2WI 图像,在MRE 幅度图上绘制感兴趣区(region of interest,ROI),在逐层幅度图上绘制单个ROI,以包括尽可能大的肿瘤体积,同时尽量避开胰管、大血管及肿瘤边界,ROI 自动复制至弹性图及波形图上,记录其弹性值,最终弹性值为每名患者所有ROI层面的弹性平均值,单位为kPa。
1.4 临床及病理学评估
术后肿瘤切片用苏木精-伊红(hematoxylin-eosin staining,HE)染色。组织学评估由两名具有10 年诊断经验的病理科医师共同进行,采用双盲法评估肿瘤组织学分级。结果不一致者经讨论协商,重复评价后统一。记录患者的基本资料(年龄、性别)及实验室生化检查结果(CA19-9)。
1.5 随访
以手术结束为随访起始时间,术后每3~6 个月复查胰腺增强CT 或胰腺MRI 和血清生化检查,计录总生存时间(overall survival,OS)。OS定义为从手术日期至死亡或最后一次随访的时间间隔,最终随访至2021年11月。
1.6 统计学分析
采用IBM SPSS Statistics 26.0 统计分析软件。以xˉ±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示非正态分布的计量资料,分类变量表示为计数。以Spearman 秩相关分析PDAC 病理分级与弹性值间的相关性。对于不同病理分级间弹性值比较采用单因素方差分析,两两比较采用LSD检验。绘制ROC曲线,评价弹性值对于高、中-低分化与高-中分化、低分化PDAC 的诊断效能,计算曲线下面积(area under curve,AUC)、敏感度、特异度及诊断阈值。两组AUC 比较采用DeLong 检验,P<0.05 为差异有统计学意义。采用Kaplan-Meier法分析PDAC患者总生存率,以Cox比例风险模型行单因素及多因素分析其影响因素,P<0.05为差异有统计学意义。
2 结果
本研究共招募73 名患者,排除11 名患者,其中5 名患者磁共振弹性图质量不佳(3 名患者无有效的波形数据,1 名患者疼痛难忍,1 名患者有心脏支架);3 名患者肿瘤直径小于0.5 cm;2 名患者为胰腺实性假乳头状瘤,1 名患者为胰腺导管内乳头状黏液肿瘤。最终62 名患者纳入研究队列,年龄(61.76±11.14)岁,男34名,女28名。
随着胰腺硬度的增加,弹性图上肿瘤的颜色为黄色或红色。62 例PDAC 患者的临床及病理资料见表1。所有PDAC 的弹性值为(3.06±0.82) kPa。病理分级为高分化、中分化及低分化PDAC 患者的弹性值 分 别 为(2.31±0.62) kPa、(2.98±0.78) kPa 及(3.83±1.08) kPa,不同分级之间弹性值差异有统计学意义(P<0.001)。两两比较发现,低分化PDAC患者弹性值大于中分化及高分化PDAC 患者(P均<0.001),中分化PDAC 患者弹性值大于高分化PDAC 患者(P<0.001) (图1、2)。病理分级为高分化、中分化及低分化PDAC 患者的血清CA19-9 水平分别为病理分级为(267.41±51.96) U/mL,(223.97±65.25) U/mL及(162.37±53.02) U/mL,不同分级之间血清CA19-9 水平差异有统计学意义(P=0.003)。两两比较发现,高分化与中分化PDAC 患者血清CA19-9 水平差异无统计学意义(P=0.056)。高分化PDAC 患者血清CA19-9 水平高于低分化PDAC 患者(P<0.001);中分化PDAC 患者血清CA19-9 水平高于低分化PDAC 患者(P=0.017)。
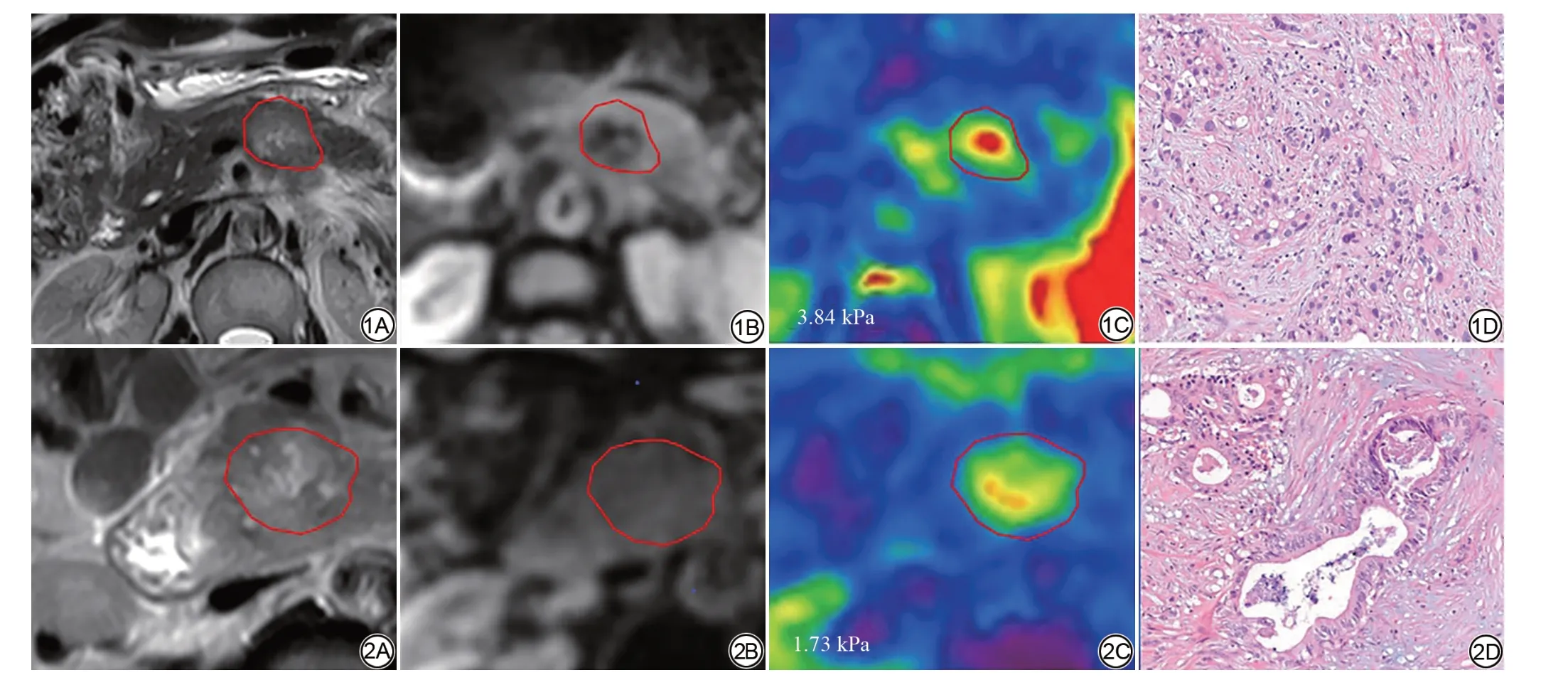
图1 男,53 岁,低分化胰腺导管腺癌。1A:T2WI图,病灶表现为T2 稍高信号影;1B:幅度图,病灶表现为低信号;1C:弹性图,肿瘤区域呈黄色及红色,弹性值为3.84 kPa;1D:病理诊断为低分化胰腺导管腺癌,肿瘤细胞核异型性明显,排列成无规则状或条索状癌巢(HE×200)。 图2 男,67岁,高分化胰腺导管腺癌。2A:T2WI图,病灶表现为T2稍高信号影;2B:幅度图,胰头部肿胀,呈等信号;2C:弹性图,肿瘤硬度为1.73 kPa;2D:病理诊断为高分化胰腺导管腺癌,肿瘤细胞核失去极性,形成较好的腺体结构,与正常胰腺导管有不同程度的相似(HE×200)。Fig. 1 A 53-year-old male patient with poorly differentiated pancreatic ductal adenocarcinoma (PDAC). 1A: T2WI, the lesion showed slightly higher signal;1B: Amplitude, the lesion showed low signal; 1C: Elastogram, the PDAC shown yellow and red, with the stiffness measured using MRE was 3.84 kPa; 1D:Pathological diagnosis was poorly differentiated PDAC,tumor cells with obvious nuclear atypia,arranged in irregular or cord-like nests (HE ×200).Fig.2 A 67-year-old male patient with well-moderate differentiated pancreatic ductal adenocarcinoma (PDAC). 2A: T2WI, the lesion showed slightly higher signal; 2B: Amplitude graph,swelling of head of pancreas,showed normal signal as well as the surrounding tissue signal;2C:Elastogram graph,the stiffness measured using MRE was 1.73 kPa;2D: Pathological diagnosis was well-moderate differentiated PDAC, tumor cell nuclei lose polarity and form better glandular structures, which were similar to normal pancreatic ducts to varying degrees(HE×200).
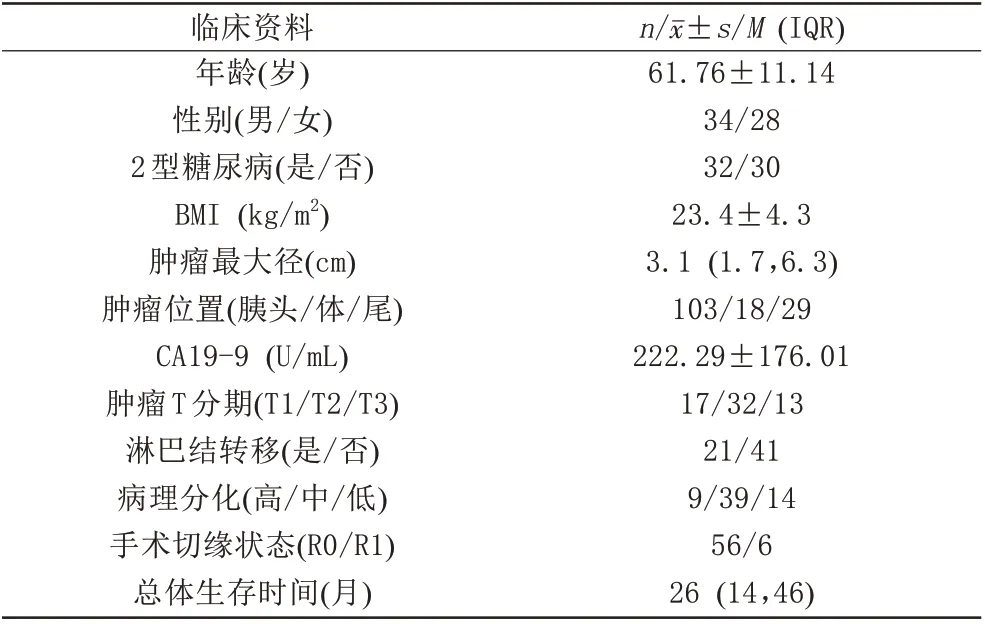
表1 患者的基本资料特征Tab.1 Baseline characteristics of patients
PDAC 患者弹性值与PDAC 病理分级呈正相关(rs=0.831,P<0.001)。MRE 弹性值诊断高、中-低分化与高-中、低分化PDAC 的阈值分别为2.51 kPa 和3.50 kPa。MRE弹性值诊断高、中-低分化与高-中、低分化PDAC的AUC分别为0.826 (95%CI:0.822~0.973)及0.884 (95%CI:0.853~0.982)。CA19-9诊断高、中-低分化与高-中、低分化PDAC 的阈值分别为221.50 U/mL和200.00 U/mL。CA19-9诊断高、中-低分化与高-中、低 分 化PDAC 的AUC 分 别 为0.713 (95%CI:0.628~0.854)及0.678 (95%CI:0.590~0.756),见图3。弹性值的AUC 高于CA19-9,两两比较显示弹性值与CA19-9的AUC差异有统计学意义(P=0.002)。
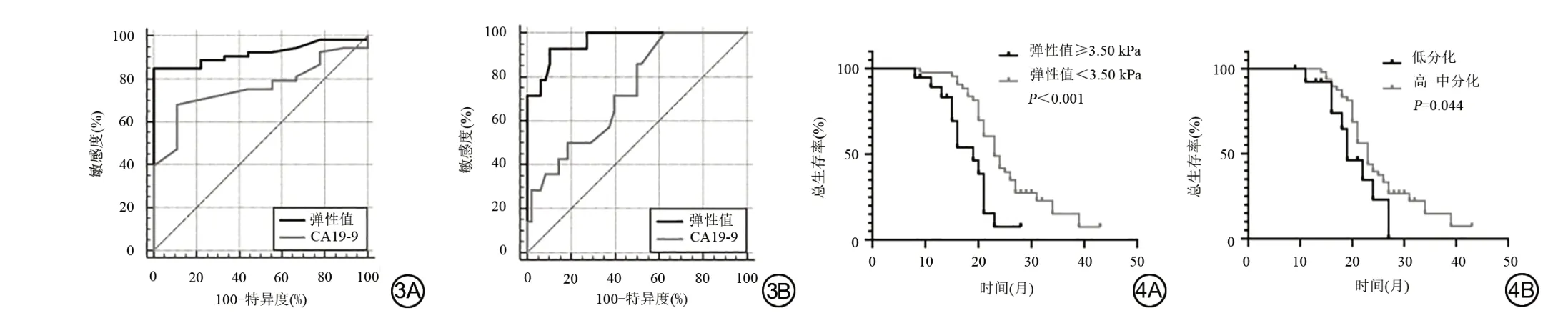
图3 弹性值诊断胰腺导管腺癌病理分级的ROC 曲线。3A:高分化与中-低分化;3B:高-中分化与低分化。 图4 胰腺导管腺癌患者生存曲线。4A:以弹性值进行分组,弹性值≥3.50 kPa 组预后较差,风险比为2.547(95%CI:1.809~5.950);4B:以病理分级进行分组,低分化组比高-中分化组预后差,风险比为1.863(95%CI:1.068~3.139)。Fig. 3 ROC curve for the diagnosis of pancreatic ductal adenocarcinoma pathological grading by elasticity value. 3A is well differentiated and moderate-poorly differentiated; 3B is well-moderate differentiated and poorly differentiated. Fig. 4 Survival curve of patients with pancreatic ductal adenocarcinoma. 4A is grouped by elasticity value,the group with stiffness ≥3.50 kPa had poor prognosis with a hazard ratio of 2.547(95%CI:1.809-5.950);4B is grouped by pathological grade,the poorly differentiated group had a worse prognosis than the well-moderate differentiated group,with a hazard ratio of 1.863(95%CI:1.068-3.139).
随访结束时,62例患者中56例死亡,分别以病理分级(高-中、低分化)及弹性值诊断高-中、低分化的阈值(3.50 kPa)为分割点进行分组,分析组间生存率,高-中分化患者的中位生存期为26 个月,低分化患者的中位生存期为22 个月;高硬度(弹性值≥3.50 kPa)组患者的中位生存期为18 个月,低硬度患者的中位生存期为25 个月,见图4。影响PDAC 患者生存时间的单因素及多因素分析结果见表2。
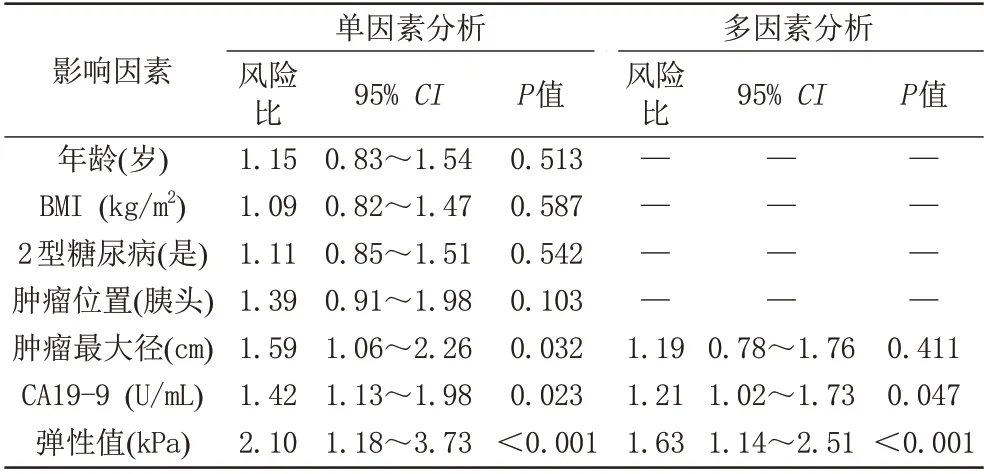
表2 术前胰腺导管腺癌患者生存时间的单因素及多因素分析结果Tab.2 Univariate and multivariate analysis of overall survival of patients with pancreatic ductal adenocarcinoma in preoperative
3 讨论
本研究通过对PDAC患者行术前MRE成像,发现通过MRE测量的弹性值与肿瘤组织学分级呈正相关,组织学分级越高的患者弹性值越高。MRE 弹性值诊断高、中-低分化与高-中、低分化PDAC的AUC值均>0.8,有较好的诊断价值。术前MRE的弹性值是影响术后预后的独立因素,较硬的PDAC与较低的OS相关。
3.1 体素内不相干运动扩散加权成像评价PDAC组织学分级
体素内不相干运动扩散加权成像(intravoxel incoherent motion-diffusion weighted imaging,IVIM-DWI)成像使用多个b 值将信号衰减拟合为双指数函数,然后区分无灌注扩散和毛细血管灌注,从而可以同时评估扩散和灌注参数[10]。Ma等[12]研究表明,IVIM-DWI 的慢表观扩散系数(ADCslow)和灌注分数(perfusion fraction,f)对评估PDAC 分化程度有重要价值,f 值与PDAC 分化程度呈正相关,而D 值与分化程度呈负相关。然而Ma 等的研究只评估了ADCslow值和f 值对高-中分化和低分化PDAC 的诊断效能。ADCslow值和f 值分别是基于PDAC 组织水分子真实扩散情况和微循环血流灌注评估分化程度。高-中分化PDAC 丰富的大导管样结构内含大量黏液,黏液中含有大分子蛋白限制水分子的扩散,导致ADCslow值减低。MRE则是基于弹性值来评估PDAC分化程度,我们的研究显示,分化程度越高,肿瘤的弹性值越低,究其原因可能是由于PDAC 病理级别不同,其组织学特征及生物力学特征也不相同。研究表明,与高、中分化PDAC 相比,低分化PDAC 导管周围基质张力更高,纤维直径更厚,更致密,肿瘤细胞比例更大[9],我们的研究结果与之相符。
3.2 影像学评估PDAC生存期
既往研究报道术前动态增强影像特征可预测PDAC 的预后。在Fukukura 等[13]的研究中,测量肿瘤在不同时期的CT 值,得到实质期肿瘤强化程度高的患者比强化程度低的总体生存时间更长,中位生存时间分别是60.8 个月和18.3 个月,并将实质期测得的肿瘤CT 值的中位值48 HU 作为分界点纳入多因素生存分析中,得到实质期肿瘤强化是影响预后的独立因素。Lee 等[14]研究发现,增强MRI 及增强CT 中PDAC 的强化方式(环状强化)与其细胞间质比例及预后密切相关。蔡小丽等[15]研究发现,胰腺实质期肿瘤与周围胰腺实质的CT值差可评估预后,CT值差越大,患者存活的时间越短,预后越差。除此之外,研究表明[16],DWI 的ADC 值与胰腺导管腺癌的OS 存在显著相关性,ADC值越低,预后越差。
3.3 弹性值对PDAC预后的影响
既往研究多是基于原子力显微镜或超声弹性成像所测弹性值预测PDAC预后。Nguyen等[17]用原子力显微镜测量PDAC 细胞的杨氏模量,发现PDAC 中的细胞刚度和侵袭潜力之间存在很强的关联,原子力显微镜对PDAC 组织生物力学的测试显示,较硬的PDAC可诱导邻近胶原纤维的结构更加致密。更重要的是,纤维化不是机体对肿瘤被动的反应,相反,纤维化可以通过提高PDAC组织间硬度来直接激活关键信号通路[如Yes 相关蛋白(Yes-associated protein,YAP)],以促进肿瘤的进展、侵袭和转移[18]。纤维化及组织液压的增高同时影响化疗药物的输送,导致PDAC 的化疗耐药性,同时,较硬的细胞外基质可以诱导PDAC 细胞代谢发生变化,通过肌酸磷酸化途径增强肿瘤的侵袭性及转移[19-20]。在Shi 等[21]的临床研究中,侵袭性内镜超声弹性成像获得的应变比(strain ratio,SR)与胰腺癌的不良预后相关,SR 与肿瘤间质比例正相关。Vincent 等[22]在动物中发现,PDAC 肿瘤系中局部弹性值与局部药物分布及血管通畅性呈反比关系。然而上述对于PDAC弹性值的测量多是在术后或有侵袭性的。目前用MRE 弹性值预测PDAC 预后的研究较少,张显怡等[10]对231 例PDAC 患者行术前MRE 检查,并将所有PDAC 弹性值的中位值3.0 kPa 设为阈值,分成高弹性值组和低弹性值组,发现较硬的PDAC 与较低的无病生存率(disease free survival,DFS)和OS 相关[危险比分别为1.922 (P<0.001)和1.532 (P<0.001)]。本试验研究结果与之相似,采用无创性方法,通过术前MRE成像,测量胰腺癌硬度,将弹性值诊断高-中、低分化的阈值(3.50 kPa)为界值点,得到弹性值高于阈值的患者总体生存时间短于弹性值低于阈值的患者,在多因素分析中,得到弹性值是影响患者预后的独立影响因素。
局限性:(1)本研究为单中心研究,缺乏多中心验证;(2)本研究样本量较小;(3) MRE 分辨率不及传统MRI,尚不适用于小病灶(直径小于0.5 cm);(4)受试者性别、被动刺激器位置等因素对弹性值测量结果的影响尚需进一步观察。
总之,本研究运用术前无创性MRE评估胰腺癌病理学分级及预后与弹性值的关系,将MRE弹性值纳入术前PDAC临床特征分析中发现,MRE测量的弹性值是OS的独立影响因素,并与PDAC组织学分级呈负相关。PDAC术前行无创MRE检查,有助于评价其组织学分级及预后。
作者利益冲突声明:全体作者均声明无利益冲突。
