腹膜后神经鞘瘤1例报道
2022-05-28邹莹莹张晓梅
神经鞘瘤又称雪旺细胞瘤,是由于产生神经鞘Schwann细胞异常引起的,腹膜后神经鞘瘤是一种少见的起源于周围神经鞘雪旺细胞的肿瘤,占所有神经鞘瘤的0.5%~5%
,该病的临床症状和影像学特征不具特异性,术前诊断困难。现将我院发现的1例腹膜后神经鞘瘤报道如下。
患者,女,35岁,外院体检行超声检查提示:“腹腔内占位,考虑来源于后腹膜”,为进一步治疗来我院就诊,门诊拟“腹膜后肿瘤”收入住院。查体:腹部平坦,无腹壁静脉曲张,腹部柔软,无压痛、反跳痛,中上腹可触及一质韧肿瘤,活动度差,边界约8 cm×6 cm,无压痛。实验室检查:肿瘤标志物(AFP、CA724、CA199和CEA)在正常范围内。腹部超声:腹膜后可见一个大小约12.5 cm×8.3 cm×11.0 cm的以实性为主的混合性回声团,位于腹主动脉前方,似由多个团块相互融合而成,边界欠清,形态不规则,团块周边及内部可见少许点、条状彩色血流信号(见图1)。上腹增强CT:腹膜后靠中轴线可见一分叶状肿块,大小约11.6 cm×8.0 cm×8.5 cm,考虑间叶源性肿瘤可能,与胰腺来源的实性假乳头状瘤鉴别(见图2)。胃镜下见:胃黏膜光滑,十二指肠球部黏膜充血,前壁可见压迫征象。超声胃镜下见:胰腺头颈旁、腹主动脉前方可见一巨大不均质混合回声占位性病变,内可见实性区及大小不等的蜂窝状无回声区,有包膜,所及切面大小约12.0 cm×9.6 cm(见图3),病变压迫脾动静脉,向腹腔生长,与胰腺关系密切(见图4),部分切面界限欠清晰,病变肝脏相邻,但界限清晰(见图5)。弹性成像示:肿物绿蓝色混杂回声,质地中等,胰腺受压、变形,主胰管未见明显增宽。超声内镜检查结束后以Boston 22 G穿刺针穿刺肿物4针,5 ml负压,可见大量组织条,无回声区见淡红色血性液体吸出,有絮状物漂浮,留取囊液约10 ml送检常规、生化、淀粉酶脂肪酶及肿瘤标志物,组织标本回收送病理及液基细胞学检查。液基细胞学示:见少量腺上皮细胞及较多中性粒细胞,未见异型细胞,未见恶性肿瘤细胞(见图6)。超声内镜引导下细针穿刺术(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)病理结果示:镜下形态结合免疫组化考虑神经鞘瘤,免疫组化(1#):CK(-)、CD10(个别+)、β-catenin(-)、Vim(+)、CK7(-)、CK19(-)、αAT(+)、GFAP(-)、Neu-N(-)、CgA(-)、Syn(-)、S-100(+)、CD34(-)、Dog-1(-)、CD117(-)、Ki-67(+,3%),因穿刺标本肿瘤组织较少,待肿瘤完整切除后进一步明确诊断(见图7)。术后,患者未观察到不良并发症,拟完善相关术前准备后手术治疗。
1)受沉积环境影响,二2煤层顶底板岩性存在较大差异。岩石在单轴压缩过程中具有压密、弹性、屈服和破坏4个阶段。
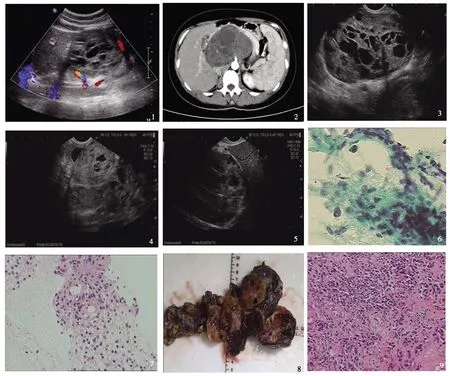
手术情况:患者全麻下行腹膜后肿瘤切除、胆囊切除、胰体尾切除、脾切除术。术中探查见,肝脏与周围组织无粘连,胰腺后方存在一巨大囊实性占位,将胰腺向前推挤,肿瘤直径约10 cm,存在包膜,与周围炎性粘连,肿瘤包裹腹腔干,毗邻肠系膜上动脉(见图8),术中出血量800 ml,尿量1 300 ml,输液4 100 ml。
含电动汽车和电转气的园区能源互联网能源定价与管理//李媛,冯昌森,文福拴,王珂,黄裕春//(16):1
本例腹膜后良性神经鞘瘤,术前EUS-FNA有助于准确诊断,最后的诊断是基于术后的组织学和免疫组织化学结果,主要的治疗方案是手术切除。
术后资料:术后病理检查示(见图9):(1)(腹膜后肿物)神经鞘瘤伴部分组织囊性变;(2)(胰腺)局部胰腺被膜与瘤组织粘连,胰腺实质未见肿瘤浸润;(3)(脾脏)见脾组织轻度充血,未见肿瘤组织累及;(4)慢性胆囊炎,未见病变累及;另见(胆囊颈)淋巴结1枚,呈反应性增生改变。免疫组化(6#):CD10(-)、CD38(+)、CD31(+)、CD34(血管+)、Ki-67(+,约2%);(10#):S-100(+)、GFAP(-)。术后第9天复查上腹增强CT,出院后第2、4、5、7、9个月随访复查腹部超声均未见明显异常,患者情况良好,无复发疾病。
表5列出来从测试集中抽样处理的示例,通过比较本文系统生成的自然答案和标准回复。可以看出:系统生成的答案比单独的答案实体更加自然友好,甚至比原始的标准回复更加自然。本文提出的自然答案生成系统能够:(1)生成自成一体的答案形式,这样的回复更容易被人理解和接受;(2)提供与问题更一致的答案(如ID 4);(3)覆盖问题和答案中相关实体的更多信息(如ID 1,2,3)。
由于腹膜后肿瘤位置较深,腹膜后神经鞘瘤可生长至较大的体积,生长速度各不相同,临床症状和体征与肿瘤的位置和大小有关,由于腹膜后间隙大而灵活,患者通常是无症状的。超声、CT、MRI等影像学检查有助于术前诊断,B超是最常用的影像学检查手段,常提示为低回声团块,回声均匀,边界清,可呈囊性或实性,无明显血流
。CT可以根据肿瘤的生长情况显示退行性病变,如出血、囊肿形成、坏死和钙化。MRI可帮助评估血管受累程度,进一步表征肿瘤的生物学行为,并有助于确定手术方式的选择。PET/CT在消化器官的良性肿瘤中偶尔表现出肿瘤吸收高氟脱氧葡萄糖
。由于腹膜后神经鞘瘤非常罕见,且缺乏典型的影像学特征,术前正确的诊断常常被遗漏
。
EUS-FNA是一种安全有效的胰腺肿瘤、胃肠道上皮下病变和淋巴结病变的组织取样技术。EUS-FNA的总体敏感性为91.7%,特异性为97.1%,PPV为98.1%,NPV为87.7%,准确性为93.8%
,文献报道
,EUS-FNA对神经鞘瘤的诊断准确性为66.7%,组织学上,神经鞘瘤由排列在高细胞栅栏区域的梭形细胞(Antoni A型)和低细胞组织区的黏液瘤细胞(Antoni B型)组成
,由于神经鞘瘤的组织学特征,通过EUS-FNA将针插入低细胞组织区并采集标本是困难的,影响EUS-FNA诊断准确性的因素有很多,包括穿刺针通过的次数、穿刺针的大小、组织学-细胞学联合分析
、现场细胞学评估
、重复穿刺、负压抽吸技术等。本例患者我们使用了22 G穿刺针,进行了4次重复穿刺,结合负压抽吸技术抽吸组织条,通过穿刺物镜下形态结合免疫组化,最终在术前成功诊断腹膜后神经鞘瘤。由于腹膜后神经鞘瘤诊断困难,尽管术前穿刺活检的价值存在较大争议
,但EUS-FNA仍然是诊断神经鞘瘤的一个重要程序,其具有明显的优势,是一种安全的检查方法,并发症发生率低、侵入性小、成本低、需要的时间和人力更少
。
手术是神经鞘瘤的首选治疗方法
,腹膜后肿瘤缺乏特异性的血清学指标,临床上未见有肿瘤指标与腹膜后神经鞘瘤相关性的研究,值得进一步探究,本例患者肿瘤标志物(AFP、CA724、CA199和CEA)同样在正常范围内。神经鞘瘤的明确诊断和性质的确定最终取决于组织学检查。S-100蛋白的阳性表达是神经鞘瘤的一个独特的免疫组织化学特征,证实肿瘤细胞来源于神经外胚层
。本例患者肿瘤组织EUS-FNA病理学及术后病理学均提示S-100蛋白为阳性,可确诊为神经鞘瘤。
综上所述,腹膜后神经鞘瘤较罕见,多为良性,术前诊断困难,EUS-FNA是诊断神经鞘瘤的一个重要程序,最终确诊需要根据病理及免疫组织化学染色。
[1] Petrucciani N, Sirimarco D, Magistri P, et al.Retroperitoneal schwannomas: advantages of laparoscopic resection.Review of the literature and case presentation of a large paracaval benign schwannoma(with video)[J].Asian J Endosc Surg, 2015, 8(1): 78-82.DOI: 10.1111/ases.12150.
[2] 张璐芳, 李华.腹腔镜手术切除盆腔腹膜后神经鞘瘤2例报告及文献复习[J].中国微创外科杂志, 2017, 17(6): 571-574.DOI: 10.3969/i.issn.1009-6604.2017.06.027.
Zhang LF, Li H.Laparoscopic resection of pelvic retroperitoneal schwannoma: two cases report and review of literature[J].Chin J Min Inv Surg, 2017, 17(6): 571-574.DOI: 10.3969/i.issn.1009-6604.2017.06.027.
[3] Benz MR, Czernin J, Dry SM, et al.Quantitative F18-fluorodeoxyglucose positron emission tomography accurately characterizes peripheral nerve sheath tumors as malignant or benign[J].Cancer, 2010, 116(2): 451-458.DOI: 10.1002/cncr.24755.
[4] Li Q, Gao C, Juzi JT, et al.Analysis of 82 cases of retroperitoneal schwannoma[J].ANZ J Surg, 2007, 77(4): 237-240.DOI: 10.1111/j.1445-2197.2007.04025.x.
[5] Eloubeidi MA, Tamhane A.Prospective assessment of diagnostic utility and complications of endoscopic ultrasound-guided fine needle aspiration.Results from a newly developed academic endoscopic ultrasound program[J].Dig Dis, 2008, 26(4): 356-363.DOI: 10.1159/000177022.
[6] Takasumi M, Hikichi T, Takagi T, et al.Efficacy of endoscopic ultrasound-guided fine-needle aspiration for schwannoma: six cases of a retrospective study[J].Fukushima J Med Sci, 2017, 63(3): 75-80.DOI: 10.5387/fms.2015-21.
[7] Kudo T, Kawakami H, Kuwatani M, et al.Three cases of retroperito-neal schwannoma diagnosed by EUS-FNA[J].World J Gastroenterol, 2011, 17(29): 3459-3464.DOI: 10.3748/wjg.v17.i29.3459.
[8] Moller K, Papanikolaou IS, Toermer T, et al.EUS-guided FNA of solid pancreatic masses: high yield of 2 passes with combined histologic-cytologic analysis[J].Gastrointest Endosc, 2009, 70(1): 60-69.DOI: 10.1016/j.gie.2008.10.008.
[9] Alsohaibani F, Girgis S, Sandha GS.Does onsite cytotechnology evaluation improve the accuracy of endoscopic ultrasound-guided fine-needle aspiration biopsy?[J].Can J Gastroenterol, 2009, 23(1): 26-30.DOI: 10.1155/2009/194351.
[10] 战勇, 于晓玲, 梁萍, 等.超声引导下穿刺活检在腹膜后病变中的应用价值[J].解放军医学院学报, 2014, 35(3): 204-207.DOI: 10.3969/j.issn.2095-5227.2014.03.002.
Zhan Y, Yu XL, Liang P, et al.Application of ultrasound-guided biopsy in diagnosis of retroperitoneal diseases[J].Acad J Chin PLA Med Sch, 2014, 35(3): 204-207.DOI: 10.3969/j.issn.2095-5227.2014.03.002.
[11] Strauss DC, Qureshi YA, Hayes AJ, et al.Management of benign retroperitoneal schwannomas: a single-center experience[J].Am J Surg, 2011, 202(2): 194-198.DOI: 10.1016/j.amjsurg.2010.06.036.
[12] Iwashita T, Yasuda I, Doi S, et al.Endoscopic ultrasound-guided fine-needle aspiration in patients with lymphadenopathy suspected of recurrent malignancy after curative treatment[J].J Gastroenterol, 2009, 44(3): 190-196.DOI: 10.1007/s00535-008-2302-6.
[13] Mastoraki A, Toska F, Tsiverdis I, et al.Retroperitoneal schwannomas: dilemmas in diagnostic approach and therapeutic management[J].J Gastrointest Cancer, 2013, 44(4): 371-374.DOI: 10.1007/s12029-013-9510-x.
[14] Tortorelli AP, Rosa F, Papa V, et al.Retroperitoneal schwannomas: diagnostic and therapeutic implications[J].Tumori, 2007, 93(3): 312-315.PMID: 17679473.
