视网膜类器官衍生物的研究应用
2022-05-27陈浩浩综述金子兵审校
陈浩浩 综述 金子兵 审校
(北京市眼科研究所,首都医科大学附属北京同仁医院,北京同仁眼科中心,北京市眼科学与视觉科学重点实验室,北京 100005)
目前针对视网膜相关疾病的治疗方法仍仅限于解剖学复位和并发症处理,如湿性AMD、糖尿病视网膜病变患者可接受定期玻璃体腔注射抗血管内皮生长因子(anti-VEGF)药物或激光光凝治疗,治疗费用高,且效果仅限于延缓视网膜退行性变的进展,不能彻底阻遏疾病进程或逆转疾病结局[3]。随着CRISPR/Cas9等基因编辑技术发展,以腺病毒(adeno-associated virus,AAV)或慢病毒作为载体,对先天性黑蒙症患者采用RPE65基因补充治疗,视力改善效果明显,尽管理论上可治愈,但出现术后1~3年视力减退、疾病继续进展等问题,潜在原因包括外源基因未能整合至宿主细胞染色体内、治疗基因的持续性丢失导致蛋白表达量不足以维持生理需要[6-8]。基因治疗对致病明确的单基因突变型视网膜病变饶有成效,但难以应用于基因和环境复杂作用下产生的AMD、青光眼等疾病,因此退行性视网膜病变治疗方法需要继续创新。细胞替代治疗可以直接补充因病凋亡的视网膜各类型细胞,达到视力改善效果,自从体细胞成功重编程为多能干细胞后,类器官也随之产生,增加了供体来源的渠道,细胞替代治疗研究也迎来新高度。类器官指由干细胞或相关祖细胞发育而来,类似体内器官形成过程,按照细胞分拣并遵循空间上的种系承诺,自发重聚形成包含多种体内器官细胞类型的人工诱导型器官[9]。RO的产生为研究眼球生物发育机制、眼部疾病建模、药物筛选提供了更好的平台,眼球作为人体免疫豁免器官,移植治疗拥有良好前景,RO衍生的细胞替代治疗也可打破当前移植供体紧缺的僵局,因此本文主要围绕RO应用于在体移植的研究进行综述。
1 视网膜类器官及其衍生物的来源
类器官(organoid)这一学术名词在早期并非指代体外培养出的生物有机体,而是指畸胎瘤类似体内器官的生长模式或胎儿发育早期未成熟的器官,即形态学上的一种描述[10-11]。与类器官相似的体外培养可追溯至120年前,Wilson等在当时将分散的海绵细胞在体外培养形成类似海绵的完整重聚有机体,后续有研究[12-13]也通过细胞悬液体外培养出简单动物——水蛭。随着体外细胞组织培养技术的成熟,类器官也被赋予了新的含义,这种通过体外培养模拟体内组织器官形成过程的创新方式促进了发育生物学的发展,对体外培养的类器官进行动态观察可揭示潜在的发育过程中细胞定向迁移分化的机制,也为体外研究肿瘤及其靶向药提供了新方法。
RO体外模型由Sasai等首先建立,研究人员对鼠胚胎干细胞(mouse embryonic stem cell,mESC)使用3D胚胎干细胞培养方法,得到自发形成的眼球前体结构——视杯,且培养过程中细胞迁移及分化与体内基本一致:ESC来源的神经上皮细胞层自发地沿近端-远端轴线形成半球形的囊泡结构,近端部严格分化为RPE,远端部内陷形成胚胎早期的视杯结构[14],Nakano等[15]使用人胚胎干细胞(human embryonic stem cells,hESC)体外培养出典型的视杯结构,由于物种差异,hESC来源视杯结构更大,后期视网膜发育成熟后也有更多视锥细胞。Meyer等[16]首次通过hESC体外培养得到类似于胚胎发育早期视区的细胞(共表达Pax6和Rx),进而获得视杯样结构,并后续验证了感光细胞、RPE和视网膜神经节细胞(retinal ganglion cell,RGC)的存在,但是缺乏发育早期双侧对称的视泡和分化后期完整的视网膜分层结构,推测与其视泡初步形成后被分离移至平面培养基有关,导致正常视网膜的空间立体结构未能形成。在前期研究基础上,脉络膜脑回样萎缩患者的成纤维细胞体外再分化过程中观察到很少的正常RPE细胞,该患者有影响RPE功能的鸟氨酸转氨酶(OAT)A226V型突变,OAT酶活性依赖于维生素B6,反应比色法可以观察到其较正常人RPE的低OAT酶活性,通过添加适量维生素B6和基因修复突变可恢复酶活性[17],该研究首次通过药物和基因编辑手段对体外单基因突变的视网膜疾病模型进行干预,并取得较好的效果。
Sasai等[14,18]早期在体外使用快速重聚无血清胚状体培养基(quickly aggregated serum free embryonic body,SFEBq)诱导分化出视网膜样结构,但无视网膜分层现象,后续添加Matrigel(由Engelbreth Holm-Swarm肿瘤细胞系分泌富含层粘连蛋白的细胞外基质)的培养基成功诱导出经典的分层视网膜,使用添加laminin、entactin和activin的培养基也有相似效果。Sasai等认为视杯可以在无晶状体或表面外胚层组织的外部条件下自发形成,这种自发的内源性驱动力也被广泛关注,更多结论指向ESC发育为视网膜过程中时间及空间特异性的分子表达及通路调节,如添加nicotinamide、activin A,或使用化学小分子CKI-7和SB431542(或Dkk1、LeftyA)抑制Wnt和Nodal信号通路,均可使hESC成功向视网膜分化[19-20]。早期胚胎的视区细胞均表达转录因子Mitf,Mitf阳性的细胞在转录因子Chx10(又名Vsx2)表达后下调Mitf表达水平,从而产生神经视网膜(Pax6和Rx双阳性)[18,21]。视网膜各亚型细胞的形成同样由多种因子调控,Notch信号通路的抑制可能是影响视网膜分化最早的分子机制,促进视网膜祖细胞(retinal progenitor cell,RPC)有丝分裂阶段后期分化为不同亚型视网膜细胞[22-23]。增殖期RPC中Vsx2的抑制效应随视网膜发育逐渐减退,原本受Vsx2抑制的转录因子Atoh7/Math5、Mash1/3、NeuroD/Math3、和FoxN4/Ptf1a表达上调,分别促进RGC、双极细胞、无长突细胞和水平细胞的分化[24-25],随后六种主要上调的转录因子(Crx、Otx2、Nrl、Nr2e3、Rorβ、Thrβ2)相互协调诱导分化出最终的视锥、视杆细胞,成熟的视锥、视杆细胞表达标记蛋白Rhodopsin、Recoverin和S-Opsin[26-27]。Müller细胞是最后分化的视网膜细胞,延续表达RPC时期的Hes1和Hes5,协同表达Hesr2,终末形态上极其类似RPC,并拥有潜在的神经元再生能力[23];RPE细胞则是视网膜首先分化的细胞,源于早期视杯外层在Chx10下调后Mitf和Pax双阳性的细胞群,由hESC体外培养可在第30天发现拥有显著六边形和色素沉积的RPE,并且表达紧密连接蛋白ZO-1[16](图1)。
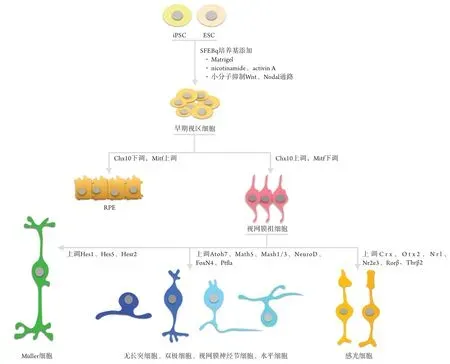
图1 影响视网膜各类型细胞分化过程的潜在分子Figure 1 Potential molecules affecting the differentiation of multiple retinal cells
在体移植的视网膜细胞目前多为感光细胞、RPE,主要由于这两种细胞凋亡是大部分视网膜退行性疾病终末期的共同表现。移植感光细胞早期由ESC体外培养获得,Lamba等[28-29]采用Noggin和DKK1分别抑制影响前脑形成的BMP、Wnt信号通路,添加胰岛素样因子(IGF-1),得到hESC来源的感光前体细胞及其它亚型的视网膜细胞,分化第3周可检测到82%的细胞表达RPC相关的Pax6和Chx10,免疫染色发现12%的细胞表达RGC和无长突细胞的标记蛋白HuC/D、Neurofilament-M、Tuj1突触相关蛋白,但表达成熟感光细胞标记蛋白S-opsin、rhodopsin的细胞总数不足0.01%,尽管感光前体细胞的标记蛋白Crx和Nrl表达量很高,具有神经元形态的细胞也可有明显的钙电流呈像,但是大部分诱导出的感光细胞不具备内外节,光传导通路的恢复也难以实现,可能由于传统2D培养mESC和hESC获取感光细胞难以提供细胞替代治疗所需的足量、成熟的感光细胞。为了更好地体外复现视网膜体内发育模式,获取更多、更成熟的感光细胞以备移植,自Sasai等体外3D培养建立RO以来,由RO获取感光细胞的研究逐渐增多,Gonzalez-Cordero等[30-31]采用hESC体外3D培养RO,第3~4周出现RPE岛样分布现象,第15周可发现63%的细胞表达视杆细胞相关转录因子Nrl和蛋白rhodopsin(Nrl与Crx早期协同调节rhodopsin蛋白的表达),第20周同时检测到S型和L/M型视锥细胞,成熟感光细胞分化数目较之前的2D培养结果明显增多;随后不仅在外核层和外丛状层检测到hESC来源感光细胞相应突触蛋白RIBEYE、Syntaxin3,而且在免疫染色和电镜下均观察到:1)形态良好的内外节,内节胞质处富含线粒体,外节拥有膜盘结构但不够成熟;2)内外节之间进行蛋白运输的连接纤毛,拥有9+0型微管结构;3)边界明显的外界膜。Zhong等[32]也通过3D途径诱导分化出感光细胞,并首次利用膜片钳验证RO来源感光细胞的电生理活性。早期多项RO来源细胞移植研究均检测到各亚型视网膜细胞及突触形成的特异性蛋白,但仅少部分研究通过钙离子呈像及膜片钳记录的方式检测到RO来源感光细胞的电信号,且结果差异大[30-32]。体外诱导分化形态结构发育良好的感光细胞是细胞替代治疗重建视环路的关键,日益完善的3D体外培养可稳定获取数量更多的视锥或视杆细胞[33],方便提供后续在体移植所需感光细胞,但供体-受体细胞之间及关联神经元之间电化学信号通路是否得到重建需更全面的验证。
2 视网膜类器官上基因修复
在RO上首先成功进行基因编辑修复突变的是RPGR基因突变患者来源的RO[34]。目前应用最广泛的基因编辑工具为成簇规律间隔重复短回文序列/相关蛋白核酸酶(clustered regularly interspaced short palindromic repeats/crisprassociated protein-9 nuclease,CRISPR/Cas9),由一段20个核苷酸组成的RNA介导识别特定的碱基序列,其设计简单、易于操作,被应用于疾病建模、基因筛选、表观基因修饰、细胞标记和基因治疗[35-36]。基因治疗与遗传性视网膜退行性疾病息息相关,AAV介导的基因补充治疗在先天性黑蒙患者已有成效,尽管理论上可以纠正遗传性视网膜病变的源头问题,但是由于CRIPR/Cas9潜在的脱靶效应可导致基因组不稳定以及影响正常基因表达,目前仍在动物试验阶段[37]。由于物种差异,动物模型并不能一致表现人类视网膜病变的特点,如RP2基因突变在人类造成X染色体连锁的视网膜色素变性(retinitis pigmentosa,RP),在小鼠并无表型,而RO对视网膜疾病建模更加逼真,视网膜退行性病变的基因治疗也逐渐以RO为模型[38]。RB1基因调节早期视网膜细胞进入分裂S期导致明显的细胞增殖,缺失RB1则引起各亚型细胞分化障碍,该基因也被认为与视网膜母细胞瘤(retinoblastoma,Rb)直接相关,早期Zheng等[39]体外CRISPR/Cas9敲除RB1后的hESC获取RO并未观察到肿瘤,只有大量凋亡的感光细胞、双极细胞、RGC,将RO移植至免疫缺陷鼠中同样无瘤体产生,Deng等[40]采用CRIPR/Cas9处理得到RB1纯合突变hiPSC,体外培养成RO也未观察到Rb,这与RB1突变致病性高不太相符[41],推测可能为CRISPR/Cas9未彻底敲除RB1等技术问题。同年Liu等基因敲除RB1,体外首次成功培养出Rb模型,得到与Xu等相同的结论:Rb起源于视锥前体细胞,并发现异常活跃的PI3K-Akt通路和显著上调的激动因子脾酪氨酸激酶(spleen tyrosine kinase,SYK),这为后续Rb药物筛选提供了更好的高真度肿瘤模型[42-44]。
Lane等[38]对比基因敲除RP2的hiPSC和RP2基因突变患者细胞来源的两种RO,观察到相似的RP视网膜病变:第150天视杆细胞凋亡达到顶峰和第180天RO外核层显著变薄,后续RP2基因补充治疗可逆转上述变化并恢复rhodopsin的表达。CRIPR/Cas9基因编辑同样在RPGP突变引起的RP、OPTN(E50K)突变的青光眼等RO疾病模型中获得明显的治疗效果[34,45-46]。近年来RNA水平剪切修饰异常导致视网膜病变逐渐受到关注,前体mRNA加工因子(pre-mRNA processing factors,PRPFs)被认为可造成常染色体显性RP,RP11型患者(PRPF31突变)来源的RO表现为显著的剪切相关蛋白表达异常,呈现RPE细胞极性混乱、胞吞障碍、跨上皮转运功能失常,同时感光细胞也有进行性损伤和细胞应激反应,经CRISPR/Cas9基因编辑后纠正了原RO所表现的RPE及感光细胞异常[47],影响RP相关的mRNA剪切因子还包括PAP1,伴随的下调基因有Fscn2和Bbs2[48]。探讨多种非编码RNA和相关剪切水平改变,有助于更全面地解释潜在致病机制,方便后续眼科遗传病治疗研究[49-50]。
师:看来这两题并不难,同学们已经理解了。可是刚才一开始为什么你会犯这样的错误呢?你觉得解答这类题目要注意些什么?
基因编辑与RO应用相辅相成。基因编辑成功在RO疾病模型上挽救多种遗传性视网膜病变,为其下一步临床应用打下坚实的基础,而RO经基因编辑能纠正患者来源细胞的基因缺陷,用于后续自体移植,避免常见的免疫排斥反应。
3 视网膜类器官衍生细胞的在体移植
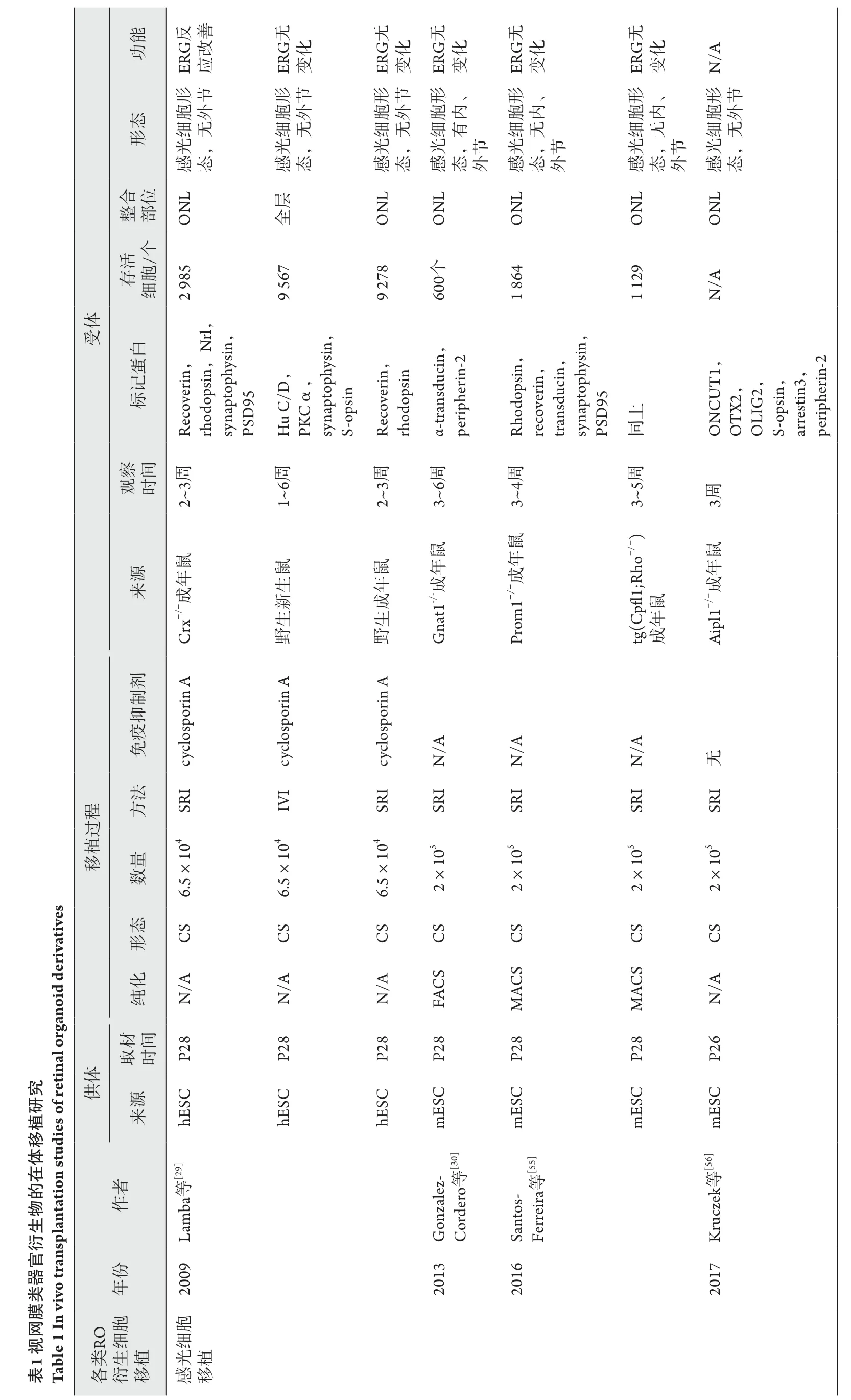
细胞替代治疗研究发展同步于获取移植细胞方式的变化,从早期ESC到iPSC,从平面培养到3D培养,诱导分化出的视网膜细胞逐渐接近完整的形态结构,但在体移植仍需考虑多方面因素,比如移植细胞的时期、数量等。Kaplan等[51]首次将人源感光细胞膜片移植到晚期RP患者视网膜黄斑下,未系统使用免疫抑制剂条件下,12个月后未观察到任何视力改善,同时也无免疫排斥反应和并发症的发生,提示了同种异源移植的安全性,为实现治疗效果,仍需考虑成熟的外源感光细胞是否有能力与受体视网膜内双极细胞、水平细胞建立突触并且较长时间存活。Maclaren等[52]认为外源细胞和受体视网膜细胞在发育阶段上差距过大可导致外源细胞不能整合至受体视网膜,并产生畸胎瘤,随之在移植细胞时间窗的选择上做出重要贡献,其研究表明移植分裂期后的感光细胞的前体细胞可成功整合至受体视网膜外核层内,并且通过光诱导电位和瞳孔收缩观察到明显的视功能改善,而移植增殖期干细胞或视网膜祖细胞并不能达成这种效果。多项研究[30,53-54]后续的结果也表明移植分化时期异质性大的细胞确实可导致畸胎瘤的产生及最终整合的细胞数目显著减少,此后研究也因此多采用分裂后期视网膜前体细胞用于细胞替代治疗(表1)。

3.1 感光细胞在体移植
3.1.1 感光细胞悬液注射
早期针对转基因视网膜缺陷小鼠的移植研究多采用玻璃体腔内或视网膜下腔的细胞悬液注射,方便批量操作,并且少有眼内炎发生,如葡萄膜炎、黄斑水肿等[53],Maclaren等[52]多次在小鼠玻璃体腔注射结果显示无整合的感光细胞,视网膜下腔注射更适合感光细胞移植。注射外源感光细胞可导致视网膜下腔出现少量气泡或水泡,Schwartz等[61]发现移植术后4 h水泡或气泡可完全消失,并未诱发视网膜脱落等并发症。Gonzalez-Cordeo等[30]采用mESC-RO来源的感光细胞,在RO发育阶段转染载有GFP荧光蛋白的腺病毒AAV,将GFP表达基因插入Rhodopsin基因启动子下游,荧光分选GFP阳性细胞,分别将第26、29、34天的2×105个视杆前驱细胞悬液注射至Gnat-/-小鼠视网膜下腔(Gnat负责编码重要的视杆细胞光传导蛋白,敲除后的小鼠用作夜盲症模型),3周后的结果表明第26、29天移植的外源感光细胞整合数目显著多于第34天移植,Crx在第26天表达减少并伴随Rhodopsin和Recoverin表达上升,而第36天大部分细胞已经表达成熟视杆细胞的标记蛋白α-Transducin和Peripherin-2,可推测第26~29天的培养细胞应处于感光前体细胞阶段[30,52]。整合的外源细胞拥有内外节,尽管结构相对完整,却未诱导出正常视网膜电图(electroretinography,ERG),推测主要原因为实际整合至外核层的外源感光细胞数目太少(移植后单眼存活约600个外源感光细胞)[30],并且细胞多聚集于注射点周围,未向周围迁移以达到平均分布。当前外源视杆前驱细胞的移植研究较多,视锥细胞虽然只占鼠感光细胞数目的3%及人感光细胞数目的5%,但功能十分重要,负责日间视觉及色觉,替换少量细胞即可显著改善视觉[62-63]。Kruczek等[56,64]通过mESC诱导RO,培养第14~16天加入视黄酸,视锥细胞逐渐增多,但在视杆细胞开始出现时显著减少,使用视黄酸可有效促进感光前驱细胞向视锥细胞发展,第16~18天加入Notch通路抑制剂DAPT,可最多收获约15%的视锥前体细胞,并能在移植后逐渐形态成熟,但欠缺视功能恢复情况的检查。
为研究晚期视网膜退行性变的细胞替代治疗效果,需要建立晚期视网膜膜退行性变动物模型,Prom-/-型小鼠模型是现在一种常用于感光细胞移植的轻型视网膜退行性变动物模型,将Prom-/-型小鼠与rhodopsin基因敲除的tg(Cpfl1;Rho-/-)转基因鼠杂交得到严重的视网膜退行性变动物模型,mESC-RO培养得视网膜前体细胞,后经磁性激活细胞分选技术(magnetically activated cell sorting,MACS)富集CD73抗体阳性的视杆前驱细胞,将2×105单位视杆前驱细胞注射至鼠鼻侧视网膜下腔,结果显示外源视杆细胞胞可体定位于内核层,逐渐形成具备内外节的成熟感光细胞形态,且表达光传导通路的蛋白rhodopsin、arrestin-1、transducin及突触相关蛋白synaptophsin、PSD95、pikachurin等,体内存活可达4周,但ERG无反应,可能由于邻近外源视杆细胞的内源水平细胞、双极细胞未重新伸出树突以建立视环路[55]。正常诱导ERG所需外源感光细胞数目的研究结果各不相同,大部分注射的外源感光细胞数约为2×105单位,却存在整合的外源细胞数目在15 000和3 000都能够诱导ERG的现象,后续研究应明确诱导ERG反应必需的外源感光细胞数目[29-30,54]。视网膜下腔注射式移植研究结果异质性较大,但对于功能恢复的试验条件仍有参考意义。
3.1.2 感光细胞膜片移植
玻璃体腔或者视网膜下腔注射外源感光细胞常表现为整合的细胞聚集于注射点周围,并不能平均分布于受体视网膜,采用感光细胞膜片移植的方法地可使外源细胞平铺到受体视网膜特定部位。Assawachananont等[65]在晚期IRD模型鼠中采取细胞悬液移植结果显示外源感光细胞存活时间不超过6个月,并且外源感光细胞形态发育不成熟,后Mandai等[66]采用RO来源的感光细胞膜片移植至rd1小鼠模型,观察到外源感光细胞形成内外节,与内源水平细胞建立突触连接,且在分化第17天时移植整合效率最佳,外植体存活时间最少6个月。当内源视网膜处于已经严重丢失外核层的致病微环境中,视网膜片移植最大程度上维持了外源感光细胞生存环境的稳定,利于外源感光细胞形态分化成熟。
Shirai等[67]首次在视网膜退行性变猴模型上进行视网膜下腔移植hiESC-RO来源的视网膜细胞膜片,外源感光细胞可在体内继续分化出成熟内外节,染色标记水平细胞特定蛋白PKC-α、RIBEYE,可观察到外源感光细胞与受体视网膜内水平细胞建立突触连接,并且比较在分化第50~60、60~70、100天移植的视网膜片,可发现第50~60天的视网膜片移植后可产生更厚的内核层。感光细胞膜片移植方法拥有移植后细胞存活数目多及分化效果好等优点,但移植体较大,创伤可能更多,术后并发症发生概率可比细胞悬液移植更大,需要在手术操作细节上进一步优化,以达到更好的移植效果。
3.2 视网膜神经节细胞移植
RGC是眼球内视觉信号的终点站,随后将神经纤维投射至中枢神经系统(外侧膝状体及上丘),青光眼等疾病导致的RGC进行性凋亡,只能通过细胞替代治疗才能解决视力损伤问题,外源RGC能否形成类似体内的轴突及树突并与相关细胞建立功能连接是移植研究成败的关键。胚胎来源或体外干细胞来源的视网膜祖细胞移植对于视网膜受损的啮齿动物模型具有明显的RGC保护作用,甚至能促进神经节细胞和视神经的再生,改善视功能[68-70]。Venugopalan等[71]采集1~5 d幼鼠视网膜,体外培养后通过RGC表面特异抗原CD90富集纯度高达99.5%的RGC细胞悬液,后经玻璃体腔注射,4周以后发现外源RGC与内源RGC有着相似细胞形态,轴突向受体视盘延伸,树突向内从状层生长,1个月后观察到GFP阳性的外源RGC纤维终止于大脑外侧膝状体背腹侧核以及上丘,Lim等[72]也得出相似结果,外源RGC成功建立与中枢神经系统的联系促进了后续干细胞诱导分化RGC用于移植研究。多数实施视网膜下腔注射细胞悬液的研究未能观察到RGC明显的电生理反应,而RGC通过细胞膜片进行视网膜表面或玻璃体腔移植更有效率,这符合RGC位于视网膜最内层的解剖结构特点,膜片移植的方法也逐渐应用于RGC在体移植[73]。
Iraha等[57]在分化第60天,移植hESC-RO来源视网膜片至NOD-rd1-2j和NOG-rd10的杂交鼠模型中,该模型兼具视网膜退行性变和免疫缺陷的特点,结果显示外源膜片中的感光细胞可形态成熟,但仅有较少聚集的神经节细胞对光刺激有反应,并且表现为常规或较弱光刺激下的高敏感对光反应,这种异常的光反应现象可能是外源细胞与原视网膜中高兴奋性RGC建立了不成熟的连接,早期研究使用miPSC-RO来源的视网膜片移植后位点全部具有对光反应,本实验对光反应的RGC数目较少可能因为人类RGC突触形成所需时间较长,也可能与异种移植的低突触形成率有关[74-75],这些问题均会导致最终光传导通路未完全建立。Xian等[58]对hESC进行约30 d分化,当其大量表达RGC的标记蛋白Brn3、Islet1、HuD时收获RO,将其贴附于Matrigel包被的聚乳酸-羟基乙酸共聚物(PLGA)支架上,继续培养5 d,随后移植RO-PLGA复合体至眼内压增高的恒河猴模型(rhesus monkeys with chronic ocular hypertension,OHT恒河猴),每周进行免疫荧光显微镜检查,可发现外源RGC形态逐渐成熟,大量细胞伸出树突,由于第8周时玻璃体已经开始出现浑浊,遂安乐死实验恒河猴,免疫组织化学染色检测到RGC的轴突特异性蛋白,说明hESC-RO来源的神经节细胞可在受体视网膜内逐步分化为成熟形态,但外源RGC细胞多缺乏髓鞘结构,可能是相关电生理检查结果不明显的原因[76]。尽管有些动物试验在外源RGC移植后能观察到伸长的轴突投射至外侧膝状体和上丘,但是对于视觉功能恢复的检验手段仅限于细胞组织层面的局部电生理检查,并未在小鼠个体模型上进行视功能相关的行为学验证[71],因此外源RGC移植效果仍需要更全面的功能检查,保证临床前试验的真实可靠性,以便推动后续临床研究。
3.3 色素上皮移植
RPE细胞不仅吸收光线、传递营养物质、吞噬感光细胞外节、再生11-顺-视黄醛、分泌生长因子和细胞因子,而且促进外源感光细胞形成突触并减少其凋亡[77-80]。RPE释放多种细胞因子,如TGF-β、PEDF、somatostatin等,有抑制非特异性及获得性免疫的效果[81],减少移植免疫排斥反应发生,促进RPE移植的应用。目前暂无需RO获取RPE作为移植物,这与RPE在胚胎发育中的特点有关,发育早期前脑泡头褶的两侧内陷形成双层结构,外层发育为视网膜中的色素上皮层,内层发育为神经视网膜层,在人胚胎第32~50天,外层细胞进入分裂期后即分化为有极性、有色素的单层上皮层结构,且正常情况下一直保持非增殖状态[82-83]。因此,在体外分化过程中并不需要RO收获RPE前体细胞以备后用,在hESC分化形成胚状体后,即可肉眼逐渐观察到RPE细胞形成的外层色素沉着区,分离后继续培养即可得到成熟RPE细胞[60,84]。人源RPE细胞体外培养并筛选SSEA表面抗原阳性的细胞亚群,可实现RPE细胞自我增殖,并且在分化第4周移植对RCS小鼠视力挽救效果最好[85-86]。
ESC和iPSC分化来源的RPE细胞用作细胞替代治疗仍是主流,且早已有相关临床研究,在AMD、Stargardt患者中移植后治疗效果为最佳矫正视力轻度改善、不变或加重,效果虽不一致,但均未观察到过度增殖、免疫排斥反应[59,61,87-88],接受移植患者数目很少可能造成不良反应的遗漏和治疗效果的偏差。对于RPE细胞移植,细胞膜片同样较细胞悬液效果更好,细胞悬液移植使外源RPE细胞难以黏附于病变Bruch膜,造成大量细胞凋亡[89];膜片式移植则使外源RPE存活数目更多,形态分化更成熟,形成有极性的单层结构[60],同时RPE细胞的分化程度和色素化程度也可能对移植后细胞的增殖和迁移产生影响[61]。
4 视网膜细胞替代治疗的问题与改进
4.1 移植动物模型的构建
视网膜退行性病变逐步进展,仅累及少部分视网膜细胞的早期病变,或大片层状结构消失的晚期视网膜病变,均需针对性的治疗措施,为了模拟人类不同视网膜病变时期的视网膜细胞分布特点,临床前试验的动物模型也从常用啮齿类动物过渡到非人灵长类动物。构建视网膜退行性变模型的早期方法不成熟,通过碘乙酸、眼内光纤、强光刺激处理得到缺失感光细胞的动物模型,这些处理方式的视网膜病变尺寸难以控制,不能稳定复现[90-92]。Shirai等[67]采用猴视网膜下腔注射氯化钴,营造一种类似缺氧的环境,可选择性地损伤感光细胞层,但药物安全浓度范围很窄,实际效果欠佳。在满足易操作、时间短的要求下,Gao等[93-95]应用硝普钠视网膜下腔注射,成功在浓度0.1 mmol/L时经7 d即可快速建立只丢失外核层、外从层和色素上皮层的OHT恒河猴,可大大缩短后续动物建模时间,具体机制可能与该药品释放的NO和O2生成过氧三硝基的毒性有关。
4.2 移植用具的选择
视网膜细胞替代治疗术中器械主要包括细胞悬液常用的注射器和膜片移植常用的手术钳和导管,细胞悬液的移植使用注射器能满足定点移植,而膜片移植体积更大,为保证其平铺于预设移植区域需采用手术钳夹持或拥有较大管腔的导管传送,研究[96]表明导管组较手术钳组存活的细胞数更多,可能因为手术钳对膜片夹持造成细胞损伤丢失,而导管可以很好地保护移植膜片。外源RGC整合至受体视网膜需要至少3周,这与内界膜的功能密切相关,并且黄斑区以外范围哺乳动物比啮齿动物内界膜的穿透性更差[97-100],所以如何延长外源细胞与受体视网膜的接触时间也是关键问题,Luo等[96]比较气液交换、水凝胶填塞、视网膜钉3种固定方式,在术后30 d发现气液交换和水凝胶填塞处理的外植体完全移位,只有视网膜钉处理组固定在预设区域,术后早期有出血现象但快速凝血,视网膜切片染色可发现靠近视网膜钉位点的内从状层增厚。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)增多在早期报道中被认为与视网膜钉术后视力受损有关,它是Muller细胞的骨架蛋白,视网膜机械性损伤时表达上升,与视网膜胶质瘢痕有关,而胶质瘢痕可抑制外源感光细胞迁移和整合,因此GFAP可作为视网膜钉术后风险预估指标[101-103]。Luo等[96]免疫荧光显示轻度的GFAP增生,无小胶质细胞激活现象,且应用免疫抑制剂雷帕霉素可显著抑制上述炎症现象。一份早年对视网膜钉临床应用的10年随访病例报告也支持视网膜钉持久的固定作用[104]。当然视网膜钉肯定会造成固定位点的组织损伤,现在临床中对视网膜剥脱或撕裂的手术方式主要是硅油填充或激光光凝,但动物实验中视网膜钉固定外源细胞膜片效果最好,联合免疫抑制剂也可避免炎症及增生反应的发生,因此权衡之下应用视网膜钉可能是现有固定外源细胞膜片的最佳手段。
4.3 移植位置的选择
外源细胞移植至视网膜的位置可影响最终的研究结果,视网膜退行性变是渐进式发展,位于疾病早中期的视网膜可包含视网膜萎缩区、过渡区及正常区,过渡区视网膜即将发展至疾病下一阶段,可作为视网膜变性疾病早中期的模型,更能代表后续针对众多早中期视网膜退行性变患者的疾病状态和移植效果。Schwartz等[84,105]在临床试验中采取此方法移植hESC来源RPE应用于AMD和Stargadt患者,可在平均随访22个月后观察到较对照组平稳甚至得到改善的最佳矫正视力,先前研究采取RPE至于病变区中央(萎缩区)的方式不能达到改善视力的效果,主要由于病变最重区域的感光细胞层,Bruch膜和脉络膜层均严重受损或缺失,外源RPE难以存活。
4.4 免疫抑制剂的使用
细胞替代治疗研究现在并非全部使用自体移植细胞,而且经巩膜的有创操作可能打破血眼屏障,最终造成免疫排斥反应,同种异体iPSC来源RPE移植后出现的免疫反应包括玻璃体腔内IL-12升高、视网膜下腔巨噬细胞聚集[106-107]。针对免疫抑制药物的选择及应用方式同样值得关注,免疫抑制剂雷帕霉素和地塞米松体外均可抑制小胶质细胞的聚集,Xian等[58]对比二者应用于移植术后的效果,发现只有地塞米松组可明显延长外源RGC存活时间,约8周,但地塞米松的半衰期短,可考虑缓释剂型延长作用时间。对比不同的免疫抑制剂给药方式,结果发现玻璃体腔内注射相比传统的系统给药方式更加有效,延长外源RPE细胞的生存时间,推测原因为血眼屏障、药物分布效应、安全剂量条件下,传统给药方式难以在视网膜最终达到有效药物浓度,玻璃体腔内注射则可定点地快速给予足量的药剂,具有更好的免疫抑制效果,玻璃体腔内注射地塞米松有引起青光眼和白内障的风险,因此需要确定玻璃体腔内注射的安全剂量[108-109]。
4.5 免疫荧光染色的应用
免疫荧光染色常用于镜下观察细胞替代治疗后外源细胞的形态功能变化,然而已有研究指出供体-受体细胞可双向交换蛋白或线粒体,可能通过微囊泡、外泌体或纳米管道实现,早期通过免疫荧光法得出的有效结论也因此受到质疑,如荧光阳性细胞的真实来源问题[110-111]。为增加荧光染色的可靠性,有研究使用雄性小鼠来源GFP标记的ESC获取感光细胞,后移植到雌性大鼠视网膜内,将Y染色体结合荧光蛋白,观察外源GFP阳性但Y染色体阴性的细胞定位,或使用hESC来源移植物时添加人细胞核特定抗体(hNUCLEI+),后续观察双阳性细胞,而且最终人源感光细胞拥有显著大于鼠感光细胞的细胞核体积,多种荧光验证和不同细胞特征的测量对比大概率确定了荧光细胞的来源[31],但仍存在荧光细胞数目过少时,过度解读研究结果的风险,荧光跨细胞交换效率也会影响结果的真实性。观察移植后的外源细胞不应该局限于免疫染色,新兴的共聚焦激光扫描检眼镜,可对移植后的感光细胞进行长期监测,并获得多种生物标记参数,包括移植物大小、GFP密度、移植细胞的迁移、移植后并发症(出血、视网膜萎缩、周边视网膜增殖等),能够提高术后结果的检出率[112]。微视野检查和自适应扫描激光显微镜则可在细胞层面上验证视功能恢复的具体位置与移植部位的一致性,排除由于原视网膜残存细胞引起的假阳性视功能改善现象。
5 结语
视网膜类器官研究发展迅速,面对之前素手无策的视网膜变性疾病,RO及其衍生物提供了细胞替代治疗的新可能,在动物模型及临床试验已取得经多方验证的成效。移植前的体外诱导RO技术逐渐成熟,包括分化过程中使用的培养基,也逐渐由血清,滋养层细胞共培养等方式简化至联合明确的小分子即可诱导分化出RO及衍生细胞,这符合获取移植物的生产质量管理规范(good manufacturing practice,GMP)原则[113],但获取高质量移植物不只限于简化培养所需成分,机体内大到器官,小到细胞,都需要多因素的调控作用才得以发挥正常功能,后续研究应明确更多影响视网膜细胞分化成熟所必需的因子[114]。移植过程中术式及器具应继续改良,减少或避免损伤血眼屏障;靶向应用免疫抑制剂,规避手术创伤副作用的同时延长移植后细胞或组织的存活时间。RO相关动物移植研究结果差异很大,多在视觉通路的不同细胞层面都获得较好的电生理反应,却极少在实验动物行为学层面验证视觉功能恢复情况,如水迷宫、光栅实验等,最终局限于细胞组织的功能验证导致对个体视功能改善情况评价有失偏颇。为得到实验动物视力改善的相对客观评价,后续研究需做到同批实验动物除干预处理之外的其他条件高度一致,并且实验动物的行为学检测足够全面反应视觉改善情况,包括动物的光感、运动、时间分辨、形状分辨、及空间分辨的改善情况。移植后的免疫排斥反应可通过自体来源细胞移植避免,但自体移植所需移植物的体外分化培养时间更长,可能错失视网膜病变的最佳移植时间窗[115],因此体外细胞分化培养效率需进一步提高,结合基因编辑获取自体移植细胞或者降低同种异体移植物的免疫原性,如建立人iPSC库[116-117],实现高效的细胞替代治疗。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。
