3D 打印多孔钽的生物安全性评价
2022-05-26张璞蒋波张玲王旖曾荣荣杨柳王富友范能全通信作者
张璞,蒋波,张玲,王旖,曾荣荣,杨柳,王富友,范能全(通信作者)
1 重庆市食品药品检验检测研究院 (重庆 401121);2 陆军军医大学西南医院关节外科 (重庆 400038)
钽是一种“亲生物”的过渡金属,作为医学植入材料已被广泛用于临床近80年[1-2]。近年来,随着材料科学的迅速发展,医用多孔材料逐渐替代固体金属被应用于多种外科植入手术中,且应用越来越广泛、用量越来越大。多孔钽凭借其自身的优异特性,如良好的骨传导、骨诱导与成骨作用,在众多医用材料中脱颖而出,成为最理想的植入材料之一[3-5]。3D 打印是一种快速成型技术,具有个性化、高精度等优点,在生物医疗领域应用广泛,其中,3D 打印个性化植入体是目前临床医学发展的新趋势[6-7]。基于此,本研究按照GB/T 16886《医疗器械生物学评价》标准对3D 打印多孔钽进行了全面的生物安全性评价,旨在为该材料在外科植入领域的安全应用提供科学依据。
1 材料与方法
1.1 实验材料、仪器和动物
1.1.1 实验材料
3D 打印多孔钽、钽圆片(直径10 mm,厚1 mm)、钛圆片(直径10 mm,厚1 mm)均系陆军军医大学西南医院关节外科赠送;小鼠成纤维细胞(L929)、中国仓鼠肺细胞(CHL 细胞)均购自中国科学院细胞库(上海);TA97、TA98、TA100、TA102、TA1535菌株和大鼠肝脏微粒体酶S9均购自CHI SCIENTIFIC,丝裂霉素C 购自MYM BIOLOGICH TECHNOLOGY, 环 磷 酰 胺 购自SIGMA-ALDRICH,秋水仙素购自重庆川东化工(集团)有限公司;高密度聚乙烯膜(Lot. No.C-161)及二乙基二硫代氨基甲酸锌的聚氨酯膜(Lot. No. A-182K)均购自Hatano Research Institute,FDSC(日本东京);大豆油(供注射用)购自广州白云山汉方现代药业有限公司;0.9%氯化钠注射液购自四川科伦药业股份有限公司。
1.1.2 实验仪器
HVA-85高压灭菌锅(日本Hirayama 公司),Synergy HTX 酶标仪(美国Biotek 公司),CB150二氧化碳培养箱(德国BINDER 公司),Sorvall ST 8R高速冷冻离心机(美国Thermo Fisher 公司),MJ-250F-Ⅲ微生物培养箱(上海龙跃仪器设备有限公司),IX71倒置生物显微镜(日本Olympus 公司),TBA-40FR 全自动生化分析仪(日本Toshiba 公司),BC-5300Vet 血液分析仪(深圳迈瑞生物医疗电子股份有限公司),UV2600分光光度计(日本Shimadzu 公 司),UX620H 电 子 天 平(日 本Shimadzu 公司),ACS-6Kg 电子计价秤(永康市永州衡器有限公司)。
1.1.3 实验动物
普通级新西兰兔,由济南金丰实验动物有限公司提供;SPF 级KM 小鼠,由辽宁长生生物技术股份有限公司提供;Hartley 豚鼠,由重庆壁山区腾鑫养殖场提供。动物均在重庆市食品药品检验检测研究院动物饲养室饲养,室温20~25 ℃,相对湿度40%~70%,12/12 h 明暗交替照明。
1.2 方法
1.2.1 3D 打印多孔钽试样浸提液制备
采用超纯水超声清洗3D 打印多孔钽试样15 min,自然晾干,再置高压灭菌锅内121 ℃灭菌30 min,备用。根据GB/T 16886.12-2017《医疗器械生物学评价第12部分:样品制备与参照材料》的规定,细胞试验采用RPMI.完全1640培养液作为浸提介质,按照0.2 g/ml 的比例在37 ℃浸提24 h;其他试验项目均选用0.9%氯化钠注射液和大豆油(供注射用)分别作为极性溶剂和非极性溶剂,按照0.2 g/ml 的比例加入后于37 ℃条件下浸提72 h。
1.2.2 遗传毒性试验[8]
根据GB/T 16886.3-2019《医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验》推荐,采用细菌回复突变试验、哺乳动物细胞微核试验和体外哺乳动物细胞染色体畸变试验组合进行遗传毒性试验。
1.2.2.1 细菌回复突变试验
取鉴定合格的TA97、TA98、TA100、TA102和TA1535菌株的冻存液0.1 ml 接种至装有25 ml 营养肉汤培养基的三角瓶中,振荡培养至对数生长期,融化顶层琼脂培养基分装于无菌小试管中,2 ml/管,于45 ℃水浴中保温待用。
在保温的顶层琼脂培养基中依次加入测试菌株新增菌液0.1 ml 和浸提液0.1 ml,溶剂对照组加入0.1 ml 菌液和0.1 ml 浸提介质,需活化时另外加入0.5 ml 的S9,混匀后,迅速倾入底层培养基上,转动平皿使顶层琼脂培养基均匀分布在底层上,平放固化,每个剂量做3个平皿;于37 ℃培养48 h 后,观察并计数各组回变菌落数。
1.2.2.2 哺乳动物细胞微核试验
健康成年SPF 级KM 小鼠50只,雌、雄各半,体质量20~22 g。按体质量随机分为极性/非极性溶剂组、极性/非极性浸提液组、阳性对照组,每组10只,雌、雄各半。试验采用30 h 两次给药法,各组按20 ml/kg.bw 腹腔注射,连续给予2次,间隔24 h,并于末次给药后6 h 采集骨髓样品,与新生牛血清混匀后制备骨髓涂片、固定、染色。在显微镜下观察计数200个红细胞中嗜多染红细胞(polychromatic erythrocytes,PCE)、 正 染 红 细 胞(normochromatic erythrocyte,NCE)的个数,计算PCE/(PCE+NCE)的比值;计数含微核的PCE 细胞数,微核率以千分率表示。
1.2.2.3 体外哺乳动物细胞染色体畸变试验
取处于指数分裂期贴壁生长良好的CHL 细胞,调整密度为1×106个/ml,培养24 h。按照表1所示加样方式加样,每组设2个平行瓶。
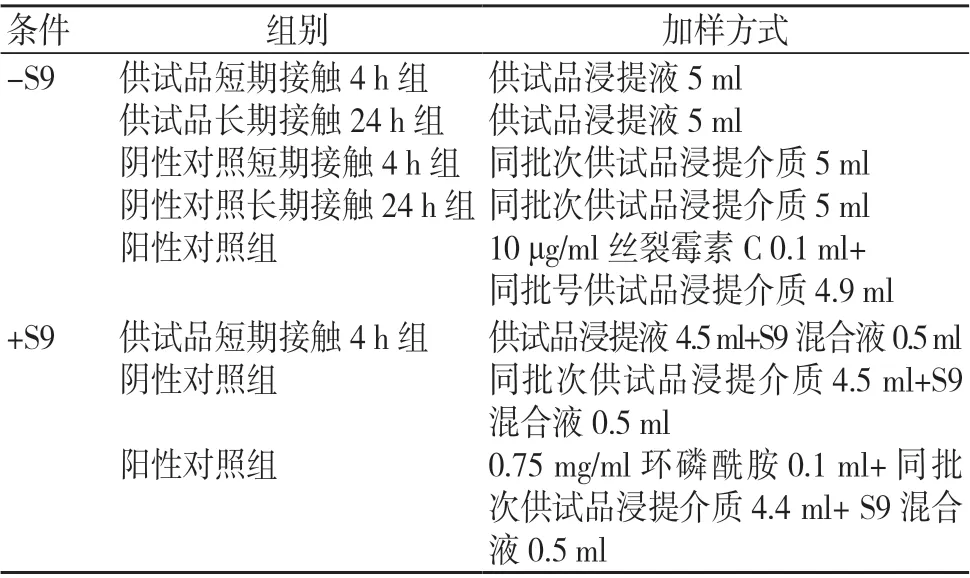
表1 试验加样方式
各组在终止培养前4 h,加入50 μg/ml 秋水仙素0.1 ml 至5 ml 培养液中,培养结束时,进行细胞收集与计数。细胞悬浮液经低渗处理后固定、滴片、染色,在显微镜下观察并记录染色体畸变情况。
1.2.3 溶血试验[9]
普通级新西兰兔,体质量2.5 kg,采血制备成稀释兔血;将供试品极性/非极性浸提液组、阴性对照组、阳性对照组的全部试管放入37 ℃水浴中保温30 min 后,每支试管加入0.2 ml 稀释兔血,轻轻混匀,置于37 ℃水浴中继续保温60 min;倒出各管内液体以800×g 离心5 min ;吸取上清液在545 nm 波长处测量吸光度。
1.2.4 体外细胞毒性试验[10]
取生长良好的L929细胞,调整密度为1×105个/ml,将其接种于96孔板中,培养24 h;吸出培养基,每孔加入100 μl 供试品100%浸提液(S-100%)、供试品75%浸提液(S-75%)、供试品50%浸提液(S-50%)、供试品25%浸提液(S-25%)、阴性对照液(高密度聚乙烯膜浸提液)、阳性对照液(二乙基二硫代氨基甲酸锌聚氨酯膜浸提液)及空白培养基,继续孵育24 h 观察结果,并进行MTT 检查后计算细胞存活率。
1.2.5 植入后局部反应[11]
普通级新西兰兔48只,雌、雄各半,体质量2.5~3.0 kg,采用家兔脊柱旁肌植入方法分别将1片直径10 mm、厚度1 mm 的钽圆片及钛圆片沿脊柱一侧植入肌肉,与脊柱平行,离中线25~50 mm,作为实验组及对照组;术后观察动物一般情况,分别于第14、28、56、84天后无痛处死动物,进行大体、组织学观察并评价。
1.2.6 皮内反应试验[12]
普通级新西兰兔3只,体质量2.0~2.5 kg,在每只家兔脊柱侧去毛区按规定分别注射极性/非极性浸提液及相应的阴性对照液,注射后即刻及24、48、72 h 观察记录各注射部位状况并计分。
1.2.7 皮肤致敏试验[12]
Hartley 豚鼠50只,体质量300~500 g,按体质量随机分为供试品极性/非极性浸提液组、极性/非极性溶剂组和阳性对照组,每组10只;通过动物肩胛骨的内侧皮内注射0.1 ml 进行诱导,皮内注射后7 d,采用敷贴片局部贴敷覆盖诱导注射点,局部诱导阶段后14 d,使用供试品进行激发,并于试验结束后24、48 h 观察动物激发部位情况并计分。
1.2.8 急性全身毒性试验[13]
SPF 级KM 小鼠20只,体质量18~22 g,按体质量随机分为供试品极性/非极性浸提液组、极性/非极性溶剂组,每组5只;按50 ml/kg.bw 进行腹腔注射,给药后观察72 h。
1.2.9 亚慢毒性试验[13]
普通级新西兰兔24只,雌、雄各半,体质量2.0~2.5 kg,按体质量随机分为假手术组、供试品组,每组12只。本试验的供试品为直径10 mm、厚1 mm 的钽圆片。于试验第1天从家兔背部肌肉植入3片钽圆片;第90天每组各解剖8只动物,雌、雄各半,采集标本进行血液学、血液生化学、病理等检测;第91天取出供试品组剩下4只动物体内植入的钽圆片,恢复30 d,于第121天解剖所有动物并采集标本做检测。
1.3 统计学处理
2 结果
2.1 遗传毒性试验
2.1.1 细菌回复突变试验
如图1所示,供试品极性/非极性浸提液组在加和不加代谢活化系统的条件下TA97、TA98、TA100、TA102菌株的回变菌落数均小于溶剂对照组计数的2倍,TA1535菌株的回变菌落数小于溶剂对照组计数的3倍,表明3D 打印多孔钽细菌回复突变试验为阴性。
2.1.2 哺乳动物细胞微核试验
2.1.2.1 PCE/(PCE+NCE)比值
如图2A 所示,供试品极性/非极性浸提液组小鼠的骨髓PCE/(PCE+NCE)比值与对应的溶剂对照组比较,差异无统计学意义(P>0.05),表明3D 打印多孔钽试样无体内骨髓细胞毒性。
2.1.2.2 微核试验结果
如图2B 所示,阳性对照组小鼠PCE 中微核明显增多,与溶剂对照组及供试品极性/非极性浸提液组比较,微核率显著升高,差异有统计学意义(P<0.01),表明试验成立;供试品极性/非极性浸提液组小鼠PCE 微核率与对应溶剂对照组比较,差异无统计学意义(P>0.05),表明3D 打印多孔钽无体内遗传毒性。
2.1.3 体外哺乳动物细胞染色体畸变试验
3D 打印多孔钽浸提液对CHL 细胞的毒性:细胞毒性结果显示,3D 打印多孔钽浸提液在加和不加S9条件下接触CHL 细胞4 h,在不加S9条件下接触CHL细胞24 h,其相对细胞增长数分别为84.68%、85.07%、84.68%,均大于80%,无细胞毒性。
3D 打印多孔钽浸提液对CHL 细胞染色体的影响:染色体畸变观察结果表明,3D 打印多孔钽浸提液在加和不加S9条件下接触CHL 细胞4 h,在不加S9条件下接触CHL 细胞24 h,均未发现畸变细胞,其染色体畸变率与阴性对照组比较,差异无统计学意义(P>0.05),表明3D 打印多孔钽无致染色体畸变作用。
综合细菌回复突变试验、哺乳动物细胞微核试验和体外哺乳动物细胞染色体畸变试验的结果,表
2.2 溶血试验
2.3 细胞毒性试验
从细胞形态方面看,3D 打印多孔钽浸提液组的细胞生长良好,与空白对照组中的细胞形态无差异;MTT 试验中,以空白对照组作为存活率100%计算,3D 打印多孔钽浸提原液(S-100%)及3个浓度稀释液(S-75%、S-50%、S-25%)接触L929细胞24 h 后,其细胞存活率均大于80%,大于空白对照组的70%,S-50%组存活率大于S-100%组的存活率,具体结果见图3,表明3D 打印多孔钽无潜在细胞毒性。
2.4 植入后局部反应
试验期间,所有实验动物术后一般情况良好,进食及活动正常,伤口无肿胀、分泌物,均无感染发生,也未见材料排出,伤口均2周愈合。
解剖时肉眼观察,钽圆片和钛圆片植入位置基本正常,纤维囊形成良好,钽、钛圆片与周围肌肉结合紧密,无移位、无脱出,取出顺利,囊壁纤维组织与钽、钛圆片未见明显粘连;取材时测量植入材料大小,与术前相比,外观尺寸保持不变。
家兔肌肉局部植入试验的肌肉刺激反应结果见表2,病理半定量评价结果见图4。试验结果表明,供试品组术后各观察时间点的肌肉刺激反应等级、植入后局部组织病理改变评分与对照组比较,差异无统计学意义(P>0.05)。

表2 家兔肌肉刺激反应等级
2.5 皮内反应试验
供试品极性/非极性浸提液组以及阴性对照组在注射后24、48、72 h 的评分均为0,未见刺激反应。试验结果表明,3D 打印多孔钽无皮内刺激作用。
2.6 皮肤致敏试验
供试品极性/非极性浸提液组以及极性/非极性溶剂组在激发后24、48 h 的评分均为0,未见皮肤致敏反应;阳性对照组在去除敷贴片后24 h 有1只动物评分为2分,2只动物评分为1分;48 h 有2只动物评分为1分,出现皮肤致敏。试验结果表明,重复接触3D 打印多孔钽对Hartley 豚鼠不引起致敏反应。
2.7 急性全身毒性试验
对小鼠腹腔注射3D 打印多孔钽的极性/非极性浸提液,在72 h 观察期内小鼠未见中毒症状或不良反应,且小鼠体质量正常增长。试验结果表明,3D 打印多孔钽不会引起急性全身毒性反应。
2.8 亚慢毒性试验
试验期间,所有实验动物术后一般情况良好,进食及活动正常。供试品组动物在植入期和恢复期的体质量增长率、摄食量、主要脏器体质量比以及尿常规与假手术组比较,差异均无统计学意义(P>0.05)。
血液学的15个指标以及血液生化的18个指标中,供试品组和假手术组比较,差异均无统计学意义(P>0.05),具体结果见表3~4。
表3 血液学检测统计结果(±s)

表3 血液学检测统计结果(±s)
检测项目 植入期(n=8) 恢复期(n=4)假手术组 供试品组 假手术组 供试品组凝血酶原时间(s) 8.50±0.25 9.18±0.73 9.52±0.46 9.62±0.29活化部分凝血活酶时间(s) 46.20±9.17 50.5±12.8 61.80±6.38 61.00±4.57白细胞计数(G/L) 9.05±3.53 6.84±2.29 7.33±2.93 6.66±2.22红细胞计数(T/L) 5.87±0.44 5.57±1.02 5.99±0.54 6.07±0.64血红蛋白(g/L) 129.86±7.86 125.17±22.80 135.00±8.41 134.80±5.26红细胞容积(L/L) 40.04±4.65 36.48±6.35 39.13±2.55 38.50±1.50平均红细胞容积(fl) 68.07±3.21 65.65±5.14 65.55±2.95 63.86±4.67平均红细胞血红蛋白含量(pg) 22.16±1.08 22.48±1.48 22.63±1.08 22.34±1.72平均红细胞血红蛋白浓度(g/L) 326.43±23.24 342.67±7.84 345.17±5.19 350.00±3.74红细胞分布宽度变异系数(%) 12.49±1.00 12.48±0.66 12.45±0.46 12.58±0.41红细胞分布宽度标准差(%) 37.16±3.74 35.58±3.05 35.67±2.18 35.08±1.83血小板计数(G/L) 418.86±172.73 331.83±162.29 302.50±39.02 326.80±115.35平均血小板体积(fl) 5.94±0.49 6.33±0.41 6.25±0.59 6.02±0.51血小板分布宽度(fl) 15.19±0.29 15.22±0.42 15.07±0.31 15.02±0.26血小板压积 0.25±0.11 0.21±0.10 0.19±0.02 0.19±0.06
对供试品组和假手术组动物的肝、心、脾、肺、肾、脑等组织、器官以及试验部位肌肉进行病理形态学检查,各组织、器官和试验部位肌肉均未见明显毒性作用。
3 讨论
多孔钽是新一代理想的植入材料,伴随个性化医疗的发展,3D 打印多孔钽已成为研究热点。目前,关于3D 打印多孔钽制备工艺和临床治疗有效性的研究较多[14],安全性方面的研究多为体外细胞试验,在体安全性方面的研究甚少,因此,3D 打印多孔钽的生物安全性需要更全面、系统的试验数据来证实。本研究根据GB/T 16886《医疗器械生物学评价》标准中对植入材料的要求,对外科植入物用3D 打印多孔钽材料进行了全面的生物安全性评价。试验结果表明,3D 打印多孔钽无遗传毒性,不引起溶血反应,无潜在细胞毒性,不引起皮内刺激,无皮肤致敏性,不引起急性全身毒性反应,无亚慢性全身毒性,符合国家医用材料临床应用的标准。
长期植入用产品植入后的局部反应、亚慢性毒性试验应是安全性评价重点关注的内容。较采用大鼠尾静脉注射等方式进行亚慢性全身毒性的考察方式,本研究采用新西兰兔肌肉植入的方式进行试验,能重现该材料的临床使用方式,更直接、真实地反映植入材料产品的安全性;同时,采用临床上应用广泛且生物相容性研究也相对成熟的材料钛[15]作为植入后局部反应试验的参照样品,试验结果显示,供试品与参照样品比较,各项指标均无明显差异。
表4 血液生化检测统计结果(±s)

表4 血液生化检测统计结果(±s)
检测项目 植入期(n=8) 恢复期(n=4)假手术组 供试品组 假手术组 供试品组肌酐(μmol/L) 248.57±147.43 268.33±37.76 220.50±39.62 205.40±44.55谷氨酰转肽酶(IU/L) 10.14±4.18 9.50±3.27 10.00±4.05 11.60±6.50尿素(mmol/L) 6.67±1.59 5.27±0.80 6.02±1.95 6.15±1.59丙氨酸氨基转移酶(U/L) 63.29±27.71 45.50±17.91 66.33±32.41 75.80±43.43门冬氨酸氨基转移酶(U/L) 47.29±30.14 37.50±8.04 57.17±26.77 68.40±39.62碱性磷酸酶(U/L) 52.29±13.59 59.33±10.37 48.17±13.91 65.80±39.20总蛋白(g/L) 73.63±11.21 72.87±6.48 68.80±5.54 67.52±7.05白蛋白(g/L) 44.19±2.68 43.77±3.03 43.07±2.33 42.22±1.51球蛋白(g/L) 29.44±9.65 29.10±4.73 25.73±5.14 25.30±5.89总胆红素(μmol/L) 41.79±35.80 53.45±11.11 36.68±10.53 32.40±12.03葡萄糖(mmol/L) 11.49±7.48 12.43±9.89 7.33±2.05 7.72±0.65胆固醇(mmol/L) 1.33±0.71 1.49±0.55 0.93±0.45 1.23±0.66三酰甘油(mmol/L) 0.99±0.15 1.03±0.30 0.83±0.18 1.07±0.31 K(mmol/L) 6.31±1.92 5.73±0.83 6.50±1.09 4.66±1.29 Na(mmol/L) 126.29±1.50 126.83±1.33 125.17±1.17 125.80±1.79 Cl(mmol/L) 137.57±37.87 145.17±38.05 151.33±40.14 138.00±50.08 Ca(mmol/L) 3.16±0.21 3.17±0.20 3.25±0.24 3.01±0.27 P(mmol/L) 2.29±0.72 2.15±0.26 2.24±0.34 2.20±0.47
总之,3D 打印多孔钽是生物医学领域有前景的材料,具有良好的生物相容性,本研究为3D 打印多孔钽在外科植入领域的安全应用提供了科学依据。
