基于代谢组学研究高脂诱导MAFLD模型大鼠血清脂质特征
2022-05-26宋素菲赵冬梅白凤媛郑继贤徐秋玲
宋素菲,赵冬梅,白凤媛,孙 涛,郑继贤,徐秋玲,刘 涛
0 引 言
代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD),曾用名非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD),是基于代谢功能障碍的肝细胞脂肪变性[1],是目前最常见的慢性肝病[2]。研究表明MAFLD的全球患病率为25.24%[3],中国MAFLD的流行率为29.6%[4],至2030年中国将成为全球MAFLD患病率增幅最大的国家[5]。MAFLD已成为一个全球性的公共健康问题[6],极大加重社会负担。
代谢组学广泛应用于疾病的诊断、生物标记的表达以及生理和病理生理过程的阐明[7]。本研究采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(ultra-high performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution tandem mass spectrometry, UHPLC-QE-MS)非靶标代谢组学技术,进一步分析MAFLD模型大鼠血清脂质代谢标志物。
1 材料与方法
1.1 实验材料
1.1.1 动物12只SPF级雄性SD大鼠,体重均为(180±20)g,购自长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019-0013。饲养于海南医学院SPF级动物实验室,室内温度和湿度分别保持在22℃和50%,自由饮食水。
1.1.2试剂甲醇(CAS 号67-56-1)、乙腈(CAS号75-05-8)、乙酸铵(CAS号631-61-8)、氨水(CAS号1336-21-6),均购自德国CNW 技术公司;超纯水(屈臣氏),油红O染色液购自珠海贝索生物公司。
1.1.3仪器超高效液相色谱仪、高分辨质谱、离心机(美国Thermo Fisher Scientific公司),天平(德国Sartorius公司),超声仪(深圳市雷德邦电子有限公司)。
1.2方法
1.2.1 MAFLD模型大鼠的建立12只SD雄性大鼠正常喂养1周,按照随机数字表法分为正常组和模型组各6只;正常组予普通饲料喂养;模型组予高脂饲料喂养,高脂饲料由20%猪油、4%白糖、 2%奶粉、1% 胆固醇以及73 %普通饲料配制。4周成功建立MAFLD模型。
1.2.2取材造模完成后,按4 mL/kg给予1%的戊巴比妥钠深度麻醉大鼠,取其腹主动脉血,静置30 min,4 ℃ ,离心半径15 cm、3000 r/min离心10 min,将上清液分装至EP管,放置-80 ℃超低温冰箱中保存。取肝左叶石蜡包埋、切片。
1.2.3肝组织油红O染色准备好肝组织冰冻切片,严格按照试剂盒说明书进行油红O染色,显微镜下观察。
1.2.4样品的制备与提取4 ℃解冻血清样品,取100 μL血清样品和400 μL提取液[甲醇∶乙腈=1∶1(V/V)],含同位素标记内标混合物)在EP管混合并涡旋30 s混匀,置于冰水浴中超声10 min,-40 ℃低温静置1 h,4 ℃,离心半径8.6 cm、12 000 r/min离心15 min,取等体积样品上清和质控(QC)样品转入UHPLC/MS小瓶中上机检测[8-11]。
1.2.5UHPLC-QE-MS条件色谱条件使用Agilent 1290 (Agilent Technologies)超高效液相色谱仪,通过Waters ACQUITY UPLC BEH Amide (2.1 mm × 100 mm, 1.7μm)液相色谱柱对血清样品进行色谱分离。液相色谱A相为水相(25 mmol/L乙酸铵+25 mmol/L氨水),B相为乙腈。采用梯度洗脱方式进行洗脱:0~0.5 min, 95% B; 0.5~7 min, 95%~65% B; 7~8 min, 65%~40% B; 8~9 min, 40% B; 9~9.1 min, 40%~95% B; 9.1~12 min, 95% B。流动相流速:0.5 mL/min,柱温30 ℃,样品盘温度4 ℃,进样量为3 μL[12]。
质谱条件Thermo Q Exactive HFX质谱仪通过控制软件(Xcalibur,Thermo)采集数据。参数设置为鞘气体的流速为50 Arb,辅助气体的流速为10 Arb,毛细管的温度320 ℃,Full MS分辨率为60 000,MS/MS分辨率为7500,NCE模式下碰撞能量为10/30/60,电离源为电喷雾电离,喷雾电压:3500V(+),3200V(-)。
1.2.6数据提取和处理原始数据经ProteoWizard软件转为mzXML格式,导入自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分归一化等处理,并且在BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释[13]。使用SIMCA16.0.2软件对最终的数据进行多元统计分析。
1.2.7数据分析利用主成分分析(PCA)观察组内的总体分布和组间的分散程度,进一步采用有监督的正交偏最小二乘法-判别分析(OPLS-DA),过滤与分类变量不相关的正交变量,最大化组间代谢物的分离,投影值大于1的变量(VIP>1)被视为差异变量。同时为检验OPLS-DA模型是否过度模拟和耦合以及评估模型的统计显著性,对数据模型进行多次置换检验(n=200)验证。本研究筛选潜在差异代谢物的条件设置为VIP>1、P<0.05,将潜在差异代谢物并导入MetaboAnalyst 5.0数据库进行血清脂质富集分析。
2 结 果
2.1 病理结果分析油红O染色结果显示,正常组大鼠肝细胞形态正常,界限清晰,细胞核呈蓝色,细胞内未见红色脂滴生成;模型组大鼠肝细胞形态肿胀,细胞间界限模糊,细胞质内可见大量大小不等的红色脂滴。见图1。
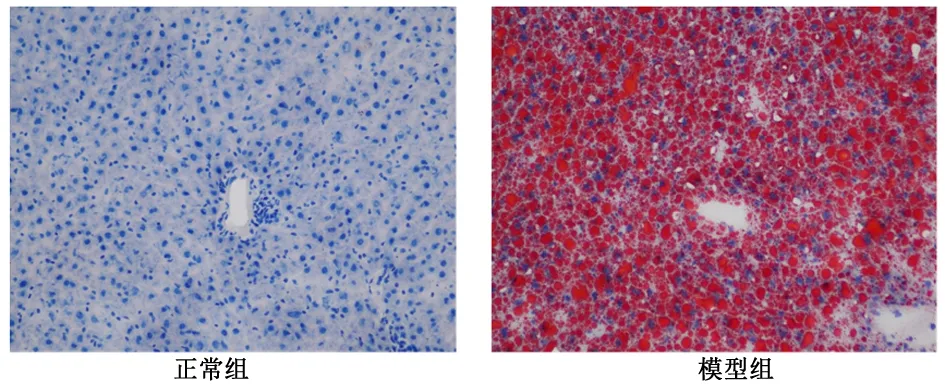
图 1 光学显微镜下观察大鼠肝脏脂肪沉积情况(油红O染色 ×200)
2.2多元统计学分析通过UPLC-QE-MS进行血清样品的分离和数据采集,发现两组样品的血清代谢物相似,但含量存在一定差异。PCA结果显示正常组和模型组的代谢物出现明显分离的趋势, 表明两组之间的代谢物存在差异,见图2。OPLS-DA结果显示正负离子模式的正常组和模型组代谢物各自分布于一侧,完全分离,表明两组存在明显的差异,血清代谢轮廓发生改变。OPLS-DA模型验证结果显示正负离子模式下的R2全部在Q2之上,且Q2的回归直线与纵轴Y的截距分别为-0.4和-0.48,表明模型不存在过拟合的现象,模型的建立是有效可靠的,见图3。
2.3血清潜在差异代谢物筛选正负离子模式下共筛选出743种潜在差异代谢物,图4结果显示有85个潜在差异代谢物的相对表达量明显改变。与正常组相比,模型组共有11个代谢物表达增加,74个代谢物表达降低。
2.4潜在差异代谢物的脂质富集分析将83个潜在差异代谢物代入Metaboanalyst5.0进行脂类富集分析。共有43个脂质差异代谢物的相对表达量发生改变,富集到7类脂类物质,其中脂肪酸类、固醇脂类和甘油磷脂类显著富集(P<0.05),见图5。与其相关的主要脂质差异代谢物及倍数变化(Fold change,FC)为:①脂肪酸类:十八烷酸(FC=1.25)、二十碳五烯酸(FC=0.38)和异丁酸(FC=0.34);②固醇脂类:异脱氧胆酸(FC=0.14)、脱氧胆酸(FC=0.44)和牛磺去氧胆酸(FC=0.13);③与甘油磷脂类主要脂质差异代谢物为PC(22:2(13Z,16Z)/15:0)(FC=0.21)、PC(22:6(4Z,7Z,10Z,13Z,16Z,19Z)/20:2(11Z,14Z))(FC=0.22)以及LysoPC(16:1(9Z)/0:0)(FC=0.42)等。

a:正离子;b:负离子

图 3 各组血清代谢组数据OPLS-DA 得分图及模型验证图
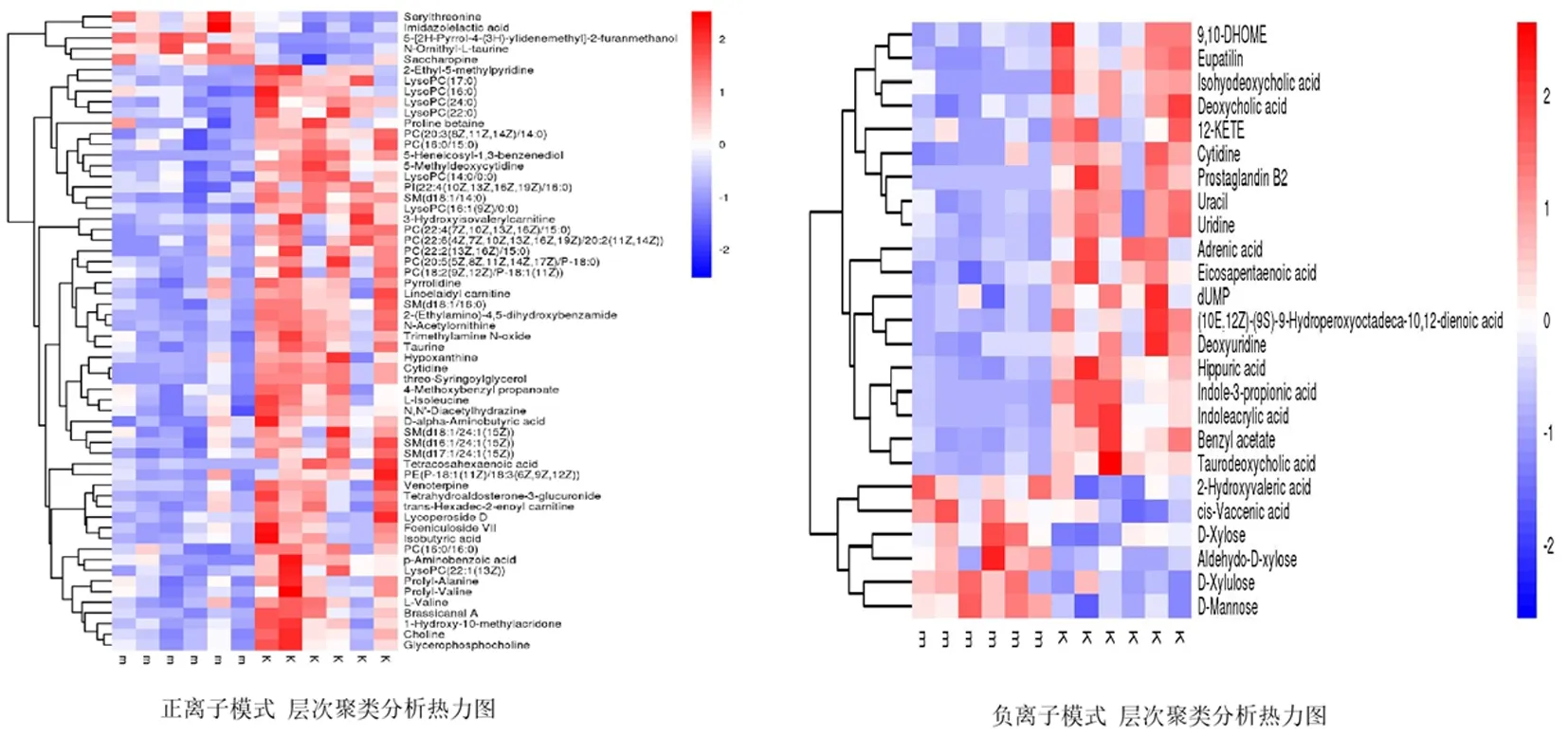
图 4 各组差异代谢物层次聚类分析热力图
3 讨 论
近年来,代谢组学以系统性、动态性、高灵敏度和高通量等特点,对代谢产物进行定性定量分析,反映生物体的某一特定时期整体的代谢变化,被广泛应用在医学及生物等各学科领域。UHPLC分离时间不超过10min,QE-MS可以在正负模式之间快速切换,能够使用单一方法以相对快速的周期时间进行代谢物定性定量实验[14]。
肝是脂质代谢的主要场所,负责调控脂质获取和输出之间的稳态平衡。当肝内的脂质生成大于利用时,其动态平衡被打破,脂滴在肝细胞内蓄积,导致脂肪肝发生[15-16]。本研究发现MAFLD血清中脂肪酸类、固醇脂类、甘油磷脂类变化显著。
脂肪酸:二十碳五烯酸是ω-3多不饱和脂肪酸,与代谢相关性疾病密切相关[17]。二十碳五烯酸能够提高线粒体氧化能力,减少脂质积聚,同时维持氧化还原平衡,避免氧化应激[18]。研究表明二十碳五烯酸可以降低高碳水化合物饮食的啮齿动物的体重以及甘油三酯水平,缓解葡萄糖耐量受损、胰岛素抵抗以及高胰岛素血症等不良症状[19]。异丁酸是短链饱和脂肪酸,短链脂肪酸调控肝脏中脂质和能量代谢的关键调控因子AMPK和PPAR家族基因的表达[20]。十八碳烯酸是不饱和脂肪酸,Notarnicola等[21]研究发现十八碳烯酸在MAFLD中呈高水平表达,且与肝细胞受损程度呈正比。本研究发现,与正常组相比,模型组大鼠的二十碳烯五烯酸、异丁酸等含量均明显下降,2-羟基戊酸、十八碳烯酸表达上升,与脂肪酸的合成代谢失调相关,造成肝脏脂肪变性和脂肪储积。
固醇脂类:异脱氧胆酸、脱氧胆酸和牛磺去氧胆酸都是次级胆汁酸。“肠-肝循环”是胆汁酸代谢的重要途径,而MAFLD的发生会导致肠道黏膜屏障受损[22]。初级胆汁酸由肝内胆固醇直接生成,在肠道内依赖肠道菌群催化生成次级胆汁酸[23]。刘凯利等[24]通过提高MAFLD大鼠体内次级胆汁酸含量,激活法尼醇X受体信号表达,改善MAFLD大鼠肝脏的脂肪变性。此外,MAFLD的发展和次级胆汁酸与初级胆汁酸的比例相关,He等[25]研究发现增加次级胆汁酸与初级胆汁酸的比值可以有效改善小鼠NASH小鼠的纤维化症状。本研究显示模型组异脱氧胆酸、脱氧胆酸、牛磺去氧胆酸含量均降低,可能与MAFLD胆汁酸代谢失调有关。
甘油磷脂类:本研究发现模型组PC(16:0/16:0)、LysoPC(16:0)以及LysoPC(14:0/0:0)表达较正常组均降低。甘油磷脂(glycerophospholipid,GPL)是生物体最重要的生物膜成分。GPL与胆碱结合生成磷脂酰胆碱(phosphatidylcholine, PC)。PC是细胞膜的组成成分,参与包装和出口VLDL。PC生物合成减少,VLDL的合成和分泌受到抑制,肝脏新生脂肪的合成增加,导致肝脏脂质沉积[26]。PC在磷脂酶A2的催化下生成溶血磷脂酰胆碱(lysophosphatidylcholine,LysoPCs)[27],LysoPCs是构成甘油磷脂最重要的成分,它的水平与MAFLD密切相关[28]。LysoPCs含量明显下降,导致甘油磷脂含量下降,脂蛋白合成不足,肝脏合成的甘油三酯不能及时输出肝外,导致肝脂肪变性和炎症。
本研究采用UHPLC-QE-MS非靶标代谢组学技术对高脂诱导MAFLD模型大鼠血清差异代谢物进行脂类富集分析,发现脂肪酸类、固醇脂类、甘油磷脂类、有机酸、聚酮化合物、鞘脂类以及脂类和类脂分子7类脂类物质的含量发生明显改变,其中脂肪酸类、固醇脂类和甘油磷脂类改变最为显著,表明在MAFLD的发生初始阶段,肝细胞脂肪变性和脂肪储积可能与脂肪酸类、固醇脂类和甘油磷脂类含量变化密切相关。
