肝素结合蛋白对脓毒症患者急性肾损伤的预测价值
2022-05-26朱洪伍梁继芳武卫东闫新明
朱洪伍,梁继芳,武卫东,闫新明
(山西医科大学第三医院·山西白求恩医院·山西医学科学院·同济山西医院急诊科,太原030032)
脓毒症是感染引起宿主反应失调、导致危及生命的器官功能障碍综合征[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症的严重并发症之一,研究表明,脓毒症患者AKI的病死率明显高于单纯脓毒症患者[2,3]。因此,早期诊断AKI,及时进行肾脏保护是非常必要的。就目前来说临床上常用尿量和血肌酐进行急性肾损伤的诊断和分级[4],然而这两种指标均具有局限性,不能很好地反应肾脏情况[5]。因此,有必要寻找一种准确、灵敏的指标用来预测和诊断脓毒症患者AKI的发生。肝素结合蛋白(heparin-binding protein,HBP)作为一种炎症介质,不仅能够在早期预测脓毒症的发生,而且还可以引起肾小管上皮细胞炎症反应和管周血管发生渗漏,引起肾功能损伤[6,7]。本研究探讨了脓毒症患者入院时HBP对发生AKI的预测价值,旨在较早预测脓毒症患者急性肾损伤的发生,早期干预治疗,降低死亡率。
1 对象与方法
1.1 研究对象
收集2020年5月至2021年5月就诊于山西医科大学第三医院急诊科70例脓毒症患者的临床资料,根据入院时是否并发AKI,分为AKI组(41例)和非AKI组(29例)。其中男性36例,女性31例,年龄27~88(62±16)岁。纳入标准:(1)符合《第3次脓毒症和脓毒性休克定义国际共识(sepsis-3)》[8]对脓毒症的诊断标准;(2)2012年改善全球肾脏病预后组织发布的AKI临床诊疗指南诊断标准[4]。排除标准:(1)既往有慢性肾脏疾病或肾移植史;(2)患者在就诊前1周有造影剂检查,或肾毒性药物的应用;(3)既往患有恶行肿瘤、血液系统疾病及自身免疫性疾病等;(4)入院前已行连续肾脏替代疗法(continuous renal replacement therapy,CRRT)治疗;(5)入院前使用激素类药物;(6)孕妇及儿童;(7)年龄<18岁。本研究符合医学伦理学标准,并获得医院伦理委员会的批准。所有检查和治疗均获患者或家属知情同意。
1.2 方法
利用我院电子病历系统,根据纳入和排除标准确定纳入案例,采集患者相关信息。(1)基本信息:性别和年龄;(2)统计数据:患者入院时的HBP、急性生理与慢性健康评分(acute physiology and chronic health evaluationⅡ,APACHE Ⅱ)、脓毒症相关序贯器官衰竭评分(sequential organ failure assessment,SOFA)、白细胞(white blood cell,WBC)总数、中性粒细胞(neutrophils,Neut)数、降钙素原(procalcitonin,PCT)、血乳酸(lactic acid,Lac)、血肌酐(serum creatinine,SCr)、估算肾小球滤过率(estimated glomerular fitration rate,eGFR)。
1.3 统计学处理
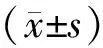
2 结 果
2.1 2组患者临床资料比较
2组患者性别、年龄、Lac、WBC及Neut比较,差异均无统计学意义(均P>0.05)。AKI组的HBP、SCr、APACHE Ⅱ评分、SOFA评分及PCT均高于非AKI组(均P<0.05);而eGFR低于非AKI组(P<0.05;表1)。
2.2 HBP与其他临床资料的相关性分析
患者入院时HBP与其他临床资料的相关性分析:HBP与SCr、APACHE Ⅱ评分、SOFA评分及PCT呈正相关(P<0.05);而与eGFR呈负相关(P<0.001);与年龄、Lac、WBC及Neut数均无明显相关性(P>0.05;表2)。
2.3 脓毒症患者发生AKI的logistic回归分析
单因素logistic回归分析显示,入院时HBP、血肌酐、eGFR、APACHEⅡ评分、SOFA评分、PCT与脓毒症患者发生AKI有关。将上述变量进一步纳入多因素logistic回归分析示:HBP与SOFA评分为脓毒症AKI的独立危险因素,HBP指标每增加1,AKI的发病风险增加0.018倍;SOFA评分每增加1,AKI的发病风险增加0.361倍(表3)。
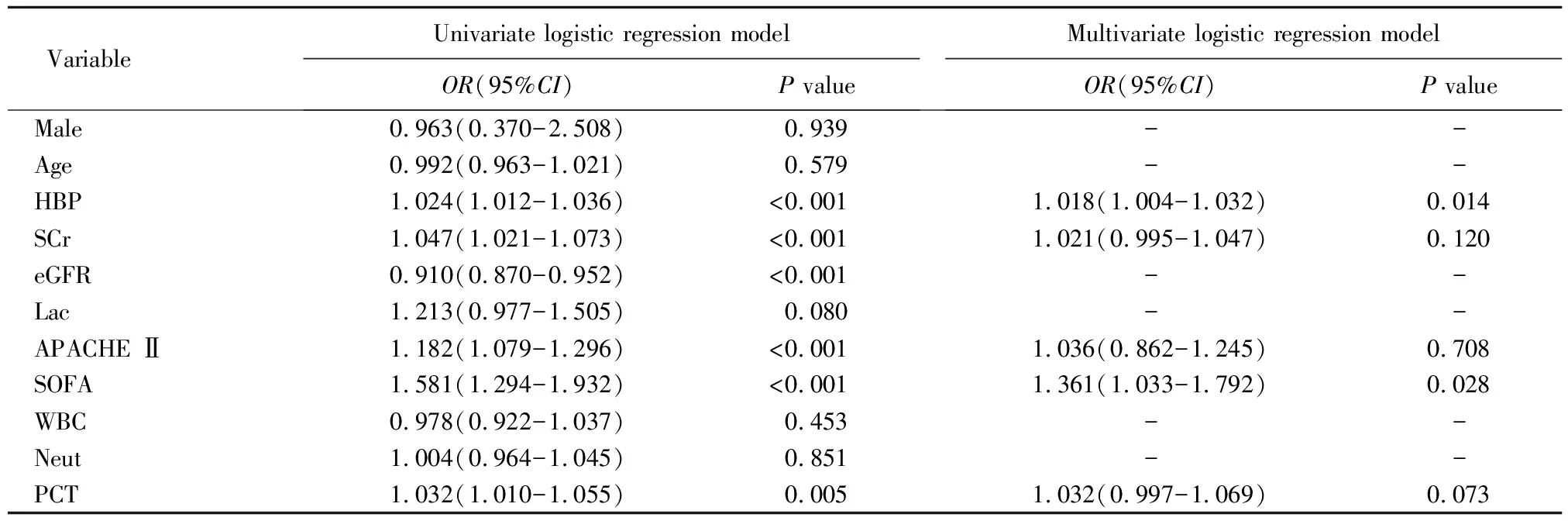
表3 Logistic回归模型参数估计结果Table 3 Logistic regression model parameter estimation results
2.4 ROC曲线分析指标对AKI的预测效能
HBP和SOFA评分预测脓毒症发生AKI的ROC曲线分析结果显示:HBP可作为脓毒症患者AKI的预测指标,其AUC为0.874,最佳截断点为79.895,灵敏度为92.7%,特异度为72.4%;SOFA评分的AUC为0.913,最佳截断点为9.500,灵敏度为95.1%,特异度为79.3%(表4,图1)。

表4 多指标对脓毒症患者AKI预后评估价值Table 4 Evaluation value of multiple indicators for prognosis of patients with sepsis

图1 预测脓毒症患者发生AKI风险的ROC曲线Figure 1 ROC curve for predicting risk of AKI in patients with sepsisAKI: acute kidney injury; ROC: receiver operating characteristic; HBP: heparin-binding protein; SOFA: sequential organ failure assessment.
3 讨 论
目前有研究报道脓毒症相关性肾损伤的发病机制是微循环功能障碍引起的肾脏局部缺血缺氧,此外肾实质炎症细胞浸润、内皮功能障碍等学说也越来越得到重视[9]。而HBP恰好是一种炎症介质和血管渗透剂,诱导急性肾损伤的发生。有文献报道,HBP水平能够评估脓毒症患者器官障碍的严重程度[10]。
健康人血清中HBP浓度很低。当发生细菌感染时,细菌抗原刺激中性粒细胞分泌HBP[11],在脓毒症患者中,78%的患者HBP水平升高,这是疾病进展为脓毒症的一个强有力的预测因子[12,13],并且HBP作为一种急性时相蛋白,对脓毒症的诊断比其他细胞因子更准确[14]。Li等[15]在动物模型中发现,HBP在脓毒症诱导的AKI相关的初始炎症反应中发挥重要作用。Fisher等[6]通过临床研究发现,脓毒症合并AKI患者基线中位血浆HBP水平(38.9 μg/L)高于脓毒症未合并AKI患者(9.5 μg/L)。Tverring等[7]不仅认为HBP诱导肾小管上皮细胞发生炎症反应,进而导致AKI的发生,他还通过对511例严重脓毒症或脓毒性休克患者研究发现,发生AKI 2~3期者基线中位血浆HBP水平明显高于未发生AKI者,且HBP可有效预测脓毒症相关AKI的发生。因此我们推测HBP与脓毒症患者发生AKI有关,但目前国内相关研究较少。
本研究回顾性分析脓毒症患者的临床资料,将其分为AKI组与非AKI组,将2组患者的临床资料进行比较发现,与非AKI组相比,AKI组患者的HBP、SCr、APACHE Ⅱ评分、SOFA评分、PCT指标,均高于未发生AKI组患者,差异均有统计学意义。为了进一步明确HBP与其他指标的关系,经Spearman相关法分析得出HBP与SCr、APACHE Ⅱ评分、SOFA评分、PCT呈正相关;而与eGFR呈负相关。Xue等[16]也发现HBP与血肌酐呈正相关,监测HBP可用来预测新冠肺炎继发的多器官损伤,这也为HBP与脓毒症引起的其他器官功能障碍的相关性提出指引。logistic回归分析显示HBP和SOFA评分是脓毒症患者AKI的危险因素,且通过ROC曲线分析发现,HBP与SOFA评分均能作为预测脓毒症发生AKI的指标。然而SOFA评分过程较复杂,需要综合评估呼吸、循环、肝脏、肾脏等情况,才能判断发病时的器官功能障碍[17]。而HBP作为单一指标,与SOFA评分的灵敏度和特异度相差不大,只需简单检测即可快速评估患者器官功能状态。
综上,HBP可作为预测脓毒症患者AKI的危险因素,对临床判断脓毒症患者的病情及预后的改善具有一定意义。本研究的缺点是病例相对较少,需要增加样本量减少误差。同时,患者可能不会第一时间到我院就诊,造成数据采集的时间偏差。各参数的计算结果都受到一些处理因素的干扰。
