UV-B辐射和施氮对满江红生长、矿质营养和抗氧化生理的影响
2022-05-25杨竞张光群李明锐湛方栋李元祖艳群何永美
杨竞,张光群,李明锐,湛方栋,李元,祖艳群,何永美
(云南农业大学资源与环境学院,昆明 650201)
臭氧衰减导致的地表UV-B 辐射(280~315 nm)增强是当今重大的全球气候变化问题之一[1]。UV-B辐射作为重要的环境因子之一,会诱导植物产生大量活性氧自由基(ROS),显著降低植物叶片光合色素含量、改变植株矿质营养含量、抑制抗氧化酶活性、阻碍抗氧化物质合成、导致植株生物量下降[2]。在一定范围内,植物启动自身的防御机制,通过提高超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽还原酶(GR)等抗氧化酶活性[3]、增加酚类、类黄酮等抗氧化物质含量来提高植物抗性[4],以缓解UV-B的损伤[5-6]。氮素是植物生长发育的主要限制因子,施氮可提高植物抗性,也可改变植物对UV-B 辐射增强的响应[7-8]。因此,研究UV-B 辐射和施氮对植物的影响显得尤为重要,目前的研究主要集中在谷子、白菜、菠菜、藻类[9-10]等,对固氮植物满江红的相关研究报道较少。
满江红(Azolla imbricata)是蕨藻共生体,其生物量大、固氮量高,作为生物绿肥被广泛使用[11]。满江红体内的固氮蓝细菌(Cyanobacterium)通过固氮酶将氮气转化为可被利用的氨,供植物生长发育,植物固氮酶极易被氧化,其活性直接决定着满江红的供氮能力[12-13],显著影响满江红参与稻田氮循环[14]。云南元阳梯田紫外辐射背景值高,梯田不施加化肥,依靠满江红等还田维持稻田氮循环[15],这为研究UV-B 辐射和氮素复合作用的影响提供上佳的试验材料。因此,以元阳梯田稻田满江红为研究材料,UV-B 辐射和氮素作为影响因素,在项目组前期研究的基础上,基于元阳梯田的地域特点,研究UV-B 辐射和施氮单独及复合作用对满江红生长、矿质营养和抗氧化生理的影响,为认识元阳梯田满江红对UV-B 辐射与氮素养分的生理响应特征提供科学依据。
1 材料与方法
1.1 试验材料
选取云南元阳梯田水稻生长期(5—6 月)自然漂浮生长的满江红植株,带回试验室用蒸馏水冲洗数次,去除表面多余泥土和杂质,备用。
1.2 试验设计
光源设置:5.0 kJ·m-2UV-B 辐射强度,采用李元等[16]建立的方法在试验小区水面垂直距离40 cm处悬挂UV-B 灯管(光谱为280~315 nm),灯管长1.2 m,间距30 cm。自然光对照组只悬挂灯架不供应灯管。光源和培养液设置见表1,其中氮含量0 g·L-1的处理采用无氮霍格兰营养液[17],氮含量0.06 g·L-1的处理采用30%霍格兰营养液[18]。

表1 试验处理Table 1 Experiment settings
将备用满江红随机接种至矩形塑料培养盆(31 cm×24 cm×11 cm)中连续水培18 d,接种量为水面面积的1/10,约3.0 g,每3 d 定量添加100 mL 蒸馏水补充蒸发量,共4 组处理,每组处理5 个重复,共20 个小区。UV-B辐照时间为9:30—17:30(光暗周期为8 h∶16 h),大棚培养温度(24±4)℃,相对湿度50%~70%。根据预试验结果,在第12 天时,CK 处理满江红长满试验小区水面,因此,统一将采样时间定为第12天。
1.3 生物量测定及生长系数计算
采用鲜质量称量法,每3 d 取出全萍过40 目筛,用纸吸干表面水分后称取鲜质量,称完后放回。按照公式(1)计算生长系数(K)[19]:

式中:W0是初始放萍量,g;W是实际萍体的鲜质量,g;t为间隔天数,d。
1.4 植株矿质营养元素测定
培养12 d 时取样,于105 ℃杀青30 min,70 ℃烘干24 h至恒质量。采用凯氏定氮法测定总氮含量,钼锑抗比色法测定全磷含量,火焰原子吸收分光光度法测定总钙、总镁含量[20]。
1.5 光合色素的测定
取鲜萍2 g 去根洗净,加入95%乙醇5 mL,冰浴研磨至匀浆,转移至离心管。于转速20 000 r·min-1离心10 min。取上清液在分光光度计波长665、649 nm 和470 nm 处测定吸光度。参照文献[20]计算叶绿素a、叶绿素b和类胡萝卜素的含量。
1.6 抗氧化物质和酶的测定
取鲜萍2 g 加入2 mL 的PBS 提取缓冲液[0.04 mol·L-1Na2HPO4,0.06 mol·L-1NaH2PO4,0.1%(V/V)Triton X-100,1 mol·L-1NaCl,10 g·L-1PVPP,pH:7.0],在冰浴中研磨成匀浆。将匀浆移入离心管,另加1 mL的提取缓冲液,清洗研钵后也并入离心管中,混匀后于8 000 r·min-1离心15 min。取上清液置于分光光度计测定过氧化物酶(POD)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)、抗坏血酸(AsA)吸光度,具体波长和计算公式参照南京建成生物工程研究所SOD、POD、MDA、CAT 和总抗氧化能力(FRAP 法)测定试剂盒说明书。
取鲜萍1 g,在冰浴中研磨成匀浆,加入含1%盐酸的甲醇溶液,提取24 h,取0.5 mL提取液,用蒸馏水定容至25 mL,在紫外分光光度计280、325 nm 处测定吸光度,计算总酚含量,在305 nm 处测定吸光度,计算类黄酮含量[21]。
1.7 统计分析
试验结果以平均值±标准差(Mean±SD)来表示,用SPSS 12.0 统计软件对试验数据进行双因素方差分析和最小显著差法(LSD)显著性检验,显著性水平α=0.05。
2 结果与分析
2.1 UV-B辐射和施氮对满江红生长的影响
由图1 可知,以3 g 的初始放萍量记录连续水培18 d 的生长系数的变化。UV-B辐射和N处理导致满江红的生长速率在1~18 d 内均低于CK,在培养6 d 时生长系数最高,9 d 时和12 d 时生长速率无显著差异,18 d 时生长速率最低。CK 处理的满江红平均生长系数为0.102,UV-B+N、UV-B和N处理的平均生长系数低于CK 处理,分别为0.085、0.082 和0.080。UV-B+N、UV-B、N处理在各时期的K值均显著低于CK处理,UV-B+N、UV-B 和N 处理在各时期K值无显著差异。双因素分析表明,UV-B辐射处理、N处理对满江红生长系数有极显著影响,且两者存在交互作用。
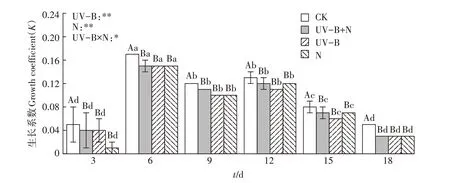
图1 UV-B辐射和施氮对满江红生长系数(K)的影响Figure 1 Effects of UV-B radiation and nitrogen application on growth coefficient(K)of Azolla
由图2 可知,以3 g 的初始放萍量记录连续水培18 d的生物量变化。UV-B+N 处理、UV-B 辐射处理、N 处理在培养18 d 时满江红生物量均显著低于CK,UV-B+N 处理在培养9、12、15、18 d时生物量下降,降幅分别为10.6%、16.8%、22.6%、34.8%。UV-B 处理在9、12、15、18 d 时生物量下降,降幅分别为19.8%、26.7%、27.7%、36.1%。N处理在9、12、15、18 d时生物量下降,降幅分别为19.8%、18.4%、21.3%、30.0%。四组处理均在培养12 d 时生物量最高。UV-B+N、UVB、N 处理在3~18 d 的生物量均显著低于CK 处理,UV-B+N、UV-B 和N 处理在各时期生物量无显著差异。双因素分析表明,UV-B辐射处理、N处理对满江红生物量有极显著影响,且两者存在交互作用。
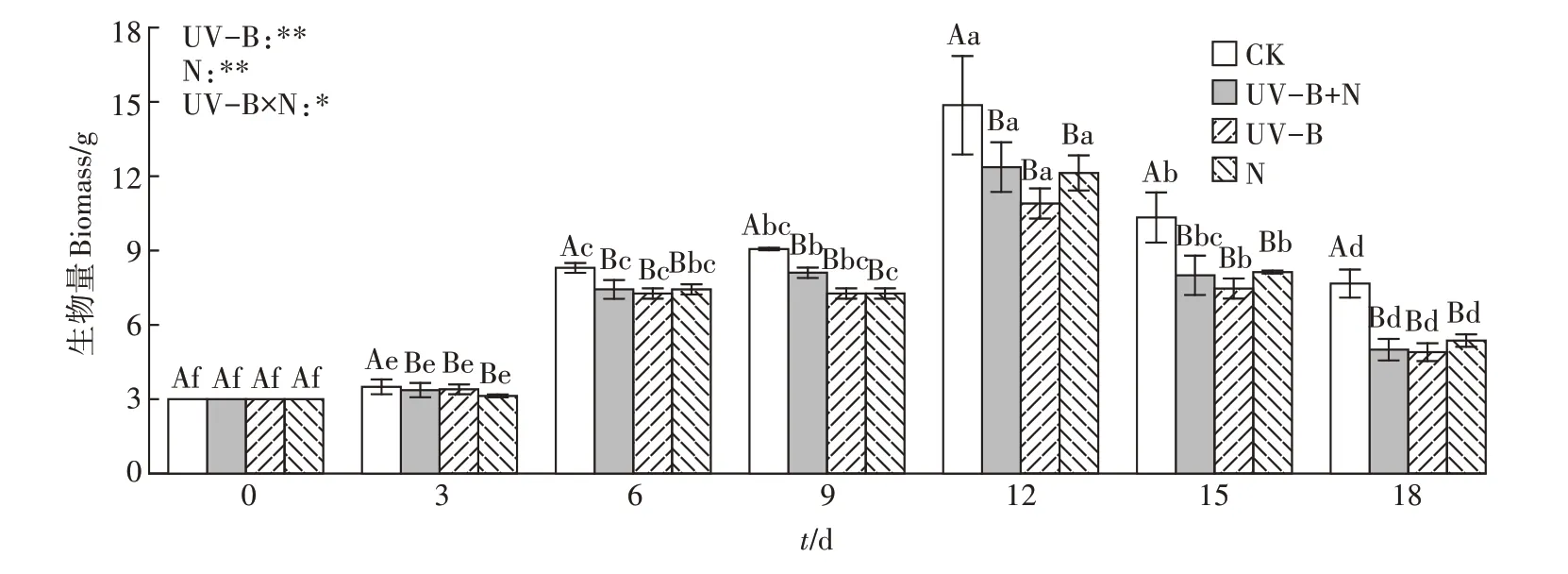
图2 UV-B辐射和施氮对满江红生物量的影响Figure 2 Effects of UV-B radiation and nitrogen application on biomass of Azolla
2.2 UV-B 辐射和施氮对满江红矿质营养元素含量的影响
与CK 相比,UV-B+N、UV-B、N 处理均显著增加了满江红N 含量,增幅分别为156.8%、136.1%、33.7%;UV-B+N 处理和N 处理显著降低满江红的P、Mg、Ca 含量,降幅分别为20.8%、38.5%、37.1% 和4.2%、36.0%、37.5%。双因素分析表明,UV-B、N处理对满江红N、Mg、Ca 含量有极显著影响,且两者存在交互作用。UV-B 处理对K 含量没有显著影响,三组处理均对满江红N含量影响显著,且有交互作用。可知UV-B+N、UV-B 辐射、N 处理均使满江红的N 含量增加,Mg、Ca含量减少(表2)。
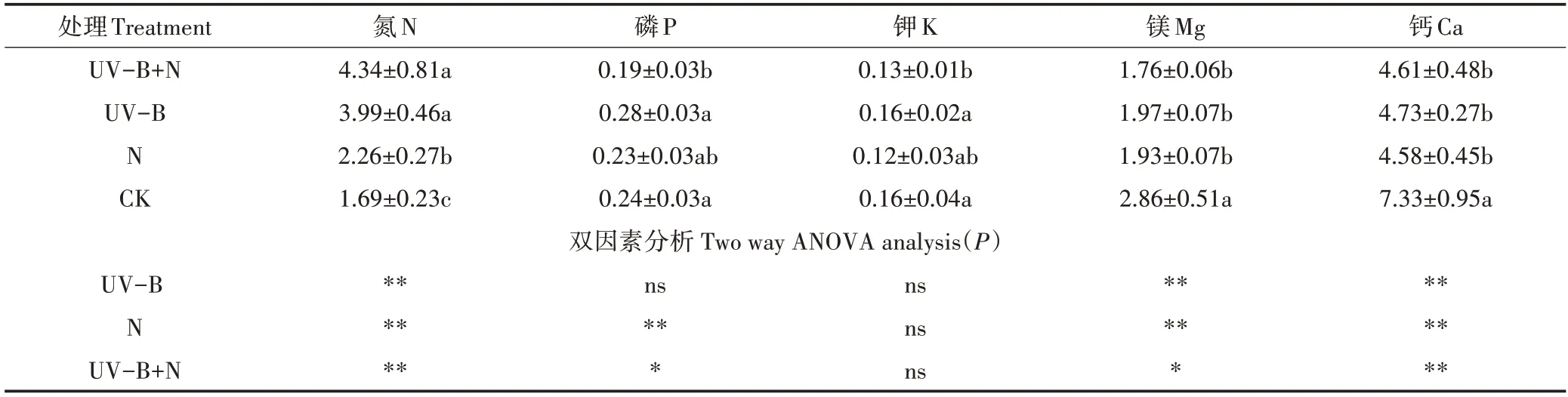
表2 UV-B辐射和施氮对满江红矿质营养元素含量的影响(mg·g-1)Table 2 Effects of UV-B radiation and nitrogen application on the content of nutrients of Azolla(mg·g-1)
2.3 UV-B辐射和施氮对满江红光合色素含量的影响
与CK 相比,UV-B+N 处理显著降低了叶绿素a、类胡萝卜素含量,降幅分别为21.9%、43.6%。UV-B处理显著降低了叶绿素a、叶绿素b、类胡萝卜素含量,降幅分别为21.1%、37.3%、41.0%。N处理显著降低了类胡萝卜素含量,降幅为41.0%。UV-B辐射条件下叶绿素b含量的降幅大于叶绿素a的降幅。双因素方差分析表明,UV-B 处理、N 处理对叶绿素a 和类胡萝卜素含量有极显著影响,且具有交互作用(表3)。
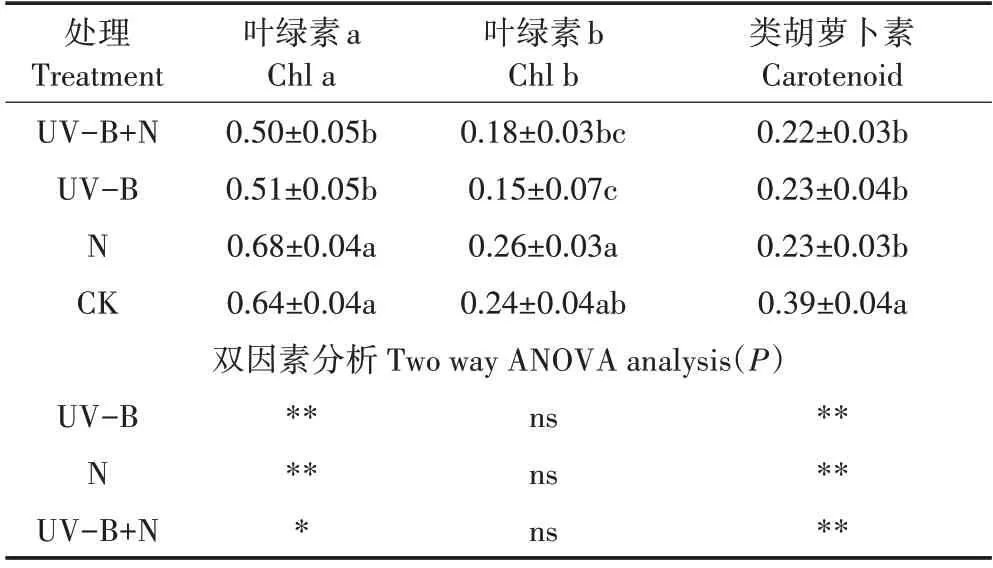
表3 UV-B辐射和施氮对满江红光合色素含量的影响(mg·g-1)Table 3 Effects of UV-B radiation and nitrogen application on photosynthetic pigment content of Azolla(mg·g-1)
2.4 UV-B辐射和施氮对满江红抗氧化物质含量的影响
与CK 相比,UV-B+N 处理显著增加了总酚的含量,增幅为160.2%。UV-B 辐射使满江红总酚和MDA 含量显著增加86.7%、69.5%,使AsA、类黄酮含量显著降低16.6%、57.8%。N 处理显著增加了AsA含量,增幅为14.7%。双因素方差分析表明,UV-B 处理和N 处理对MDA、AsA、类黄酮含量有显著影响,且对总酚、类黄酮含量的影响具有交互作用。三组处理均导致MDA含量显著增加(表4)。
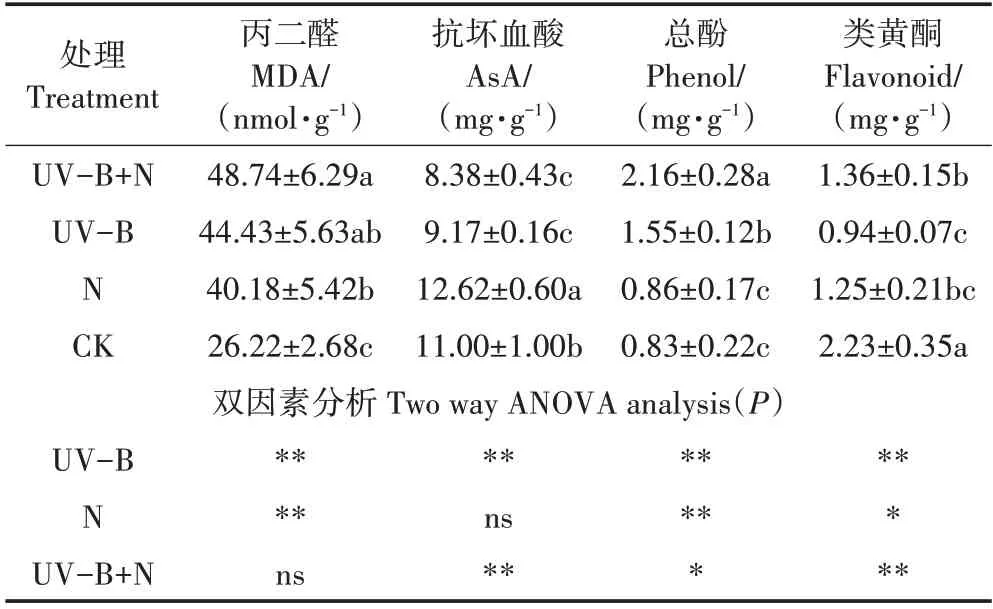
表4 UV-B辐射和施氮对满江红丙二醛与抗氧化物质含量的影响Table 4 Effects of UV-B radiation and nitrogen application on MDA and oxidation product content of Azolla
2.5 UV-B辐射和施氮对满江红抗氧化酶的影响
与CK 相比,UV-B+N、UV-B 辐射、N 处理均显著增加SOD 活性,增幅为164.7%、189.3%、185.0%。POD 活性显著降低,降幅分别为8.17%、30.1%、29.4%,使GR 活性显著增加85.9%、69.5%、53.2%,对CAT 活性无显著影响。UV-B 辐射处理的总抗氧化能力是CK 的3 倍,N 处理使满江红总抗氧化能力显著提升82.1%。双因素方差分析表明,UV-B 处理和N 处理对总抗氧化能力和SOD、POD、GR 活性有显著影响,且具有交互作用(表5)。

表5 UV-B辐射和施氮对满江红抗氧化酶的影响Table 5 Effects of UV-B radiation and nitrogen application on antioxidant enzymes of Azolla
2.6 相关性分析
相关性分析结果(表6)显示,UV-B 辐射和N 处理的满江红生物量与类胡萝卜素、类黄酮含量呈显著正相关,与总氮、总酚含量呈极显著负相关,与MDA含量呈显著负相关。满江红总氮含量与AsA 含量呈极显著负相关,与类黄酮含量呈显著负相关,与MDA、总酚含量呈极显著正相关。满江红总抗氧化能力与AsA含量呈显著负相关,与总酚含量呈极显著正相关。
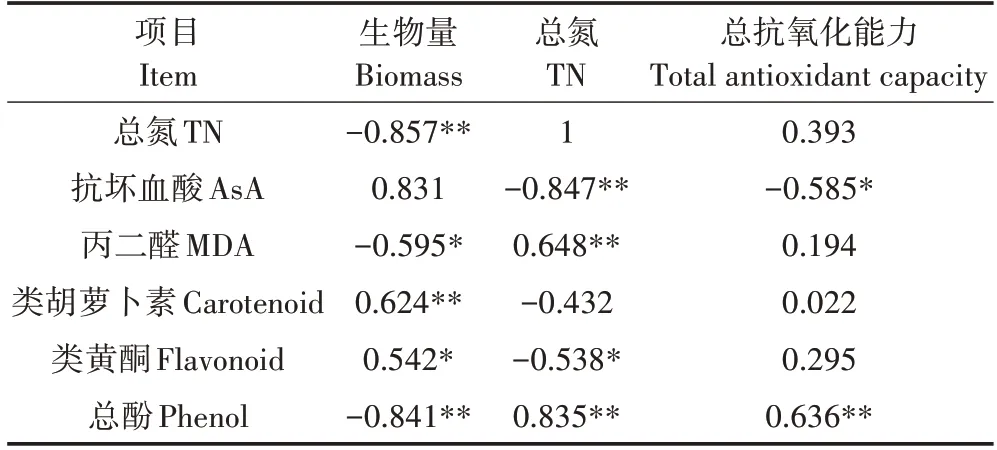
表6 满江红生物量、总氮含量与抗氧化物质及光合色素含量的相关性分析Table 6 Correlation between biomass,total nitrogen,oxidation products and photosynthetic pigment of Azolla
3 讨论
3.1 满江红生长对UV-B辐射响应的机理
生物量是所有生理、生化和生长因子的长期积累响应[2]。UV-B辐射抑制植物的生长发育及生物量[22]。本研究中,UV-B 辐射(5.0 kJ·m-2)处理使满江红的生长速率和生物量都低于对照组,在培养6~12 d 生长速率呈负增长,生长系数下降,表明UV-B 辐射缩短了满江红的生长周期,这与PRASAD 等[23]的研究结果一致。N 处理导致满江红磷、钾含量显著减少,而UV-B 辐射处理与CK 无显著差异,可能施氮会对满江红磷脂、磷酸合成和渗透压调节过程造成不利影响[24],这与试验中观察到的满江红变黄和叶片萎缩的现象一致。UV-B+N、UV-B、N处理均导致满江红钙、镁含量显著减少,这可能是满江红的应激反应,不利于满江红叶绿素的合成。UV-B+N、UV-B、N 处理均导致氮含量显著增加,该结果与大多数研究不同,满江红氮含量与根部吸收作用和生物固氮作用有直接关系,是由于UV-B 辐射和施氮促进了满江红的氮吸收或固氮作用,这与满江红品种以及施氮量和时间有关。根部吸收和生物固氮过程与满江红氮代谢过程有关。
生长在不同氮浓度条件下的植物叶片光合作用对UV-B 辐射的响应程度不同[25],本试验中UV-B、UV-B+N 处理显著减少满江红光合色素含量,N 处理下光合色素含量无显著变化,叶绿素a/b发生变化,使叶绿体的膜发生氧化作用,破坏叶绿体的膜结构[26]。本试验中施氮未能缓解这些损伤,这可能与满江红生育期和UV-B 辐射强度有关。综上,UV-B 辐射导致满江红矿质营养元素含量的变化,使满江红基础生理代谢受阻[27],同时光合作用可能受到抑制,施氮未能缓解UV-B 辐射给植物带来的损伤,最终导致生物量下降。
3.2 满江红抗氧化代谢对UV-B辐射响应的机理
UV-B 辐射对满江红最重要的影响是诱导其产生过量活性氧(ROS)进而损伤质膜。同时,UV-B 辐射也会激活植物体内的两类抗氧化机制[28]:一种是抗坏血酸(AsA)、类胡萝卜素、酮类、酚类等抗氧化物质的非酶促反应,另一种是SOD、CAT、POD 和GR 的酶促反应。这些抗氧化酶和物质相互协调、相互作用,以缓解UV-B辐射给植物带来的损伤[29]。
MDA 是植物过氧化的最终产物之一,它间接反映了生物膜受损伤程度。本研究发现,与CK 相比,UV-B+N、UV-B、N 处理的MDA 含量均显著上升,且与生物量呈显著负相关,与总氮含量呈极显著正相关,这与相关研究结果[30]一致,满江红生物量下降与质膜受损程度有关。本研究中UV-B、UV-B+N 处理导致总酚含量显著增加,这与大多数研究相同,是满江红抗性的表现。而N 处理导致AsA 含量显著增加,AsA 与总氮、总抗氧化能力呈显著负相关,与生物量无显著相关性,AsA 与谷胱甘肽(GSH)、GR 等物质协同作用形成抗坏血酸-谷胱甘肽循环,可以清除ROS,UV-B+N、UV-B、N 处理均导致GR 活性显著增加,GR 能有效维持AsA-GSH 循环,但这不仅需要GR,还需要GSH 底物合成[31]。AsA-GSH 循环过程较复杂,要解释AsA 在N 处理下的含量增加还需进一步对该循环的其他物质和酶进行研究。UV-B+N、UV-B、N 处理均显著减少类黄酮的含量,类黄酮含量与生物量呈显著正相关,与总氮含量显著负相关,这可能是由于UV-B 辐射诱导产生的ROS 超出了满江红活性氧清除能力,对满江红叶片造成了进一步损伤。
SOD在氧化应激防御中起核心作用,其作用是将O2-转化为O2和H2O2,CAT 能催化H2O2,其转化率高,UV-B 辐射对CAT 活性的影响取决于其强度和持续时间[32]。与其他类似研究相同[33],UV-B 辐射和施氮均导致满江红体内SOD、GR 活性提高,SOD 活性的显著增强可能会导致满江红O2-转化为O2和H2O2的转化率过高,部分H2O2可能会在体内累积。与大多数研究不同,本研究中UV-B、N 处理的满江红POD 活性显著下降,可能与满江红POD 对UV-B 辐射的敏感度有关[34]。一方面,UV-B 辐射激发了满江红的抗氧化代谢,使总酚含量显著增加,且施氮增加AsA含量,一定程度提升了满江红抗氧化能力。另一方面,SOD活性的提高程度可能超过了POD、CAT 对H2O2的转化率,导致H2O2累积并造成氧化损伤[35],同时MDA 含量的显著上升也说明满江红受到了氧化损伤。
综上,UV-B 辐射引起了满江红的氧化应激反应,H2O2、-OH 和O2可能在满江红体内累积,UV-B+N处理对两种抗氧化机制都有所激发,总抗氧化能力显著提高;UV-B 辐射提高满江红抗氧化酶活性;施氮增加AsA 含量,总抗氧化能力显著增强,植物抗性增强;UV-B+N、UV-B、N处理可能均导致满江红质膜不同程度的损伤,而满江红抗氧化物质的含量增加利于其对生物量的累积,抗氧化酶活性的提高有利于其总抗氧化能力增强。满江红总氮含量与MDA 含量显著正相关,推测满江红的氮累积可能是由浓缩效应造成的。UV-B 辐射增强和施氮对满江红抗氧化机制的影响较复杂,还需进一步研究。
4 结论
(1)UV-B 辐射和施氮处理均显著增加满江红氮含量,均显著降低钙、镁含量,对钾含量无显著影响。UV-B 辐射和UV-B 辐射+施氮处理使叶绿素a 和类胡萝卜素含量显著下降。
(2)UV-B辐射处理使满江红MDA、总酚的含量增加,SOD、GR活性提高。施氮处理显著增加AsA含量,UV-B 辐射、施氮处理均使满江红总抗氧化能力显著提升。
(3)UV-B 辐射和施氮抑制满江红生长速率,降低其生物量,施氮未能缓解因氧化损伤造成的生长速率下降和生物量减少。
