合成MRI联合弥散加权成像及DISCO增强鉴别BI-RADS 4类肿块良恶性
2022-05-25宋美娜王志军
宋美娜,何 花,王志军*,孙 杰,宋 江
(1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院放射科,宁夏 银川 750004)
第5版乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)中,以BI-RADS 4类病变为可疑恶性病变[1]。常规乳腺MR检查主要依据病变的形态学及有限的血流动力学改变进行评估,缺乏客观定量指标,存在一定主观性,尤其对于BI-RADS 4类病变的诊断准确率较低。合成MRI是一种新的MR成像方法[2],可采用多对比度定量图谱MRI(MAGiC)定量评估组织弛豫时间。基于笛卡尔采集的K空间共享三维容积快速动态成像(differential subsampling with cartesian ordering, DISCO)的多期增强技术解决了传统动态增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)中时间分辨率与空间分辨率相互制约的问题。本研究观察合成MRI、弥散加权成像(diffusion weighted imaging, DWI)联合增强DISCO鉴别BI-RADS 4类肿块良、恶性的诊断价值。
1 资料与方法
1.1 一般资料 收集2020年7月—2021年5月79例于宁夏医科大学总医院经穿刺活检或手术病理证实的女性乳腺肿瘤患者,年龄22~78岁,平均(47.9±11.3)岁。纳入标准:①术前MRI诊断为BI-RADS 4类乳腺肿块型病变;②术前常规MRI、MAGiC、DWI及增强DISCO资料完整;③检查前未接受手术、放射、化学及激素等治疗。排除图像质量不佳或无法勾画病变ROI者。79例中,72例为单发、7例为多发乳腺肿块(3例3个、4例2个病灶)。共纳入89个病灶,其中63个恶性病变(恶性组),包括50个非特殊浸润性癌、9个导管原位癌2个乳腺导管内乳头状癌和乳腺浸润性小叶癌、乳腺黏液癌各1个;26个良性病变(良性组),包括15个纤维腺瘤、5个导管内乳头状瘤、2个乳腺腺病及4个炎性病变。
1.2 仪器及方法 采用GE SIGNA Architect 3.0T MR仪行乳腺扫描,配备乳腺专用8通道相控阵线圈。嘱患者俯卧,使双乳自然悬垂于线圈内,双臂置于头部两侧,足先进;扫描参数:常规T1WI,TR 613 ms,TE 7.5/37.3 ms;常规T2WI,TR 4 211 ms,TE 85 ms;DWI,应用单次激发平面回波成像序列,b值为800 mm2/s,TR 2976 ms,TE 72.6/166 ms,层厚5 mm,层间距0.5 mm,矩阵128×140,FOV 320 mm×320 mm;合成MRI(MAGiC序列),TR 4 378 ms,TE 19 ms,层厚5.0 mm,层间距0.5 mm,FOV 320 mm×320 mm,扫描时间4 min 32 s;增强DISCO,TR 3.8 ms,TE 1.3~21 ms,层厚1 mm,层间距0,FOV 320 mm×320 mm,采集1期蒙片后,以流率2.5 ml/s注射对比剂钆双胺注射液(0.1 mmol/kg体质量)并以等量生理盐水冲管,于注射对比剂的同时进行扫描,扫描时相共15期,第1期扫描时间29 s,第2~15期单期35 s。
1.3 图像分析 由具有5~8年乳腺影像学诊断经验的主治及副主任医师各1名共同分析图像,评估各参数值。将DWI导入GE工作站,以READY View 软件自动生成表观弥散系数(apparent diffusion coefficient, ADC)图,参考增强DISCO图像于病变最大层面沿其边缘勾画ROI,避开肉眼可见的液化坏死、出血等区域,测量其ADC。对MAGiC序列原始图像进行后处理并自动生成T1 Mapping、T2 Mapping、PD Mapping、R1 Mapping及R2 Mapping图,参考各序列MRI,分别于显示病变最大层面沿其边缘勾画ROI,测量T1、T2、PD、R1、R2值。对以上参数均重复测量3次,取其均值。采用READY View 软件于增强DISCO图像显示病变最大、增强最明显层面手动勾画ROI,获得时间-强度曲线(time-intensity curve, TIC),测量病变最大径,并依据BI-RADS标准分析其形态、边缘及内部强化特征。
1.4 统计学分析 采用SPSS 26.0统计分析软件。符合正态分布的计量资料采用±s表示,非正态分布者以中位数(上下四分位数)表示,组间比较采用t检验或Mann-WhitneyU检验。计数资料比较采用χ2检验或Fisher精确概率法。针对差异有统计学意义的参数,采用logistic回归分析和受试者工作特征(receiver operating characteristic, ROC)曲线分别评估MAGiC、ADC、DISCO增强参数及三者联合对BI-RADS 4类病变良恶性的诊断效能,计算其曲线下面积(area under the curve, AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 组间一般资料及病变MRI参数 良、恶性组间患者年龄和病变形态、内部强化、TIC、ADC、T2及R2值差异均有统计学意义(P均<0.05),其余参数差异均无统计学意义(P均>0.05)。见表1及图1、2。
2.2 MAGiC、DWI、增强DISCO参数及模型的诊断效能 经logistic回归分析建立了基于MAGiC、DWI、DISCO增强多参数的MAGiC、DISCO、DISCO+ADC、MAGiC+DISCO、MAGiC+ADC及MAGiC+ADC+DISCO模型。ROC曲线显示,各参数中,ADC鉴别良、恶性BI-RADS 4类肿块的AUC最大(0.845);各模型中,以MAGiC+ADC+DISCO模型的AUC最大(0.908)。见表2及图3。
3 讨论
常规MRI诊断形态学征象及TIC重叠较多的BI-RADS 4类乳腺肿块的准确率较低,临床常通过活检明确诊断或直接手术切除,导致部分良性病变患者接受不必要的有创治疗。MAGiC一次扫描可得到5种定量图谱及多种不同对比度图像,同时满足形态学评估和定量评估组织弛豫时间的需要。DISCO技术在保证空间分辨率的同时改进了时间分辨率,可同时获得精准的形态学信息及更优的TIC。综合应用多种MR新技术可为鉴别良、恶性BI-RADS 4类病变提供丰富的形态学、血流动力学及代谢等定量信息,提高诊断准确率。

表1 良、恶性BI-RADS 4类病变患者一般资料及病变MRI参数比较
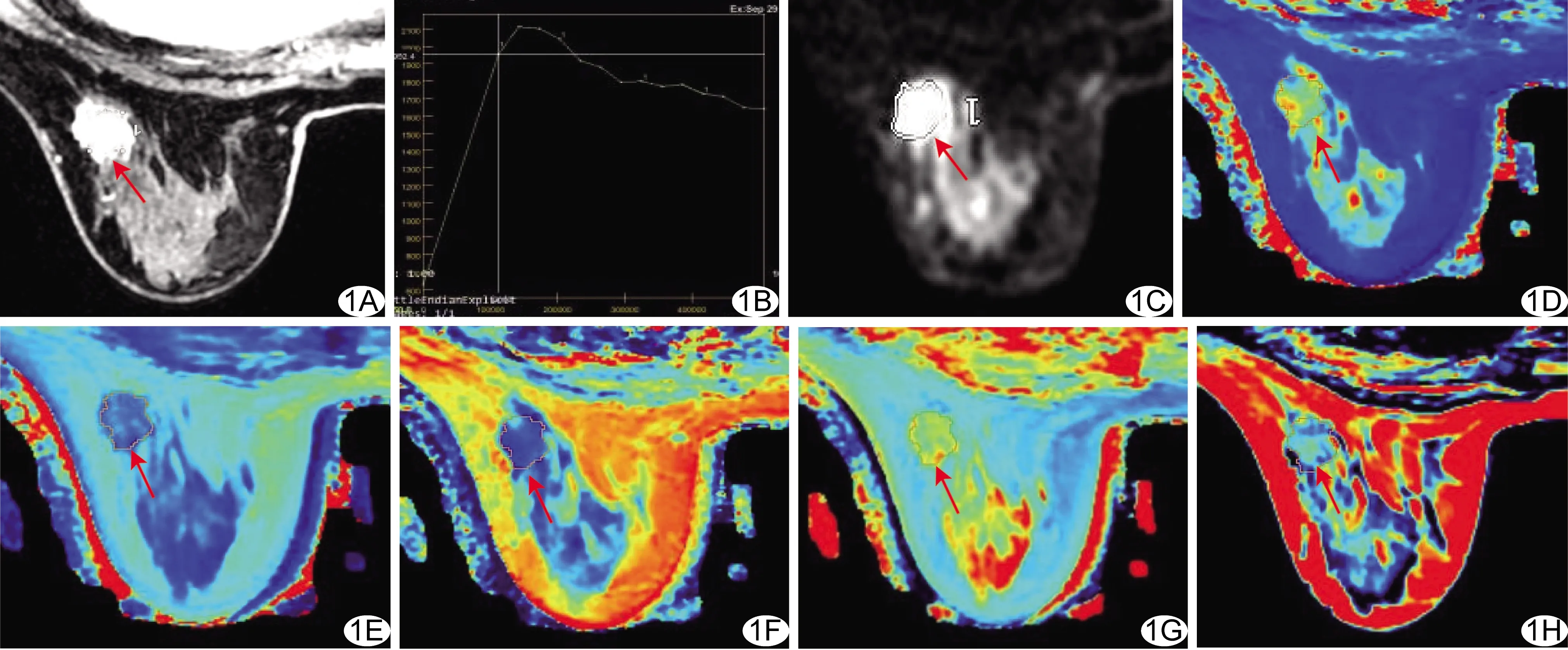
图1 恶性组患者,女,47岁,左乳非特殊型浸润性癌 A.增强DISCO图示左乳外上象限病灶形态不规则,边缘星芒状,强化不均匀; B.TIC呈流出型; C.DWI图示病变弥散受限; D~H.分别为T1 mapping(D)、T2 mapping(E)、R1 mapping(F)、R2 mapping(G)及PD mapping(H)图,病变ADC、T1、T2、R1、R2及PD值分别为0.93×10-3 mm/s、1 348.00 ms、75.67 ms、0.75 s-1、13.28 s-1及74.53 pu (箭示ROI)
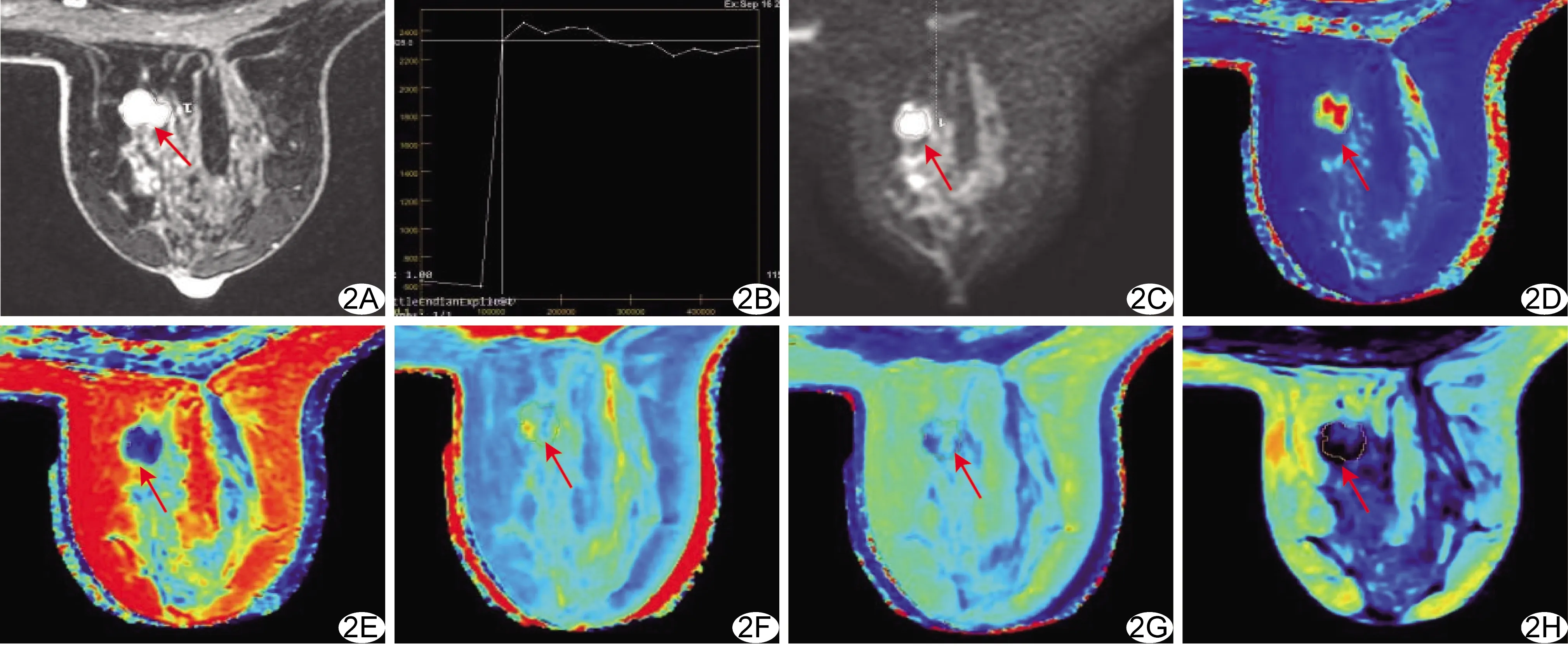
图2 良性组患者,女,42岁,右乳纤维腺瘤 A.DISCO增强图示右乳乳头水平病变边缘不规则,强化不均匀; B.TIC呈平台型; C.DWI图示肿块弥散受限; D~H.分别为T1 mapping(D)、T2 mapping(E)、R1 mapping(F)、R2 mapping(G)及PD mapping(H)图,病变ADC、T1、T2、R1、R2及PD值分别为1.50×10-3 mm/s、2 001.33 ms、97.33 ms、0.52 s-1、7.15 s-1及73.80 pu (箭示ROI)
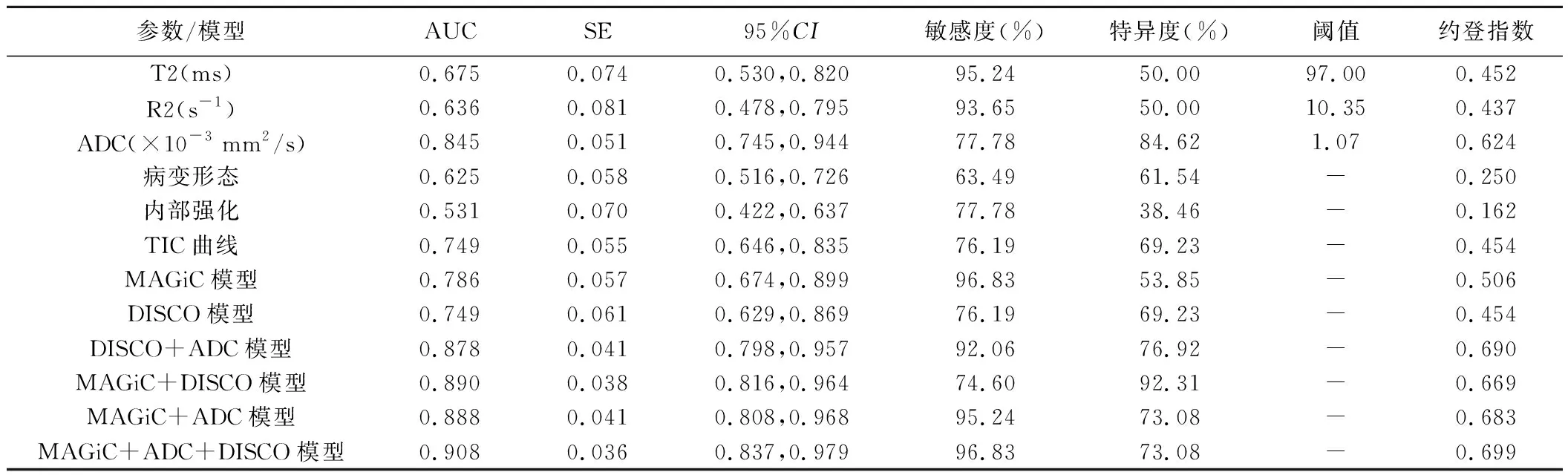
表2 MAGiC、DWI及增强DISCO各参数及模型鉴别乳腺良、恶性BI-RADS 4类肿块的效能
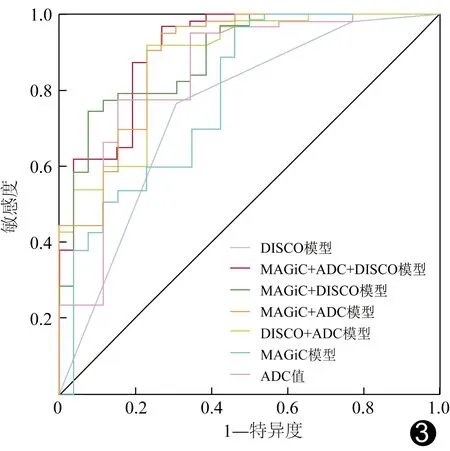
图3 MAGiC、DWI及增强DISCO各参数单独及联合鉴别良、恶性BI-RADS 4类肿块的ROC曲线
MAGiC序列基于多延迟饱和多回波原理,通过直接采集多个回波、多个时间点的信号强度,一次性计算得出T1、T2及其反向弛豫率(R1、R2)和PD值,并获得T1、T2等多种对比图像及定量图谱[3],可在保证图像质量的同时缩短成像时间,使临床应用T1、T2值定量成像成为可能。本研究恶性组T2值(79.67 ms)显著低于良性组(93.50 ms),与LIU等[4]研究结果(82.69 ms及95.48 ms)相近;这是由于弛豫时间受组织含水量影响最大,自由水含量越多,则T2弛豫时间越长[5]。乳腺恶性肿瘤细胞增殖速度快,可因供氧量不足而发生坏死,坏死物质及淋巴细胞/浆细胞浸润细胞间隙,导致细胞外间隙和自由水含量减少;乳腺良性病变生长缓慢,细胞密度相对较小,细胞外间质比恶性病变少,组织自由水较多,故其T2弛豫时间长于恶性病变。GAO等[6]发现,恶性乳腺病变的T2、PD值均显著低于良性病变。车树楠等[7]报道,乳腺良性病变T1值高于恶性病变。本研究T1、R1、PD值组间差异无统计学意义,可能原因是仅针对BI-RADS 4类病变进行分析,有待扩大样本量进一步观察。
R2值为T2的倒数。本研究发现BI-RADS 4类恶性病变R2值高于良性病变;ROC曲线提示T2、R2值鉴别良、恶性BI-RADS 4类病变的敏感度均较高;将T2、R2值纳入logistic回归分析建立的MAGiC模型鉴别良、恶性病变的AUC为0.786,敏感度96.83%,特异度53.85%,提示其具有有一定价值,但单一参数的诊断效能并不理想;分析原因,可能在于乳腺恶性肿瘤具有高度异质性,癌细胞增殖、生长受周围多种基质因子的影响[8],原发灶的肿瘤细胞在不同时间点、同一肿瘤的不同肿瘤细胞之间均存在差异[9],对弛豫时间的影响不同,导致仅以弛豫时间鉴别良、恶性BI-RADS 4类病变的效能不高。
DWI可无创检测活体组织内水分子扩散运动,量化判断病变性质[10]。本研究恶性组ADC明显低于良性组,与文献[11]报道一致,与恶性肿瘤增殖速度快有关:恶性病变组织内细胞密度大,细胞外间隙减小,导致水分子活动受限,ADC降低。ADC鉴别良、恶性BI-RADS 4类病变的AUC为0.845,具有较高效能,但其敏感度和特异度相对较低(77.78%和84.62%)。
同时拥有较高的时间分辨率和空间分辨至关重要。空间分辨率过低会导致小病变无法显示,时间分辨率过低则无法获取病变的强化特征。DISCO技术以K空间随机欠采集与时域复用技术,最大限度地减少时间与空间分辨率的相互制约,得到乳腺病变更精准的形态学特征及TIC[12]。本研究良、恶性组间病变形态、内部强化及TIC差异均有统计学意义;所建立的DISCO模型鉴别良、恶性BI-RADS 4类肿块的AUC为0.749,提示其具有一定鉴别诊断效能;各模型中,MAGIC+ADC+DISCO模型的诊断效能最佳(AUC为0.908)、诊断敏感度较高,而MAGiC+DISCO模型的AUC为0.890、诊断特异度最佳。以上结果表明,联合应用MAGIC、DWI及DISCO增强多参数有助于提高鉴别良、恶性BI-RADS 4类肿块的效能。
本研究的局限性:①仅针对BI-RADS 4类肿块型病变进行分析;②仅评价DISCO形态学特征及半定量曲线,对相关定量参数的诊断效能有待观察。
综上所述,合成MRI、DWI及增强DISCO对鉴别BI-RADS 4类肿块良恶性均具有一定价值;三者联合诊断效能更佳。
