达芬奇机器人与电视胸腔镜手术治疗纵隔肿瘤的临床对比研究
2022-05-25曾锐杜铭*
曾 锐 杜 铭*
(重庆医科大学附属第一医院胸心外科,重庆 400016)
纵隔肿瘤是胸外科常见的疾病之一,包括胸腺 瘤、胸腺癌、胸腺增生、神经源性肿瘤、纵隔囊肿、异位甲状腺、畸胎瘤、淋巴瘤、生殖细胞肿瘤、转移性肿瘤等。因其发病隐匿、缓慢,发病机制尚不明确,通常为胸部影像学检查才能被早期发现,目前处理原则为一经发现尽早处理。临床上治疗纵隔肿瘤的方式包括手术切除治疗、放射治疗、化学药物治疗等,一般首选方案为手术治疗,且早期病变治疗效果较好[1-2]。传统的开放性手术治疗的手术入路及方式众多,手术切口入路主要包括:胸骨正中劈开、胸骨部分劈开、前外侧切口、蛤壳式切口以及半蛤壳式切口等,其胸骨或肋骨连续性遭到破坏,创伤大,出血多,部分肿瘤因瘤体大位置深,术野显露较差,操作困难,手术时间长,术后伤口疼痛明显,术后恢复时间长,围手术期并发症较多等[3]。达芬奇机器人手术系统因其良好的人体工程学体验、高清3D视野、灵活精准、稳定舒适的操纵特点,受到越来越多外科医师的青睐。目前达芬奇机器人手术系统已被广泛应用于胸外科的各种术式,包括肺叶肺段切除术、食管癌根治术以及纵隔肿瘤切除术等[4-5]。我科于2016年6月完成首例达芬奇机器人辅助纵隔肿瘤切除手术,至2021年11月共完成机器人纵隔肿瘤手术66例,为了比较达芬奇机器人手术(RATS)和电视胸腔镜手术(VATS)在纵隔肿瘤治疗中的围手术期疗效和分析二者的安全性,总结本中心微创纵隔肿瘤切除术的经验,现对我科同一医疗组开展的机器人手术系统辅助纵隔肿瘤切除术及胸腔镜辅助纵隔肿瘤切除术的病历资料进行回顾性分析,总结经验报道如下。
1 资料与方法
1.1 临床资料 回顾性分析我院胸外科同一医疗组2015年3月至2021年11月收治的纵隔肿瘤切除术患者的资料。根据手术方式将患者分为两组:达芬奇机器人组(n=66)和普通电视胸腔镜组(n=68)。记录两组患者的年龄、性别、身高、体质量、BMI、瘤体部位、瘤体最大直径、术后病理学类型、手术总时间、术中失血量、术后胸腔引流液总量、胸腔引流管留置时间、术后住院时间、手术并发症等资料,并进行统计分析。纳入标准:①CT检查提示纵隔肿瘤并行手术治疗的患者。②术前检查基本正常,心、肺、肝、肾功能可耐受胸腔全身麻醉手术,无严重合并症,既往无胸部手术病史或明确的结核、脓胸、外伤性血气胸等病史。排除标准:①术中治疗纵隔肿瘤时同期处理与纵隔病变不相关的肺部病灶者。②术前经过放射治疗及化学治疗的患者。③术前营养不良,存在低蛋白血症的患者。
1.2 手术方法
1.2.1 达芬奇机器人组 麻醉方式:常规采用全身麻醉单腔气管插管,辅助人工气胸,使术侧肺稍萎陷,充分显露纵隔病变。体位与手术入路:依据不同的肿瘤位置制定。纵隔肿瘤常规选择前外侧体位,一侧胸部垫高30°~45°,左、右侧入路则根据肿瘤的主体位置决定,若瘤体位于正中,多倾向于右侧入路,少部分前纵隔病变选择剑突下入路(胸部垫高平卧位)。为避免术侧上肢对机器人机械臂的干扰,常将其外展显露腋窝固定于头侧麻醉架附近。机器人切口常规选择:机器人镜孔(患侧腋中线第5肋间),操作臂孔(患侧腋前线第3肋间),操作臂孔(患侧锁骨中线第5肋间)。除此之外,根据纵隔肿瘤部位及大小可适当调整切口的位置、体位等,部分手术根据需要增加1个辅助操作孔,主要原则是切口朝向肿瘤、三角分布打孔,左右操作臂孔、镜孔距离一掌以上,并适当放宽机械臂大臂间距,避免机械臂相互干扰。剑突下路径常采用三切口法,即选择剑突下长3 cm左右的切口为主镜孔,于左右侧锁骨中线与肋骨下缘交点制作机械臂切口。机器人手术流程:手术切口标识画好后,常规消毒铺巾,置入Trocar,连接气腹机,将二氧化碳气体充入术侧胸腔,一般选择人工气胸压力维持在8~10 mm Hg左右。手持镜头探查胸腔,观察胸腔有无粘连、病变大小及位置,与邻近组织结构关系等。安装机械臂,主刀为右利手,一般左臂安装心包抓钳,右臂根据需要常选择单极电凝钩、双极电凝钩(马里兰钳)、超声刀等。探查胸腔后,电凝钩或者超声刀等能量器械结合,以膈神经、乳内静脉、无名静脉、胸骨、心包等为界,打开肿瘤周围纵隔胸膜,仔细分辨解剖、游离肿物,辨别并保护周围重要的血管、神经等组织,对于前纵隔病变重点保护膈神经,尽量钝性分离,使用能量器械时要防止副损伤。对于肿瘤的滋养血管需完全游离,可使用钛夹或生物夹结扎后再使用能量器械离断,对于较粗的血管,也可选择使用腔镜切割缝合器钉仓进行离断。对于可切除肿瘤,无论良恶性尽量完整取出,标本取出时,可适当延长操作孔或助手孔大小。对于术前未明确病变性质的肿瘤,常规送检术中冰冻,根据术中冰冻结果决定具体手术范围。若考虑良性病变,即可准备止血关胸;若考虑胸腺瘤,需行胸腺扩大切除;若考虑恶性肿瘤,必要时可行淋巴结清扫。术毕于切口旁留置皮下镇痛泵,常规留置1根26-28F胸腔引流管,并连接引流瓶。
1.2.2 普通电视胸腔镜组 本医疗组电视胸腔镜手术常规开展3孔经肋间入路,少部分为单孔肋间入路及三孔剑突下入路。主刀医师站于患者术侧,其麻醉方式、体位、切口选择、手术操作流程和达芬奇机器人手术大致相似。
1.3 术后管理 两组患者术后均为同一医疗组管理,术后24 h内持续心电监护、雾化、吸氧,常规静脉滴注(氟比洛芬酯注射液100 mg,每日2次)联合口服镇痛药物(洛芬待因缓释片0.4 g,每日2次)进行镇痛,预防性使用抗生素不超过48 h(注射用头孢呋辛钠1.5 g,每日2次),经评估24 h胸腔引流量<100 mL,用力咳嗽无气体溢出,复查胸部X线无明显异常后予以拔除胸腔引流管。
1.4 统计学分析 所有数据采用SPSS 24.0软件进行分析。若计量资料符合正态分布,采用()表示,组间比较采用t检验表示,若计量资料不符合正态分布,以中位数[M(P25,P75)]表示,组间比较采用Man WhitneyU检验。计数资料以例数及百分比表示,组间比较采用皮尔森χ2检验或Fisher确切概率法。P<0.05为差异具有统计学意义。
2 结果
两组患者均完成预期病灶切除,其中达芬奇机器人组1例中转开胸,普通胸腔镜组5例中转开胸,无术后非计划二次手术、围手术期死亡等严重并发症。两组患者的性别构成、年龄、身高、体质量、BMI、肿瘤位置分布等数据均衡性好,具有可比性,差异无统计学意义(P>0.05)。见表1、表2。在围手术期观察指标方面,除术后胸腔引流液总量、胸腔引流管留置时间比较,差异有统计学意义(P<0.05)外,手术总时间、术中失血量、术后住院时间比较,差异均无统计学意义(P>0.05)。见表3。在中转开胸比例方面,两组比较差异无统计学意义(P>0.05);但两组术后总并发症发生率差异有统计学意义(P<0.05),其中达芬奇机器人组共有3例发生并发症;胸腔镜组共有13例发生并发症,经过对症处理后均康复出院。见表4。

表1 两组患者临床一般资料比较

表2 纵隔肿瘤的部位、大小及术后病理类型
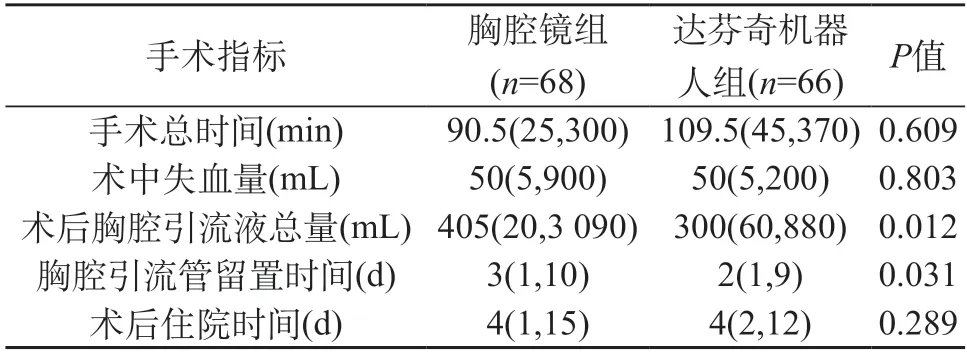
表3 两组患者围手术期观察指标[M(P25,P75)]
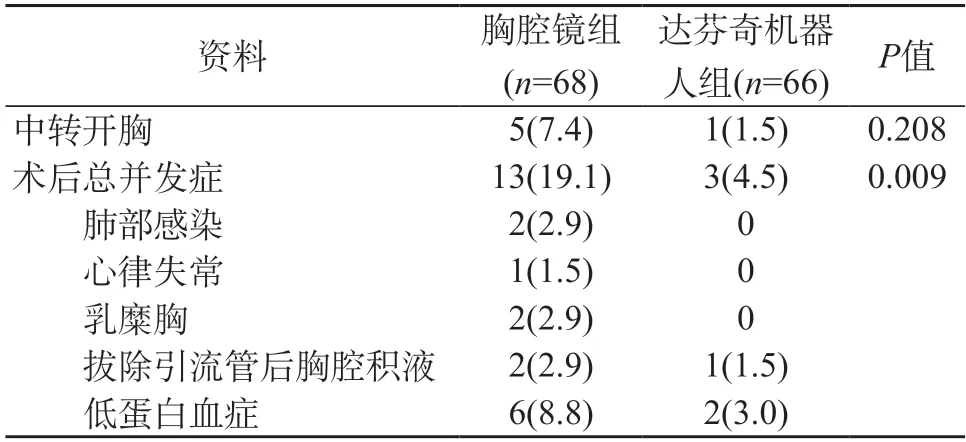
表4 两组患者中转开胸情况及术后并发症对比[n(%)]
3 讨论
纵隔肿瘤是临床常见的一类疾病,由于肿瘤的发生位置较为特殊,发病初期常无明显临床症状,若未及时诊治治疗效果往往受到影响,甚至会导致患者死亡[6-7]。纵隔肿瘤在临床中主要以手术切除治疗为主,部分患者需辅助行术后放化疗[8]。随着临床医学水平的发展,疾病治疗方法逐渐多样化,目前电视胸腔镜手术为纵隔肿瘤的主流手术方式,胸腔镜手术切口较小,仅在肋骨间隙作切口进行腔镜操作,很好的保护了骨性胸廓,在一定程度上降低了对机体的损伤。近年来,随着科技的进步,机器人辅助胸腔镜手术逐渐受到胸外科医师的青睐。达芬奇机器人手术系统具有高清的三维立体图像,放大10倍左右的术中视野图像,可清晰准确地进行组织判别和解剖[9-10]。目前有研究比较了机器人辅助纵隔肿瘤切除术、胸骨正中切开术和电视胸腔镜纵隔肿瘤切除手术[11]。机器人辅助手术能完成常规开放手术所治疗的纵隔肿瘤,保证病变切缘,同时降低术后并发症发生率、减少术中失血量及缩短术后住院时间,远期疗效满意。2016年6月,我科机器人手术医疗组完成了首例机器人辅助下纵隔肿物切除术,截至2021年11月,共完成66例纵隔肿瘤切除术,利用达芬奇机器人可以完成传统电视胸腔镜下的所有纵隔肿瘤切除手术,在前、中、后纵隔肿瘤的治疗上,机器人手术系统均显示出良好的普适性和安全性。
本研究的两组患者在性别构成、身高、体质量、肿瘤位置分布、肿瘤大小、病理类型上等数据资料均衡性好,具有可比性,而且为了减少误差,特选取同一医疗组开展的纵隔肿瘤切除术病例进行对比研究,研究结果具有一定可信度。统计分析结果显示,与电视胸腔镜组相比,达芬奇机器人组的手术总时间、术中失血量、术后住院时间、中转开胸率等无明显差异;术后胸腔引流液总量更少,术后胸腔引流管留置时间缩短,术后并发症发生率更低,显示出更良好的微创效果。本研究从我科第1例机器人手术患者数据开始统计,时间跨度大,且机器人手术可能存在学习曲线,随着机器人手术量的增加,主刀及助手的操作技巧及经验得到提升,手术操作时间及术中术后并发症较前逐渐减少,这可能会进一步优化手术效果。本研究中达芬奇机器人组1例中转开胸,普通胸腔镜组5例中转开胸,无统计学差异。其中机器人手术中转开胸,原因为术中探查发现肿瘤(最大直径7.5 cm,术后病理显示为B3型胸腺瘤Ⅱ期)与左无名静脉关系密切,分离过程存在大出血风险,为保证患者安全,故而选择中转正中切开。胸腔镜组3例探查发现胸腔致密粘连,其中2例经剑突下途径,1例为三孔肋间途径,中转开放。1例与心包、左上肺前段致密粘连、左侧膈神经受侵犯(肿瘤最大直径5 cm,术后病理纵隔不典型类癌),中转开放。1例肿瘤位于胸主动脉前方,侵犯心包及左侧膈神经(最大直径3.6 cm,术后病理显示为胸腺瘤B2型III期),中转胸骨正中切开。在术后并发症上,机器人组表现出一定优势,可能与其更加精细的操作、较少的组织副损伤有关[12-13]。术后胸腔镜组发生6例低白蛋白血症,机器人组发生2例低白蛋白血症。白蛋白低下的主要原因为术中术后丢失,其途径为术中失血及术后胸腔引流液丢失。白细胞较少会导致胸腔引流液的增多,胸腔引流液的增加会加重血浆白蛋白的丢失,二者互为循环[14]。在适应证方面,机器人辅助手术亦表现良好,一般机器人辅助纵隔肿瘤切除需选择肿瘤直径5 cm以内,本中心机器人组肿瘤直径中位数为3.5 cm,其中最大纵隔肿瘤直径为11.6 cm(病理类型为胸腺瘤 B1型 I期),顺利于微创下完成,说明机器人手术潜力巨大,巨大纵隔肿瘤并非机器人手术禁忌。术后疼痛也是外科手术的主要关注点,我们通常应用疼痛数字评分法(Numerical rating scale,NRS)及术后辅助镇痛药物的使用频率及剂量来评估患者疼痛情况。本研究为回顾性研究,患者术后疼痛评分数据缺少,同时因时间跨度大,两组患者的基础镇痛方式未能统一,可比性较差,故未予以纳入统计分析。此外,其他研究中心指出在手术费用上,机器人组相对较高。本中心机器人辅助手术常规加收3万余元费用,本中心适合微创手术的患者,常为患者结合自身经济条件自愿选择机器人或胸腔镜手术,故本研究未将住院费用纳入统计分析。从本中心的研究过程和结论中,可以总结出以下经验:首先,达芬奇机器人手术实施前,要充分评估病灶可切除性,尽量避免机器人资源浪费及增加患者及家属经济负担。术前应由机器人主刀及助手一起仔细阅读患者胸部增强CT,合理规划患者体位及切口选择。合适的切口是机器人手术成功的关键。外科医师在开展机器人手术前,需要具备一定的传统开胸及胸腔镜辅助手术经验,以具备应对机器人手术风险的应急能力。机器人手术系统在应对突发情况上尚有欠缺,对于术中出现一些意外情况,如术中出血较多不容易在机器人手术系统下控制,要果断地终止机器人手术,转为胸腔镜或开胸术止血,保证患者的安全[15]。
综上所述,达芬奇机器人辅助治疗纵隔疾病是安全可行的,与普通电视胸腔镜手术相比,围手术期治疗效果良好,提高了患者手术满意度。随着机器人系统的发展、手术经验的积累、医保的普及,机器人手术将会有更广泛的临床应用前景。同时未来也需要更多的前瞻性随机对照试验,以及长期随访追踪,进一步验证机器人手术系统的有效性和安全性。
