体外膜氧合器辅助下经皮冠状动脉介入治疗高危复杂冠心病
2022-05-25李田昌徐争鸣王志超李东韬
曹 毅,李田昌,陈 宇,徐争鸣,赵 力,王志超,李东韬
(中国人民解放军总医院第六医学中心心血管病医学部,北京 100048)
冠心病(coronary heart disease, CHD)发病率逐年升高,且患者常伴全身多种慢性疾病甚至多脏器功能障碍,急需再血管化治疗,而有治疗指征的复杂高危患者(complex higher-risk and indicated patient, CHIP)接受经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)和冠状动脉旁路移植术(coronary artery bypass grafting, CABG)时风险均较高。近年有学者[1-3]于机械循环支持(mechanical circulatory support, MCS)下行PCI,以治疗高危复杂CHD患者,取得良好效果。本研究观察体外膜氧合器(extracorporeal membrane oxygenator, ECMO)辅助下PCI治疗高危复杂CHD的价值。
1 资料与方法
1.1 一般资料 收集 2012年5月—2019年11月48例于中国人民解放军总医院第六医学中心接受ECMO辅助下PCI且冠状动脉造影示高危复杂冠状动脉病变的CHD患者,男36例,女12例,年龄51~93岁、平均(73.8±10.0)岁;Syntax评分32.0~53.5分、平均(41.66±5.82)分,院内全球急性冠状动脉事件注册(globle register acute coronary events, GRACE)评分92~276分、平均(158.06±28.79)分,欧洲心脏外科手术风险评估系统(European system for cardiac operative risk evaluation, EuroSCORE)评分6~21分、平均(12.33±3.85)分;其中不稳定型心绞痛30例,急性非ST段抬高型心肌梗死10例,急性ST段抬高型心肌梗死8例;合并高血压34例、糖尿病25例、脑梗死12例、慢性肾功能不全5例、心房颤动5例、慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)3例,6例曾接受CABG;见表1及图1~3。本研究通过院伦理委员会批准。
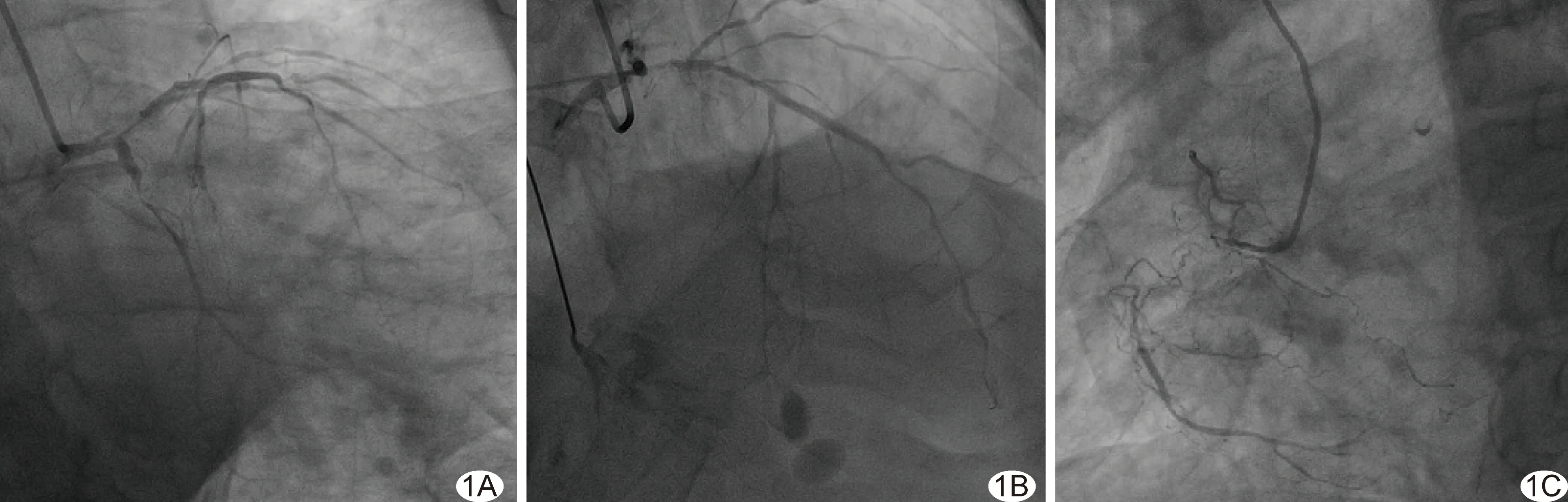
图1 冠心病不稳定型心绞痛患者,男,86岁,无保护左主干病变,冠状动脉造影图 A.LM远端重度狭窄、LCX近端重度狭窄; B.LAD弥漫病变,近端重度狭窄; C.RCA近端开口后慢性闭塞,远端桥侧支显影

表1 48例接受ECMO辅助下PCI的冠心病患者冠状动脉病变情况
1.2 仪器与方法 采用Medtronic-550型离心机,Medtronic定制肝素涂层一体化套装管路(含离心泵及膜式氧合器),MAQUET血液浓缩器,空氧混合器,变温水箱,肝素涂层股动、静脉插管等设备。嘱患者平卧,于一侧腹股沟处纵行切开皮肤,做长约5~6 cm切口,分离皮下组织、肌肉及股动脉鞘,游离股动、静脉并分别穿刺置入6F血管鞘;沿鞘管注射对比剂,明确血管无严重狭窄或纡曲后,送入J型导引导丝,并依次导入口径递增的血管扩张器,再于透视下沿导引导丝插入动、静脉引流管至适当位置,连接ECMO设备(Medtronic-550型离心机、MAQUET血液浓缩器);之后于静-动脉ECMO(venoarterial ECMO, VA-ECMO)模式辅助下行PCI并抗凝,运转气流量2~2.5 L/min,氧浓度50%~60%,血流量40~50 ml/kg体质量,维持平均动脉压≥70 mmHg,维持体温36~37℃;PCI结束后,如收缩压>90 mmHg且心功能良好,则逐步减少流量直至停机,停机后观察10 min,患者生命体征平稳、无明显不适时撤离ECMO,缝合手术切口。记录患者临床资料、ECMO辅助情况、PCI情况、住院期间病情变化及随访资料。
2 结果
2.1 ECMO辅助下PCI 48例中,39例采用单纯ECMO辅助、9例以主动脉内球囊反搏(intra-aortic balloon pump, IABP)+ECMO辅助,ECMO辅助时间0.50~3.55 h,平均(1.57±0.65)h;PCI过程中,31例导丝/球囊/支架等器械通过困难,7例血压下降≥20 mmHg或50%,6例心率减慢,4例冠状动脉夹层形成,3例慢血流/无血流。对46例成功完成PCI治疗,每例植入1~5枚支架、平均(2.60±1.25)枚,对比剂总量56~415 ml、平均(138.02±66.67)ml;2例因导丝、球囊通过困难,反复尝试过程中患者心率及血压下降而未能完成PCI,后转至心脏外科行CABG治疗。

图2 冠心病急性非ST段抬高型心肌梗死患者,女,74岁,CABG术后病变,冠状动脉造影图 A.LM无明显狭窄,LCX弥漫性钙化、重度狭窄; B.LAD弥漫病变,近端重度狭窄,中段次全闭塞; C.RCA中段第二转折前完全闭塞
2.2 PCI术后 46例PCI成功患者中,术后肺部感染4例,脑梗死2例,输血治疗2例,支架内急性血栓1例,切口感染1例,腹股沟血肿1例,急性心肌梗死1例,无远端肢体坏死发生。4例于院内死亡, 包括1例术后24 h内支架内急性血栓形成、1例术后第10日急性心肌梗死导致心源性休克及2例术后1周肺部感染并发感染性休克。42例患者病情好转并出院。
2.3 出院后随访 共随访1~89个月,中位随访时间35.5(6,72)个月;期间2例失访。40例完成随访患者中,随访期间5例死亡,包括术后8个月原因不明猝死、术后12个月因外伤致脑出血死亡、术后15个月因泌尿系统感染死亡、术后45个月股骨颈骨折手术中死亡及术后61个月因尿毒症死亡各1例;35例存活患者病情均获改善,心绞痛发作减轻,活动耐量提升。
3 讨论
CHIP伴全身多种疾病而无法耐受外科手术治疗,其冠状动脉病变严重、复杂,常合并血流动力学异常,且存在介入治疗指征[5];理论上此类患者属于可从再血管化治疗获益最高的人群,但因手术风险较高而多不得不选择药物保守治疗,导致疗效较差。本研究探索采用ECMO辅助下PCI治疗高危复杂CHD,疗效较佳,为解决上述问题提供了新的选择。
PCI术中常用机械循环辅助设备包括IABP、轴流泵(Impella)、左心房-股动脉旁路泵(Tandem-Heart)和ECMO。既往PCI多采用IABP辅助,但IABP仅能升高冠状动脉及脑、肾等重要血管的灌注压,而无法提供完全或部分心肺替代,难以有效保障手术的安全性,使得越来越多相关研究[6]下调了对IABP的推荐等级。Impella和Tandem-Heart设备价格均较高,且目前国内难以获得。ECMO模式包括VA-ECMO和静-静脉ECMO(venovenous ECMO, VV-ECMO);VA-ECMO兼具循环和呼吸辅助功能[7-8],可自右心房引流血液并泵入体外膜肺进行气体交换后,经外周动脉泵入动脉系统,可提供部分或短时间内全部心肺支持[9]。本研究纳入患者均为介入治疗“挑战性病例”,并均以VA-ECMO模式辅助PCI;对其中46例均安全完成PCI,仅2例因病变严重致术中导丝、球囊等器械通过困难而转外科行CABG,证实了ECMO辅助PCI的有效性。

图3 冠心病不稳定型心绞痛患者,男,78岁,仅存血管病变,冠状动脉造影图 A.LM未见明显狭窄,LCX近端完全闭塞,远端桥侧支显影; B.LAD近中段弥漫病变、重度狭窄,血管严重钙化、纡曲; C、D.RCA中段第二转折后完全闭塞,远端桥侧支显影
以ECMO辅助PCI亦存在并发症风险,主要包括术中出血、术后感染、中枢神经系统并发症、肾功能损害、血栓和远端肢体缺血等[10-11]。既往研究[12-13]报道,ECMO后,神经系统并发症发生率>15%,主要包括癫痫、脑梗死、脑出血和脑死亡。本研究于较低水平运转ECMO,且将平均使用时间控制于(1.57±0.65)h,多数患者一般情况尚可,表明降低ECMO流量、缩短辅助时间可有效减少并发症;2例术后发生消化道出血而需输血,主要原因可能在于ECMO机械性溶血、切口出血及应激反应,随访显示其预后均较好。本组PCI后切口感染1例、肺部感染4例,术后1周2例因肺部感染并发感染性休克而死亡。此类患者发生肺部感染较难控制,需提高警惕,或可适当预防性使用抗生素,根据个体情况管理手术切口及血管穿刺部位,改善全身营养状况,以预防切口局部并发症。
本研究的主要不足:①样本量小;②部分患者随访时间较短,且因大部分患者一般情况较差,多采用电话随访,缺乏超声、心电图及实验室指标等客观资料。
综上所述,ECMO辅助下PCI治疗高危复杂CHD安全、可行。
