三七遗传改良的研究进展
2022-05-24李满桥梁绮文陈中坚魏富刚张广辉刘冠泽杨生超
李满桥,梁绮文,闫 静,陈中坚,王 勇,魏富刚,张广辉,刘冠泽,杨生超*
三七遗传改良的研究进展
李满桥1, 2, 3,梁绮文1, 2,闫 静1, 2, 3,陈中坚4,王 勇4,魏富刚5,张广辉1, 2,刘冠泽1, 2,杨生超1, 2*
1.云南农业大学 西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201 2.云南农业大学 云南省药用植物生物学重点实验室,云南 昆明 650201 3.云南农业大学农学与生物技术学院,云南 昆明 650201 4.文山学院 文山三七研究院,云南 文山 663099 5.文山市苗乡三七实业有限公司,云南 文山 663000
三七作为传统名贵中药材,市场需求量大,人工种植是保障三七原料供给的主要措施之一。但三七在种植过程中对生态环境要求苛刻,面临着生长分布区域狭窄、连作障碍严重等诸多问题,加之三七良种对三七种植产业贡献率较低,三七品种化制度尚未建立。因此,从三七种质资源收集与鉴定、新品种选育、三七重要性状及关键基因挖掘、分子标记开发、组学技术应用等方面对三七遗传改良工作进行整理,为今后三七的新品种选育工作提供参考。
三七;种质资源;基因组;功能基因;分子标记
三七(BurK.) F.H.Chen.是五加科人参属的多年生草本植物,入药部位为其干燥的根和根茎,有活血化瘀、消肿定痛之效[1]。现代药理研究表明,三七总皂苷具有抗癌、调脂、修复神经元和保护细胞等作用,临床应用于心血管及骨科疾病的治疗[2]。三七作为中药材,质量受多种因素影响,品种是保障药材质量的关键因素之一。随着三七市场需求增长,其产业规模不断壮大,种植面积持续增涨[3]。人工种植面积的扩大,加之连作障碍的影响,三七种植区域逐渐向非道地产区转移;此外,三七人工种植过程中病虫害严重,农药的过量施用,导致农药残留和重金属含量超标等诸多问题,从而使三七安全品质下降,不利于三七产业的可持续发展[4]。《中国药典》2020年版对三七中重金属及有害元素做出严格限定[5],这就要求三七种植过程中严格控制化肥和农药的使用量。因此,选育优质、适产、抗性好的品种是三七产业发展的迫切需要,也是保障三七药材安全、有效、稳定、可控的有效手段。本文对三七品种选育的重要环节种质资源收集和新品种选育、表型性状分析、基因组研究以及三七重要性状解析和育种方法进行综述,同时探讨三七育种存在的问题并展望育种的发展方向,为从事三七育种的工作者提供参考。
1 三七种质资源现状
1.1 三七种质资源及其构成
三七有400多年的人工栽培历史,但有关三七种质资源收集与评价的研究相对较少。近20年来,研究人员陆续开展三七资源收集和整理工作。云南农业大学联合文山学院文山三七研究院及三七种植企业文山市苗乡三七实业有限公司等多家单位进行种质资源收集和评价工作,现已建立了400余份的三七种质资源圃,包含了从不同地区收集且具有不同特性的三七群体材料,以及经过人工选择、杂交、诱变后的育种材料。同时,建立已育成的三七新品种(良种)示范基地。研究人员将有望系统开展三七种质资源评价,构建三七核心种质,扩大核心种质规模,为三七今后的育种工作提供保障。
1.2 种质资源评价及新品种保护现状
三七种质资源评价为加快三七品种的选育提供理论依据及技术支持,并能通过资源评价筛选出优良种质,对育种成效进行评估[6]。三七种质资源评价中多数为不同产地三七的评价,通过农艺性状与分子标记结合对群体进行评价,张金渝等[7]利用表达序列标签(expressed sequence tag,EST)-简单重复序列标记(simple sequence repeat,SSR)对来自文山丘北、文山马塘、文山柳井经过3代集团选育筛选出的17份外观性状基本一致的选育品系和近缘种进行评价鉴定,Pan等[8]利用简化基因组测序技术(restriction-site associated DNA sequence,RAD-Seq)对12个三七种植区的36个样本进行分析,杨云[9]对经过4代连续集团选择的三七紫茎、绿茎、紧凑群体进行了评价,李满桥[10]对经过集团选择的44个三七高代群体重要农艺性状进行了评价鉴定。通过对三七资源评价结果表明,三七个体差异大而群体差异较小、经过集团选择的群体特异性和一致性高于自然栽培群体。
植物新品种保护是保障育种者权力和激励育种单位和个人从事种质资源创新的重要保障,而植物品种的DUS[特异性(distinctness)、一致性(uniformity)和稳定性(stability)]测试是实现植物新品种保护的技术基础,DUS测试工作也作为品种管理的重要手段之一。2013年发布的三七DUS测试指南极大促进了三七新品种选育工作[11]。目前,全国已授权的三七植物新品保护有3件[12],分别为滇七1号、苗乡1号和苗乡2号。云南省林业与草原局依据三七DUS测试指南要求,开展了三七新品种的注册登记工作,云南农业大学和文山市苗乡三七实业有限公司历经15年培育出滇七1号和苗乡三七1号2个三七植物新品种,其中滇七1号主要性状表现为茎杆颜色为紫色,田间抗性高,苗乡三七1号主要性状表现为茎杆颜色为绿色,与自然栽培群体相比3种皂苷(三七皂苷R1、人参皂苷Rb1和人参皂苷Rg1)含量高且高产。随后,利用系统选育法培育出滇七2号、滇七3号、苗乡三七3号、苗乡三七4号、苗乡三七5号等多个三七新品种(良种)。2019年,文山学院文山三七研究院与文山市苗乡三七实业有限公司培育出以紫根性状为主的文院紫七1号和以复叶柄夹角小为性状的苗乡三七2号2个三七新品种,集团选择为目前三七育种工作中主要的选择方法[13]。到2021年为止经过登记(审定)的三七品种(良种)共有9个(表1)。
但是三七植物DUS测试指南中大多为肉眼直观的判断,主观性较强,并且对育种选择群体的后代群体的特异性、一致性、稳定性评价描述不够清晰,工具测量量化以及分子水平应用评价较少。因此,三七植物DUS测试指南的修订工作应尽快完成。
2 三七性状变异研究
三七栽培群体为长期栽培驯化中形成的异质杂合群体,群体内性状差异较大,而性状差异也是三七系统选育的重要依据。陈中坚等[14]对绿茎、紫茎、紫绿过渡茎,以及根部断面颜色不同的三七群体研究表明,绿茎群体产量、单株根质量高于紫茎群体,但紫茎三七存苗率较高,紫根群体总皂苷含量高于绿根群体。孙玉琴等[15]将三七性状变异归类为以下几种:花型、叶着生形态、掌状复叶柄数、小叶数、叶型、复叶柄形态、块根颜色、茎杆颜色、休眠芽数、果实形状和颜色,发现三七不同部位茎、块根、休眠芽、花序、叶和果实存在明显变异,对三七性状变异类型进行较早且较为完整分析。此后,陈中坚等[16]和孙玉琴等[17]研究三七产量及质量相关农艺性状,表明地上部分叶部性状对单株产量及皂苷含量影响较大,叶面积较大单株产量较高,复叶柄平展、叶宽的植株中总皂苷含量较高,双茎植株中总皂苷含量低于单茎植株;地下部分性状中,主根颜色以及根形对皂苷含量亦有影响,紫根以及萝卜形根三七中的皂苷含量较高。其余性状如茎杆颜色及复叶数多少与三七单株产量及皂苷含量无关。另有研究表明,三七单株根质量与三七复叶柄基茎直径有关,复叶柄基茎膨大的性状变异对三七单株根质量、可溶性糖、皂苷含量有影响,通过对复叶柄基茎膨大三七与无该变异的三七植株进行比较发现复叶柄基径直径长的三七单株根质量较重、折干率、总皂苷含量较高[18],李满桥[10]通过对44个三七高代群体性状变异调查发现,复叶柄基茎粗与单株根质量有显著相关性。

表1 三七已登记(审定)品种(良种)
3 三七基因组研究
2017年三七完成全基因组草图构建,截至2021年已发表了5个版本的三七基因组(表2)。早期三七组测序组装分别由Zhang等[19]和Chen等[20]完成。Fan等[21]和Jiang等[22]先后公布了2个染色体水平的基因组,Fan等[21]组装版本基因组大小为2.26 Gb,通过转录组和比较基因组分析揭示了参与人参皂苷合成的候选基因,通过全基因组关联分析(genome wide association study,GWAS)分析鉴定了与根干重相关的63个基因,与茎粗相关的128个基因;对三七中的R基因进行分析,共预测到356个R基因,而同属植物人参有662个,其他亲缘关系较近植物R基因数量分别为辣椒796个,土豆741个,番茄537个,胡萝卜418个,结果表明三七在进化过程中出现核苷酸结合-富含亮氨酸重复序列和具有核苷酸结合位点的亚家族基因收缩的情况。Jiang等[22]组装三七基因组大小为2.66 Gb,通过基因组进化分析探索了系统发育和群体基因组复制事件及其对皂苷生物合成的影响,在时空转录水平研究了皂苷的生物合成和调控,鉴定到5个糖基转移酶基因,可以催化三七中不同人参皂苷的形成。2021年,Yang等[23]发布了染色体水平的高质量三七基因组。同先前已发表的三七基因组相比,该基因组组装及预测结果完整度最高,包含较少的冗余序列。该版本的三七基因组大小为2.41 Gb,该研究对三七中三七素生物合成途径进行解析。三七基因组学研究的不断发展,成功对皂苷、三七素生物合成以及抗病基因进行分析,为三七育种奠定了基础。
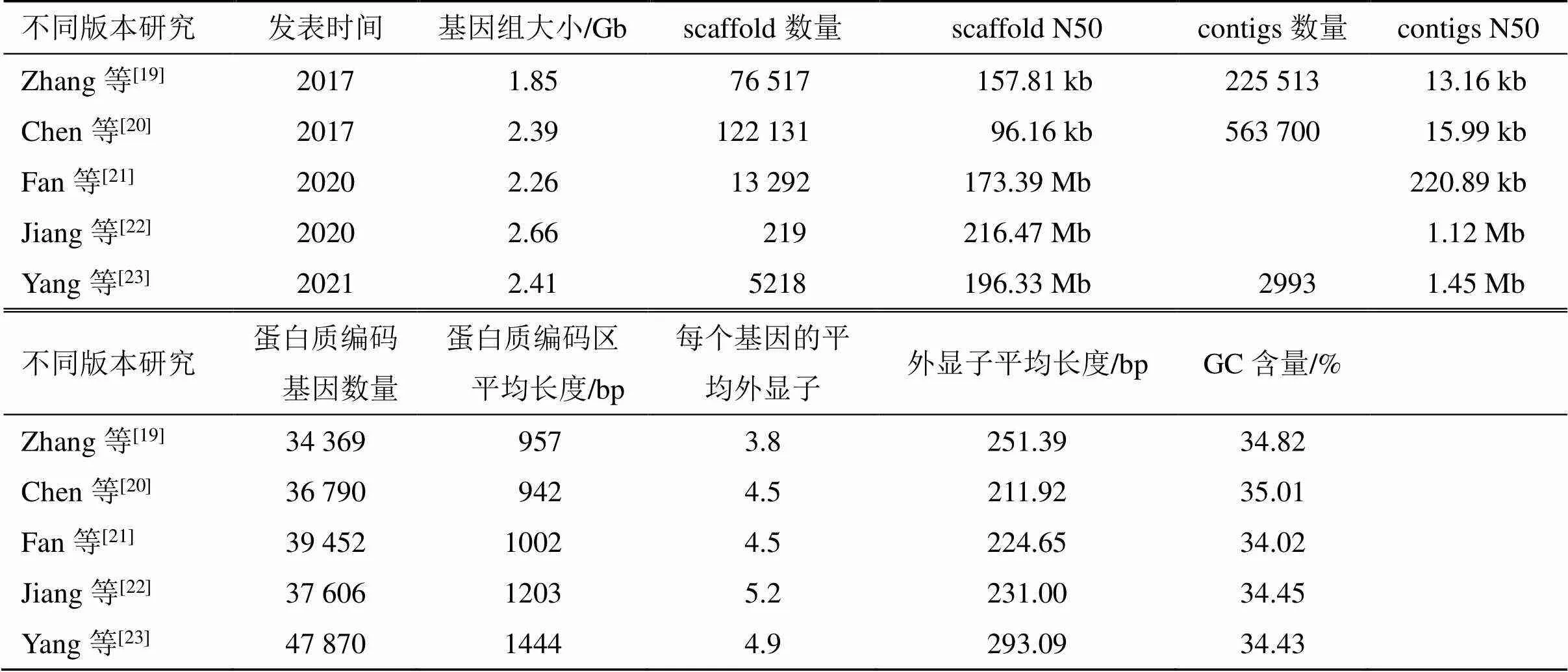
表2 三七基因组比较
scaffold N50即将基因组中所有scaffold按照长度从长到短进行排序后,对scaffold长度进行累加,当累加长度达到所有组装scaffold总长的50%时,该scaffold的长度即为scaffold N50;contigs N50类似scaffold N50,一般情况下,N50值越高说明基因组组装质量越好;GC含量在DNA的4种碱基中,鸟嘌呤和胞嘧啶所占的含量,GC含量愈高,DNA的密度也愈高
scaffold N50 is that all the scaffolds in the genome are sequenced in order of length from long to short; When the cumulative length reaches 50% of the total length of all scaffolds assembled, the length of the scaffold is N50; Contigs N50 is the same.Generally, the higher the N50 value, the better the quality of genome assembly; GC content refers to the content of guanine and cytosine among the four bases of DNA; The higher the GC content, the higher the density of DNA
4 组学技术解析三七重要性状关键基因
4.1 皂苷合成相关基因研究
三萜皂苷是三七中重要的次生代谢产物,其皂苷含量和种类影响着三七品质。利用基因组、转录组等组学技术是解析三七中三萜皂苷生物合成的重要手段之一[24]。三萜皂苷生物合成通常分为3个阶段:(1)异戊基焦磷酸(-amyl pyrophosphate,IPP)和二甲基焦磷酸烯丙基(dimethylallylpyrophosphate,DMPP)的合成;(2)IPP和DMPP催化生成2,3-氧化鲨烯(2,3-oxidosqualene);(3)2,3-氧化鲨烯经环化、羟基化、糖基化依次修饰生成三萜皂苷[25-28]。三七中三萜皂苷合成的部分关键酶基因已经被克隆鉴定,如3-羟基-3-甲基戊二酰辅酶A还原酶基因(HMG-CoA reductase,)、法尼基焦磷酸合酶基因(farnesyl diphosphate,)、鲨烯合酶基因(squalene synthase,)、鲨烯环氧化酶基因(squalene epoxidase,)、达玛烯二醇合酶基因(dammarenediol synthase,)[29-32]。其中,HMGR被认为是人参皂苷生物合成途径中的第1个限速酶[33],FPS催化二甲基烯丙基二磷酸酯和香叶基二磷酸酯与异戊烯基二磷酸酯的顺序缩合生成基焦磷酸(farnesyl diphosphate,FPP),SS将2个FPP分子转化为C30类异戊二烯鲨烯,SE催化鲨烯的双键环氧化形成2,3-氧化鲨烯,DS催化2,3-氧化鲨烯形成达玛烯二醇[34]。
根据三七不同组织转录组数据分析表明,三七中人参皂苷合成途径关键基因(、、、)均在三七花中高表达,且2年生和3年生三七植株中花和叶中表达水平高于根和须根,3年生三七中的表达水平略低于2年生三七[35-36]。在下游皂苷生物合成过程中,由细胞色素P450单加氧酶(cytochrome P450,CYP)和UDP-糖基转移酶(UDP-dependent glycosyltransferases,UGT)发挥关键作用[37],其中催化达玛烯二醇形成原人参二醇(protopanaxadiol,PPD),催化PPD形成原人参三醇(protopanaxatriol,PPT),且在地上部分中大量表达,主要在地下部分表达[38]。PPD和PPT经过UGT催化形成下游单体皂苷。Jiang等[22]通过基因组与转录组联合分析,挖掘并验证了5个UGT,即、、、、。Wang等[39]挖掘并验证了5个不同亚家族的UGT基因,即、、、、,分别催化PPD和PPT形成不同的单体皂苷(图1)。三七皂苷生物合成关键基因的功能验证,为今后开发品质相关功能标记及育种材料的筛选提供了科学依据。
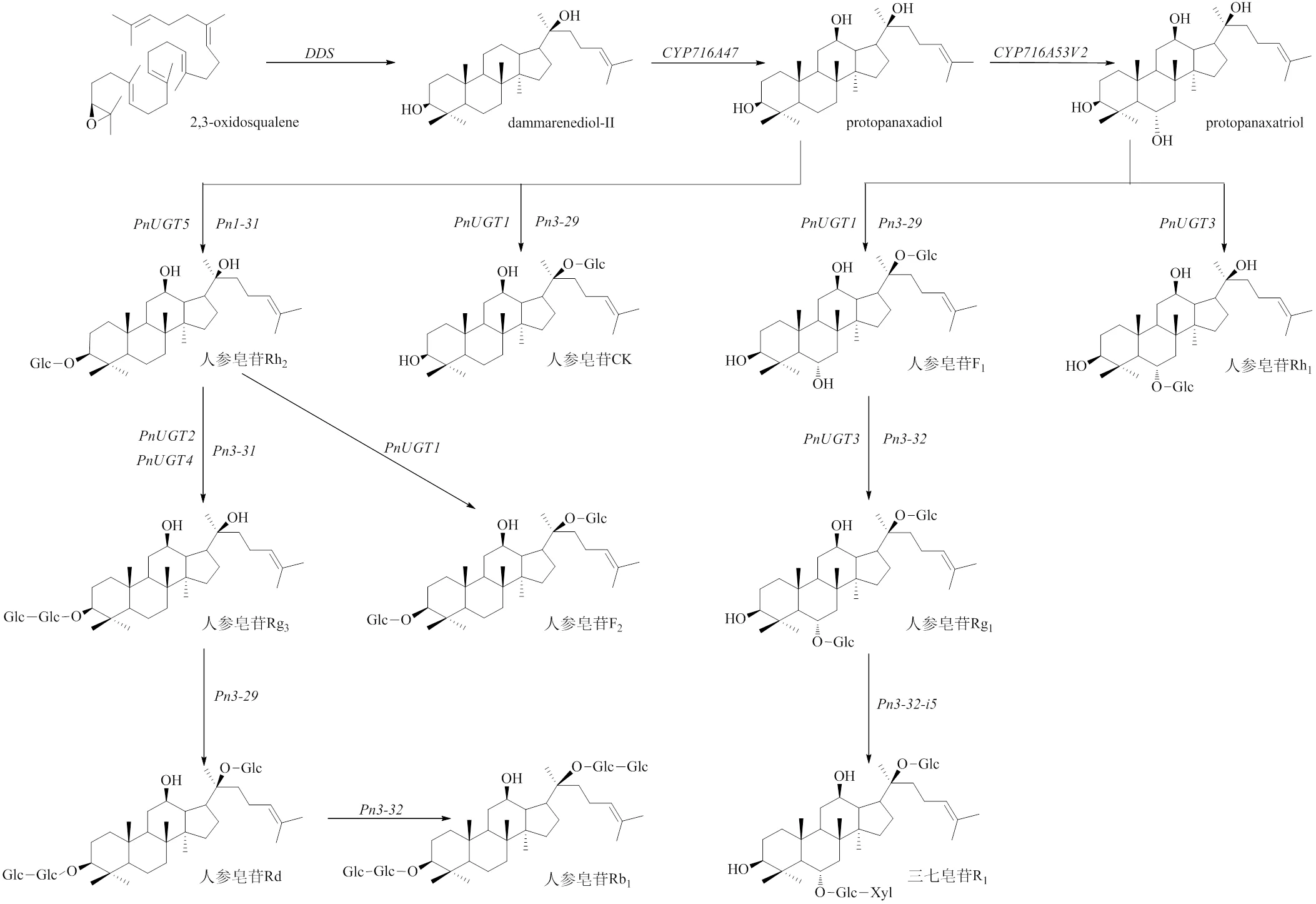
图1 不同UGT基因催化形成不同单体皂苷
4.2 三七素生物合成途径研究
三七素也称三七氨酸,是三七中天然存在的水溶性非蛋白氨基酸,其化学名为β--草酰--α,β-二氨基丙酸(β--oxalyl--α,β-diaminop-ropionic acid,β-ODAP)。三七素作为三七止血的主要活性成分,用于治疗外伤出血等症状,是云南白药中发挥止血作用的有效成分。三七素在三七中的质量分数可达0.9%,在三七花中的质量分数最高,可达到3.33%,其次是根状茎和主根,茎叶中也有较高含量[40]。利用组学技术,推测出三七素生物合成途径,并挖掘到合成通路关键酶家族3-磷酸化丝氨酸转氨酶、II类磷酸吡哆醛依赖性酶、鸟氨酸环化脱氨酶、酰基活化酶3及BAHD酰基转移酶相关基因,该发现为三七素生物合成提供了分子基础[23]。
4.3 胁迫响应相关基因研究
三七胁迫响应相关基因主要涉及生物胁迫、重金属及非生物逆境胁迫相关基因。人参链格孢是引发三七黑斑病的主要病原菌之一,许振宁等[41]发现三七叶片接种人参链格孢后,几丁质酶基因的表达量迅速升高,呈波动上升趋势,外源茉莉酸甲酯预处理三七根部,表达水平上升;接种茄腐镰刀菌后,转录水平急剧上升,接种后4 h达到最高转录水平,表明参与人参链格孢以及茄腐镰刀菌侵染三七的防卫反应。白智伟等[42]对基因重组蛋白的体外平板抑菌实验显示,该基因原核重组蛋白对尖孢镰刀菌、茄腐镰刀菌、轮枝镰刀菌的菌丝生长具有抑制作用。将该基因转入烟草后提高了烟草对茄腐镰刀菌的抗性。关瑞攀[43]从三七中获得7个dirigent()全长序列,通过体外平板抑菌实验表明,的重组蛋白对4种病原真菌串珠状赤霉菌、核盘菌、茄腐镰刀菌和尖孢镰刀菌的菌丝生长有明显的抑制作用,且随着蛋白浓度的提高,抑制活性增强。亚细胞定位表明,PnDIR1蛋白定位于植物细胞壁,基因转入烟草后,过表达显著增强了转基因烟草对茄腐镰刀菌的抗性。病程相关蛋白(pathogenesis-related protein,)基因是三七与病原菌互作研究的一个突破点,唐美琼等[44]通过蛋白组差异定量研究,在三七中鉴定出与人参序列高度相似的病程相关蛋白基因,该基因在三七受尖孢镰刀菌胁迫后表达量显著提高。杨丹等[45]在三七主根中分离到,对其进行原核表达并用其纯化重组蛋白进行体外抑菌活性实验,其重组蛋白对茄腐镰刀菌和毁灭柱孢有抑制作用。Li等[46]在三七中分离到一个编码PR-like蛋白基因,该基因的重组蛋白对茄腐镰刀菌的孢子萌发有抑制作用。将该基因导入烟草后稳定表达,转基因植株对茄腐镰刀菌有较高抗性。Liu等[47]揭示外源施用茉莉酸甲酯诱导三七对茄腐镰刀菌的抗性机制,结果表明三七中参与萜类骨架生物合成、苯丙氨酸代谢和植物-病原体相互作用相关的基因经茉莉酸甲酯处理后上调表达,外源施加茉莉酸甲酯显著激活亚油酸13-脂氧合酶(linoleate 13-lipoxygenase,)、丙二烯氧化环化酶(allene oxide cyclase,)和丙二烯氧化合酶(allene oxide synthase,)基因,上述基因均为茉莉酸生物合成关键基因,研究结果表明茉莉酸信号在三七对茄腐镰刀菌感染的反应中起重要作用。上述研究为三七抗病育种提供了重要线索。
重金属胁迫严重影响三七安全品质,Liu等[48]分析了砷对三七品质的影响以及响应的耐受机制。三七受到砷胁迫后,人参皂苷、类黄酮的生物合成会受到抑制,人参皂苷和黄酮类生物合成上游及下游通路中7个编码关键酶的基因在砷胁迫中表达下调,编码转运蛋白(ATP结合盒、多药及毒素外排、糖、寡肽、硝酸盐转运蛋白)基因、激素代谢相关因子(乙烯、脱落酸、细胞分裂素)和砷积累相关基因(已糖转运蛋白基因、天然抗性相关巨噬细胞蛋白基因、金属硫蛋白基因和谷氧还蛋白基因)差异表达。三七响应干旱胁迫的研究较少,徐若等[49]对干旱胁迫后三七差异基因进行分析,发现控制脱落酸合成关键酶9-顺式-环氧类胡萝卜素双加氧酶被显著富集,说明干旱条件下可能通过脱落酸相关合成基因表达的增加,调控三七植株对干旱胁迫的应答。
5 三七育种方法应用
5.1 选择育种
选择育种是植物品种选育的基本方法,三七经过多年的人工栽培,遗传背景仍是混杂群体,遗传多样性丰富。且三七为常异花授粉植物,个体基因杂合,遗传基础复杂,生长周期较长,目前难以获得纯系品种,而当前三七品种选育主要采用集团混合选择法对三七进行品种选育,获得群体品种。集团混合选择法是现阶段满足三七品种选育要求的主要育种方式。集团选择法在三七新品种选育中有成功案例如新品种滇七1号,良种滇七3号、苗乡4号、苗乡5号,其他药用植物如人参品种吉参1号和宝泉山人参,灯盏花优质、高产品种千山1号和千山2号也均是采用集团选择法进行品种选育[50]。
5.2 诱变育种
三七诱变育种研究较少,王朝梁等[51]用秋水仙碱对三七种子进行处理,处理后植株增高,叶片增大,叶色浓绿,叶绿素含量及气孔数目增多。滕娟等[52]利用不同剂量(0~160 Gy)的60Co-γ射线对三七种子进行处理,结果表明三七种子的适宜剂量(半致死剂量)为54 Gy;随辐射剂量的增大,丙二醛含量增加,可溶性糖、游离氨基酸、可溶性蛋白、超氧化物歧化酶活性也都随辐射剂量的增加而呈现先增加后减小的趋势,并在20 Gy或10 Gy出现峰值,三七新鲜种子对较低剂量的60Co-γ射线具有一定的耐受能力。周璇等[53]利用化学诱变剂甲基磺酸乙酯不同浓度诱变三七种子,获得了花型小、矮株、畸形叶等三七表型变异植株。此外,筛选到具有抗衰老特征的三七植株,该植株其内源激素水杨酸、脱落酸、生长素、茉莉酸和茉莉酸-异亮氨酸的含量发生明显改变。
为了探究三七与其近缘种杂交的可能性以及种内杂交的适应性,孙玉琴等[54]对三七花粉活力以及柱头可授性进行了研究,采用MTT法研究了三七开花散粉后30 h的花粉活力,花粉散粉后8 h内花粉活力维持在70%以上,散粉后15 h花粉活力明显减弱,30 h后,花粉活力只有20%~30%,花粉贮藏过程中在4 ℃和−20 ℃条件下均能有效保存花粉,三七花粉保存适宜在保存期10 d内完成杂交工作,不宜超过20 d。该研究为三七种内杂交和远缘杂交提供理论依据。
5.3 分子标记辅助育种
分子标记迅速发展,被广泛应用于药用植物种质资源遗传多样性分析、品种鉴定、品质和抗性育种等方面[55]。扩增片段长度多态性(amplified fragment length polymorphism,AFLP)[56]、限制性片段长度多态性(random amplified polymorphic DNA,RAPD)[57]、简单序列重复区间(inter-simple sequence repeat,ISSR)标记、相关序列扩增多态性(sequence related amplified polymorphism,SRAP)[9]、SSR[58]和SNP[59]等分子标记技术,在三七遗传改良中均有报道。
5.3.1 RAPD标记 段承俐等[60]采用RAPD分析,从160个10 bp的寡核苷酸引物中筛选出8条特异性引物对三七裁培群体中的7个变异类型共34个样品进行了PCR扩增共扩增出了49条带。其中多态性条带37条,变异类型之间的多态性差异达75.50%,同一类型不同个体间的多态性差异为75.20%。从遗传背景分析,三七栽培群体是杂合群体,具有丰富的遗传多样性。赵熙等[57]采用RAPD技术对2个不同产地的三七进行了DNA指纹图谱的鉴别研究,结果表明不同产地的三七具有不同遗传特征。杨莉等[61]利用RAPD对拟定父本和随机挑选母本的子代进行亲本分析,对各母本与拟定父本的基因型差异分析,得到三七花粉的传播距离应≥4.5 m。RAPD被应用到三七与人参属近缘种鉴别中,刘丽等[62]采用RAPD技术对人参属中人参、三七、西洋参基因组DNA进行多态性分析,从120条随机引物中筛选出12条随机引物用于PCR扩增,共扩增出111条扩增片段,其中多态性位点107个,多态性为96.40%,3种人参属植物中,三七与人参和西洋参的亲缘关系较远。
5.3.2 SSR标记 三七基于EST-SSR开发与应用中,Luo等[63]对EST-SSR进行分析,从2361个EST序列中共鉴定出2772个SSR基序,频率为8.98%,鉴定出的SSR频率与一些双子叶物种相似,碱基重复为2~6个碱基重复,在含SSR的序列中82.5%的序列在每个序列中都有单一的SSR基序,双碱基重复序列最丰富,双碱基重复约为三碱基重复的2倍,AG/GA/CT/TC/是双碱基重复序列中常见的碱基重复。同时,发现参与编码三萜皂苷合成酶(AACT、HMGR、SE、SS、DS)的序列相连SSR基序。张金渝等[64]用EST-SSR对来自4个不同区域的17份三七品系,进行了居群遗传多样性和遗传结构分析,品系遗传变异和遗传分化鉴定。在8个居群中用17对EST-SSR引物扩增出205个多态性位点,结果表明三七遗传差异主要集中在居群内。利用17对引物在17份三七品系中共扩增出136个多态性位点,聚类分析将其分为3个类群,证明经过集团选择后,相同栽培群体内筛选出的不同品系存在遗传分化,也可通过EST-SSR检测集团选择的结果[7]。其中ISSR、SRAP在三七中应用较少,杨云[9]利用ISSR和SRAP对集团选择4代后的3个改良群体和自然群体一致性、稳定性、特异性进行鉴定与评价,结果表明集团选择的3个群体一致性均大于自然群体。2017年三七完成全基因组测序工作后[20],揭应碧等[58]对三七基因组中的SSR位点进行了分析,总共识别到314 060个SSR位点,SSR密度为每Mbp有131个SSR位点,平均距离为7.62 kb,利用苗乡三七1号、滇七1号和自然群体为材料,筛选出41对引物,最终得到与表型、皂苷含量相关联的8对SSR标记引物[65]。
5.3.3 SNP标记 董林林等[59]基于RAD-Seq技术从苗乡抗七1号中获得12个特异性SNP位点,种子、种苗、块根进行根腐病抗性系统评价结果表明,与常规栽培群体相比,接种根腐病致病菌尖孢镰刀菌7 d后,抗病品种种子病情指数下降52.0%;接种25 d,抗病品种种苗死苗率及块根病情指数分别下降72.1%、62.4%,抗病效果显著,是三七抗病品种选育和三七分子育种方面的重要突破[66]。Fan等[21]收集并重测序了240个三七植株,利用SNP重建了三七种群结构,将其分为了4个不同的亚群。种群结构表明,亚群之间存在频繁的基因流动,并通过SNP数据滤过,为GWAS分析保留了11.8 Mb的SNP,通过GWAS分析,检测到与根干质量相关的91个SNP位点和63个基因,与茎粗相关的128个基因。
6 结语与展望
三七作为我国特有的药用植物,皂苷性状与其药效品质密切相关。三七中皂苷的含量和种类应是三七品种选育的核心目标。《中国药典》2020年版规定三七根及根状茎的干燥品中人参皂苷Rg1、人参皂苷Rb1及三七皂苷R1的总皂苷含量不得少于5%。因此,未来三七新品种选育应将总皂苷含量作为核心育种目标,通过种质资源筛选、分子标记开发等技术手段,获得高总皂苷含量的三七新品种。课题组前期通过集团选择法,构建人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1、人参皂苷Re、人参皂苷Rd总皂苷含量高的群体,有望选育出总皂苷含量和单体皂苷高的三七新品种。此外,相比农作物育种,三七产量性状应以稳产为育种目标,在当前栽培种植水平条件下,三七新品种产量应在2250~3000 kg/hm2(干品)为宜。同时,已有三七性状变异研究表明三七地上部分性状与三七产量有着密切关联,地上部分应选择总花梗较矮、株高适中、复叶柄基茎较粗、复叶柄夹角小、叶片较宽、叶面积较大的株型材料,可利用三七基因组信息开发和验证与根质量相关的分子标记,为产量性状选择奠定基础。为了缓解连作障碍造成的道地产区三七用地紧张乃至于无地可种问题,以耐连作、高海拔抗寒为育种目标的三七新品种选育工作也应陆续推进。同时,高质量三七基因组公布为全基因组选择育种奠定了基础。随着信息技术以及测序技术的发展,全基因组选择育种方法的可行性越来越强,该方法有望在三七育种中应用,缩短三七育种周期,提高育种效率。
利益冲突 所有作者均声明不存在利益冲突
[1] 潘嘉, 王家葵.三七功效本草考证 [J].中国中药杂志, 2003, 28(6): 520-521.
[2] 刘耀晨, 张铁军, 郭海彪, 等.三七的研究进展及其质量标志物预测分析 [J].中草药, 2021, 52(9): 2733-2745.
[3] 戴晨曦, 谢相建, 徐志刚, 等.中草药材种植遥感监测与分析: 以云南省文山和红河地区三七种植为例 [J].国土资源遥感, 2018, 30(1): 210-216.
[4] 王朝梁, 崔秀明.三七农残重金属研究现状及对策 [J].现代中药研究与实践, 2003, 17(S1): 36-38.
[5] 中国药典[S].一部.2020: 12-13.
[6] 萧凤回, 段承俐, 文国松, 等.三七栽培群体遗传改良研究及策略 [J].现代中药研究与实践, 2003, 17(S1): 10-13.
[7] 张金渝, 杨维泽, 崔秀明, 等.EST-SSR标记对三七选育品系的研究 [J].中国中药杂志, 2011, 36(2): 97-101.
[8] Pan Y Z, Wang X Q, Sun G L,.Application of RAD sequencing for evaluating the genetic diversity of domesticated(Araliaceae) [J]., 2016, 11(11): e0166419.
[9] 杨云.三七集团选择后代群体的鉴定与评价[D].昆明: 云南农业大学, 2014
[10] 李满桥.三七集团选择高代群体重要农艺性状评价与鉴定[D].昆明: 云南农业大学, 2021
[11] 植物新品种特异性、一致性和稳定性测试指南——三七[S].2013.
[12] 刘美娟, 薛璟祺, 曾燕, 等.我国中药材新品种保护与DUS测试指南研制现状 [J].中国现代中药, 2021, 23(9): 1637-1643.
[13] 熊高, 王勇, 胡永媛, 等.三七育种研究综述 [J].文山学院学报, 2019, 32(3): 1-5.
[14] 陈中坚, 王勇, 曾江, 等.三七植株的性状差异及其对三七产量和质量影响的调查研究 [J].中草药, 2001, 32(4): 357-359.
[15] 孙玉琴, 陈中坚, 李一果, 等.三七的植株性状差异观察 [J].现代中药研究与实践, 2003, 17(S1): 16-17.
[16] 陈中坚, 崔秀明, 孙玉琴, 等.三七主要农艺性状的相关和通径分析 [J].中国中药杂志, 2004, 29(1): 37-39.
[17] 孙玉琴, 陈中坚, 黄天卫, 等.三七不同变异类型中皂苷的差异研究 [J].中草药, 2010, 41(6): 993-996.
[18] 张优, 张洪玲, 李桂琼, 等.三七“拔鸡腿”对三七主根产量和皂苷含量的表征[J].中药材, 2021, 44(4): 773-779.
[19] Zhang D, Li W, Xia E H,.The medicinal herbgenome provides insights into ginsenoside biosynthesis and genome evolution [J]., 2017, 10(6): 903-907.
[20] Chen W, Kui L, Zhang G H,.Whole-genome sequencing and analysis of the Chinese herbal plant[J]., 2017, 10(6): 899-902.
[21] Fan G Y, Liu X C, Sun S,.The chromosome level genome and genome-wide association study for the agronomic traits of[J]., 2020, 23(9): 101538.
[22] Jiang Z Q, Tu L C, Yang W F,.The chromosome-level reference genome assembly forand insights into ginsenoside biosynthesis [J]., 2021, 2(1): 100113.
[23] Yang Z J, Liu G Z, Zhang G H,.The chromosome-scale high-quality genome assembly ofprovides insight into dencichine biosynthesis [J]., 2021, 19(5): 869-871.
[24] 陈士林, 吴问广, 王彩霞, 等.药用植物分子遗传学研究 [J].中国中药杂志, 2019, 44(12): 2421-2432.
[25] 杨金玲, 高丽丽, 朱平.人参皂苷生物合成研究进展[J].药学学报, 2013, 48(2): 170-178.
[26] Zhao Y J, Li C.Biosynthesis of plant triterpenoid saponins in microbial cell factories [J]., 2018, 66(46): 12155-12165.
[27] Yang J L, Hu Z F, Zhang T T,.Progress on the studies of the key enzymes of ginsenoside biosynthesis [J]., 2018, 23(3): E589.
[28] Kim Y J, Zhang D B, Yang D C.Biosynthesis and biotechnological production of ginsenosides [J]., 2015, 33(6 Pt 1): 717-735.
[29] Deng B, Zhang P, Ge F,.Enhancement of triterpenoid saponins biosynthesis incells by co-overexpressions of 3-hydroxy-3-methylglutaryl CoA reductase and squalene synthase genes [J]., 2017, 122: 38-46.
[30] Jiang D, Rong Q X, Chen Y J,.Molecular cloning and functional analysis of squalene synthase (SS) in[J]., 2017, 95: 658-666.
[31] 牛云云, 朱孝轩, 罗红梅, 等.三萜皂苷合成生物学元件的初步开发: 三七鲨烯环氧酶编码基因克隆及表达模式分析[J].药学学报, 2013, 48(2): 211-218.
[32] He F M, Zhu Y P, He M X,.Molecular cloning and characterization of the gene encoding squalene epoxidase in[J]., 2008, 19(3): 270-273.
[33] Wu Q, Sun C, Chen S L.Identification and expression analysis of a 3-hydroxy-3-methylglutaryl coenzyme A reductase gene from American ginseng [J]., 2012, 5(4): 414-420.
[34] Xia P G, Zheng Y J, Liang Z S.Structure and location studies on key enzymes in saponins biosynthesis of[J]., 2019, 20(24): 6121.
[35] Niu Y Y, Luo H M, Sun C,.Expression profiling of the triterpene saponin biosynthesis genes FPS, SS, SE, and DS in the medicinal plant[J]., 2014, 533(1): 295-303.
[36] Wei G F, Dong L L, Yang J,.Integrated metabolomic and transcriptomic analyses revealed the distribution of saponins in[J]., 2018, 8(3): 458-465.
[37] Hou M Q, Wang R F, Zhao S J,.Ginsenosides ingenus and their biosynthesis [J]., 2021, 11(7): 1813-1834.
[38] Wei G F, Wei F G, Yuan C,.Integrated chemical and transcriptomic analysis reveals the distribution of protopanaxadiol- and protopanaxatriol-type saponins in[J]., 2018, 23(7): E1773.
[39] Wang D, Wang J H, Shi Y S,.Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products ofusing a synthetic biology platform [J]., 2020, 61: 131-140.
[40] 段绍凤, 陈庚, 闫静, 等.三七素提取工艺及检测方法的优化 [J].热带作物学报, 2019, 40(11): 2255-2260.
[41] 许振宁, 普丽梅, 曲媛, 等.三七几丁质酶基因的克隆及表达特性分析 [J].中国中药杂志, 2016, 41(11): 2036-2043.
[42] 白智伟, 普丽梅, 唐笔锋, 等.三七几丁质酶基因的功能分析 [J].中国中药杂志, 2018, 43(9): 1832-1837.
[43] 关瑞攀.基因参与三七—茄腐镰刀菌互作的分子机理研究 [D].昆明: 昆明理工大学, 2018.
[44] 唐美琼, 闵丹丹, 李刚, 等.三七病程相关蛋白PR10-1基因克隆及功能初步分析 [J].药学学报, 2015, 50(2): 227-232.
[45] 杨丹, 包燚, 陈丽梅, 等.三七病程相关蛋白基因的克隆、表达及功能初步分析 [J].中国中药杂志, 2017, 42(16): 3106-3111.
[46] Li S, Wang Z E, Tang B F,.A pathogenesis-related protein-like gene is involved in thedefense response to the root rot pathogen [J]., 2021, 11: 610176.
[47] Liu D Q, Zhao Q, Cui X M,.A transcriptome analysis uncoversresistance toinduced by methyl jasmonate [J]., 2019, 41(12): 1383-1396.
[48] Liu Y F, Mi Y H, Zhang J H,.Illumina-based transcriptomic profiling ofin response to arsenic stress [J]., 2016, 57(1): 13.
[49] 徐若, 张秀芬, 李艳冰, 等.干旱胁迫对三七生理指标的影响及转录组分析 [J].中国农学通报, 2021, 37(16): 51-58.
[50] 杨生超, 郭巧生.药用植物育种学 [M].北京: 高等教育出版社, 2020: 66.
[51] 王朝梁, 陈中坚, 孙玉琴, 等.秋水仙碱诱导三七多倍体的初步研究 [J].中国中药杂志, 2007, 32(12): 1222-1224.
[52] 滕娟, 熊俊芬, 何忠俊, 等.60Co-γ辐射对三七幼苗生理特性的影响 [J].云南农业大学学报: 自然科学, 2015, 30(3): 445-449.
[53] 周璇, 韩丽, 戴蕾, 等.EMS诱变三七种子获得抗衰老植株 [J].陕西农业科学, 2019, 65(3): 38-41.
[54] 孙玉琴, 周世良, 陈中坚, 等.三七花粉活力和柱头可授性研究 [J].中国中药杂志, 2009, 34(7): 913-915.
[55] 王刚, 曹佩, 韦学敏, 等.分子标记技术在药用植物种质资源研究中的应用 [J].中国现代中药, 2019, 21(11): 1435-1444.
[56] Wang D, Hong D, Koh H L,.Biodiversity in cultivatedpopulations [J]., 2008, 29(9): 1137-1140.
[57] 赵熙, 李艳萍, 李顺英, 等.三七DNA指纹图谱分析 [J].云南中医中药杂志, 2006, 27(3): 45-46.
[58] 揭应碧, 卢迎春, 宋婉玲, 等.三七基因组SSR位点分析和多态性引物开发 [J].热带作物学报, 2018, 39(7): 1351-1358.
[59] 董林林, 陈中坚, 王勇, 等.药用植物DNA标记辅助育种(一): 三七抗病品种选育研究 [J].中国中药杂志, 2017, 42(1): 56-62.
[60] 段承俐, 萧凤回, 文国松, 等.文山三七栽培群体变异类型的分子鉴定 [J].现代中药研究与实践, 2003, 17(S1): 13-16.
[61] 杨莉, 崔秀明, 孙玉琴, 等.三七花粉流的初步研究 [J].现代中药研究与实践, 2012, 26(6): 11-14.
[62] 刘丽, 肖炳燚, 聂平, 等.采用RAPD技术对人参属的亲缘关系和鉴别的分析 [J].药物分析杂志, 2016, 36(2): 255-260.
[63] Luo H M, Sun C, Sun Y Z,.Analysis of the transcriptome ofroot uncovers putative triterpene saponin-biosynthetic genes and genetic markers [J]., 2011, 12(Suppl 5): S5.
[64] 张金渝, 杨维泽, 崔秀明, 等.三七栽培居群遗传多样性的EST-SSR分析 [J].植物遗传资源学报, 2011, 12(2): 249-254.
[65] 揭应碧.三七SSR标记开发及遗传多样性分析[D].昆明: 云南农业大学, 2018.
[66] 陈中坚, 马小涵, 董林林, 等.药用植物DNA标记辅助育种(三)三七新品种: “苗乡抗七1号”的抗病性评价 [J].中国中药杂志, 2017, 42(11): 2046-2051.
Research progress on genetic improvement of
LI Man-qiao1, 2, 3, LIANG Qi-wen1, 2, YAN Jing1, 2, 3,CHEN Zhong-jian4, WANG Yong4, WEI Fu-gang5, ZHANG Guang-hui1, 2, LIU Guan-ze1, 2, YANG Sheng-chao1, 2
1.National & Local Joint Engineering Research Center on Germplasms Utilization & Innovation of Chinese Materials in Southwest, Yunnan Agricultural University, Kunming 650201, China 2.Yunnan Provincial Key Laboratory of Medicinal Plant Biology, Yunnan Agricultural University, Kunming 650201, China 3.College of Agriculture and Biotechnology, Yunnan Agricultural University, Kunming 650201, China 4.Sanqi Research Institute, Wenshan University, Wenshan 663099, China 5.MiaoxiangIndustrial Corporation Ltd.of Wenshan City, Wenshan 663000, China
is a valuable traditional Chinese medicinal herb with large market demand.It is one of the main measures to ensure the raw material supply of traditional medicine.has strict requirements on ecological environment, thus the cultivation faced many problems such as narrow growth distribution area, serious continuous cropping obstacles, and the conventional breeding forhas not been established yet.In this paper, the genetic improvements ofwas summarized from the following aspects: Collection and identification of germplasm resources, breeding of new varieties, mining of key genes associated with important traits, development of molecular markers, and application of omics techniques were reviewed in this paper, in order to provide references for genetic improvement ofin the future.
(BurK.) F.H.Chen.; genetic resources; genomics; functional gene; molecular marker
R282.12
A
0253 - 2670(2022)10 - 3241 - 10
10.7501/j.issn.0253-2670.2022.10.034
2022-01-20
国家重点研发计划项目(2017YFC1702500);云南省重大科技专项(202102AE090042);云南省重大科技专项(202102AA310045);云南省重大科技专项(202102AA10005-02)
李满桥(1996—),男(白族),硕士,研究方向为三七种质资源评价与遗传改良。E-mail: 1415910330@qq.com
通信作者:杨生超,教授,博士生导师。E-mail: shengchaoyang@163.com
[责任编辑 崔艳丽]
