肾脏透明细胞癌与乏脂血管平滑肌脂肪瘤CT影像鉴别
2022-05-23叶玉冰王娇周宣合天津市第三中心医院放射科天津市重症疾病体外生命支持重点实验室天津市人工细胞工程技术研究中心天津市肝胆疾病研究所天津300170
叶玉冰 王娇 周宣合 天津市第三中心医院放射科,天津市重症疾病体外生命支持重点实验室,天津市人工细胞工程技术研究中心,天津市肝胆疾病研究所 (天津 300170)
内容提要: 目的:探究肾脏透明细胞癌(clear cell renal cell carcinoma,ccRCC)与乏脂血管平滑肌脂肪瘤(fat-poor angiomyolipoma,fp-AML)的动态增强CT表现以及鉴别诊断。方法:收集2019年3月~2021年11月就诊并术后病理证实的23例ccRCC患者和7例fp-AML患者,对其术前平扫及动态增强CT图像进行分析,评价肿瘤影像特征如囊变、假包膜、坏死出血、钙化,测量肿瘤实性部分在扫描各期CT值,计算皮质期强化率,进行独立样本t检验。结果:ccRCC患者CT影像上更易观察到假包膜、囊变坏死及钙化。平扫时ccRCC肿瘤平均CT值为(31.04±9.63)Hu,fp-AML肿瘤平均CT值为(37.57±2.99)Hu,两组平扫CT值差异有统计学意义(P<0.05)。增强扫描皮质期强化率ccRCC高于fp-AML肿瘤,两者差异具有统计学意义(P<0.05)。皮质期、实质期、排泄期各期CT值,ccRCC患者与fp-AML患者均无统计学差异(P>0.05)。结论:假包膜、囊变坏死及钙化的出现对肾透明细胞癌有诊断价值,而平扫时肿瘤的密度、增强扫描皮质期强化率对于ccRCC和fp-AML鉴别有进一步帮助。
肾脏透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾恶性肿瘤的最常见类型,最主要的治疗方式是手术切除。肾血管平滑肌脂肪瘤是肾脏常见的良性肿瘤(angiomyolipoma,AML),由厚壁血管、平滑肌及脂肪组织以不同比例组成,典型的AML因其含有肉眼明显可见的脂肪成分(CT平扫肿瘤内测得10Hu以下脂肪密度),诊断基本明确。当肿瘤内部脂肪成分肉眼无法识别时称为乏脂血管平滑肌脂肪瘤(fat-poor angiomyolipoma,fp-AML)[1],此种类型大部分可随访观察,但易与ccRCC混淆从而造成误诊。经报道约10%经手术切除的肾脏肿块病理证实为良性,其中肾血管平滑肌脂肪瘤约占18%~59%[2]。因此,本研究对23例ccRCC和7例fp-AML的CT进行回顾分析,探讨影像表现及鉴别诊断,以期帮助临床提高术前诊断。
1.资料与方法
1.1 临床资料
本研究收集2019年3月~2021年11月来本院就诊的23例ccRCC患者[男15例、女8例,平均年龄(63±8)岁]和7例fp-AML患者[男3例、女4例,平均年龄(57±7)岁]影像及临床资料,所有患者均经手术切除后病理证实。23例透明细胞癌患者和7例乏脂血管平滑肌脂肪瘤患者的一般临床资料统计结果如表1所示。ccRCC患者均为单侧肾脏肿瘤(左侧13例,右侧10例),其中16例为体检首次发现,7例伴有腰部不适,4例伴有肉眼或镜下血尿。fp-AML患者均为单侧(左侧3例,右侧4例),其中6例为体检发现,1例伴有腰部不适,2例伴有肉眼或镜下血尿。

表1. ccRCC 患者与fp-AML患者一般临床资料
1.2 方法
采用Siemens 32/128层螺旋CT扫描检查。扫描参数:管电压120kV,管电流200mA,重建层厚1~2mm,间隔1~2mm,用高压注射器经肘静脉团注对比剂碘海醇(300mg I/mL,1.5mL/kg,流速3mL/s)。患者在平静呼吸状态下屏气行4期扫描,平扫期、皮质期(打药后30~50s)、髓质期(打药后60~70s)、排泄期(打药后240~300s)。
1.3 观察指标
在PACS上分析图像CT征象,包括肿瘤是否囊变、假包膜、坏死出血、钙化。测量肿瘤实性部分各期CT值(测量面积控制在0.5~1cm2,避开大血管及囊变坏死区域,分三个不同位置测量后取平均值),计算肿瘤皮质期强化率[皮质期强化率定义为:(肿瘤皮质期CT值-肿瘤平扫CT值)/肿瘤平扫CT值],后行独立样本t检验。CT图像由两名从事腹部疾病诊断临床工作5年以上的医师阅片、对图像进行分析、测量,取两名医师测量值的平均值作为结果。
2.结果
2.1 ccRCC患者与fp-AML患者影像特征与各期CT值比较
23例ccRCC患者中出现7例(30.4%)囊变、11例(47.8%)假包膜、9例(39.1%)出血或坏死、2例(9.7%)钙化。7例fp-AML患者中囊变和钙化各出现1例(14.3%),坏死或出血出现2例(28.6%),未发现假包膜病例。部分患者CT图像如图1所示。
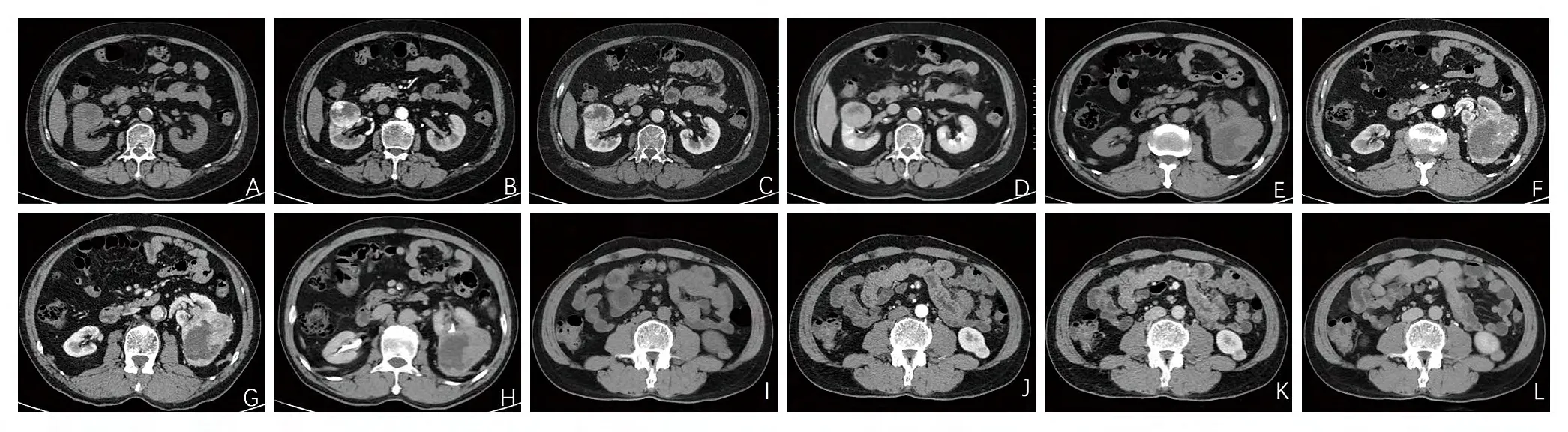
图1. 部分患者肾脏4期增强扫描CT图像(A-D为70岁男性ccRCC患者,右肾肿块于增强扫描可见不均匀强化,皮质期强化程度高于邻近正常肾皮质,实质期及排泄期肿瘤强化减退。E-H为另一位老年ccRCC患者,左肾可见外突肿瘤伴囊变,增强扫描实性成分不均匀明显强化。I-L为病理证实的fp-AML患者,男,52岁,左肾可见实性结节,未见脂肪密度,增强后皮质期CT值约134Hu,实质期肿瘤强化程度较皮质期明显减退)。
2.2 ccRCC患者与fp-AML患者影像特征与各期CT值
经统计肿瘤CT值后发现,23例ccRCC患者中13例患者肿瘤强化峰值出现在皮质期,7例fp-AML患者中有3例强化峰值出现在皮质期。平扫时ccRCC肿瘤平均CT值为(31.04±9.63)Hu,fp-AML肿瘤平均CT值为(37.57±2.99)Hu,fp-AML肿瘤平扫CT值略高于ccRCC肿瘤,其两组平扫CT值差异有统计学意义(P<0.05),见表2。增强扫描皮质期、实质期、排泄期各期CT值,ccRCC患者与fp-AML肿瘤患者均无统计学差异(P>0.05)。增强扫描皮质期强化率ccRCC肿瘤高于fp-AML肿瘤,两者差异具有统计学意义(P<0.05)。

表2. ccRCC 患者与fp-AML患者影像特征与各期CT值
3.讨论
根据WHO最新肾脏肿瘤分类,ccRCC是最常见的肾癌类型,AML是肾脏最常见的良性肿瘤[3]。AML因其含有大量成熟脂肪而易于诊断,特别是随着1988年薄层CT技术的应用推广进一步克服了厚层CT部分容积效应的影响,1.5~3mm层厚的薄层扫描能够更精确的发现肿瘤内10 Hu以下的小块脂肪组织[4]。但对于缺乏成熟脂肪组织的fp-AML来说,与ccRCC的影像鉴别诊断,仍是比较困难的课题[5]。目前,CT多期动态增强检查作为广泛应用于肾脏肿瘤的必备检查手段之一,可以提供更多诊断信息,对鉴别诊断有独特优势。
本研究中ccRCC患者CT图像可以观察到病灶密度多不均匀,更多出现囊变、坏死及钙化征象,这是由于肾透明细胞癌的恶性程度更高,而fp-AML作为良性肿瘤,生长缓慢,囊变、坏死更为少见[6]。同时本研究中ccRCC患者出现了11例假包膜,fp-AML患者中并未见到,我们认为假包膜对肾癌有一定的提示意义,这与文献报道中假包膜是鉴别ccRCC和fp-AML的独立因素相一致[6]。在大体标本上ccRCC与周围正常肾实质似有分界,但没有真正的包膜,CT增强图像上表现为ccRCC外周的低密度环,多是肿瘤在生长过程中对周围组织压迫形成,有时小病灶也可出现[7],可能与肾癌生长迅速,早期就压迫周围组织使其纤维化形成有关[8]。假包膜的存在被认为是肿瘤的早期阶段或病理等级较低,患者常被认为应该优选保留肾单位手术的挖除术[9]。
在CT值定量分析中,ccRCC患者组与fp-AML患者组平扫CT值差异有统计学意义(P<0.05),fp-AML肿瘤平扫CT值略高于ccRCC肿瘤,这与之前的研究结果相符[8]。之所以出现上述平扫CT值的差异,笔者认为与两者病理结构成分有关。平扫时fp-AML肿瘤与竖脊肌的CT值相似,因其构成是平滑肌组织、血管、少量或几乎不含脂肪成分[10],而透明细胞癌在CT平扫上常呈等或等低混杂密度影,因其病理构成是嗜酸性或胞浆透明肿瘤细胞,且多伴有上述提到的囊变、坏死等[11]。当然,仅从本研究看,必须承认本研究中收集的fp-AML病例样本数相对较少,上述结论需在更大样本量的研究中得以证实。另一方面,在动态增强扫描中,ccRCC患者与fp-AML肿瘤患者的皮质期、实质期、排泄期各期CT值均无统计学差异,说明单从各期强化CT值方面,两者鉴别诊断意义不大。但是本研究中皮质期强化率在两组患者中的差异具有统计学意义,增强扫描皮质期强化率ccRCC肿瘤高于fp-AML肿瘤。说明与平扫CT值相比较,ccRCC肿瘤皮质期CT值变化程度高于fp-AML肿瘤,这比单纯采用强化各期CT值,更能反映肿瘤本身强化程度,与文献报道ccRCC快进快出的强化方式相符[12]。此外,在以往的研究中,有报道称fp-AML患者组中病灶皮质期可以看到粗大畸形的肿瘤血管,而ccRCC肿瘤虽然血供丰富,在皮质期强化更加明显,但是很少见到增粗血管影,它的血供主要来组于间质部分丰富的毛细血管网[8]。这一征象本研究中没有观察到,值得在以后的临床研究中深入探讨。
综上所述,在ccRCC与fp-AML的鉴别诊断中,观察到假包膜、囊变坏死及钙化的出现对肾透明细胞癌有诊断价值,而平扫时的密度高低、增强扫描皮质期强化率对于两者鉴别有进一步帮助。这对临床良恶性鉴别及手术方式选择具有参考价值,但仍需在以后更大样本量的研究中进一步探索。
