TRIM31通过抑制NLRP3炎性小体通路改善蛛网膜下腔出血大鼠早期脑损伤
2022-05-23田密曾进聂伟李拥军刘晓君
田密 曾进 聂伟 李拥军 刘晓君
(湖南中医药高等专科学校附属第一医院神经内科,湖南 株洲 412000)
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)是世界上致死率和致残率均较高的一种中枢神经系统疾病,虽然显微外科技术发展迅速,但SAH患者的预后仍不令人满意。发生在SAH后72 h内的早期脑损伤(Early brain injury,EBI)是导致SAH患者死亡或不良预后的主要原因[1-2],而神经炎症被认为是SAH后EBI的重要病理过程[3]。因此,抑制炎症反应是减轻SAH后脑损伤的潜在治疗方法。作为机体先天免疫系统核心成分,含NLR家族Pyrin域蛋白3(NLR family pyrin domain containing 3,NLRP3)炎性小体介导的神经炎症对中枢神经系统疾病发生发展具有重要调控作用[4]。大量研究显示[5-6],抑制NLRP3炎性小体的激活可明显改善SAH后EBI。三结构域蛋白31(Tripartite motif containing 31,TRIM31)是一种具有E3泛素连接酶活性的蛋白,能够通过泛素-蛋白酶体途径促进底物降解,参与细胞凋亡、增殖、代谢等多种细胞生物学过程[7]。有研究表明[8],TRIM31是NLRP3炎性小体的抑制因子,能够与NLRP3直接结合并促进其泛素化降解。据此推测,TRIM31有可能通过抑制NLRP3炎性小体活化改善SAH后EBI,且目前相关研究鲜有报道。因此,本研究通过构建SAH大鼠模型,观察侧脑室注射TRIM31过表达慢病毒对大鼠SAH后EBI的影响,并探讨其对NLRP3炎性小体活化的影响。
1 材料与方法
1.1 实验动物 健康清洁级雄性SD大鼠60只,体质量280~320 g,鼠龄7~8周,由湖南昭泰生物医药有限公司提供,实验动物许可证号:SYXK(湘)2017-0004。实验前所有大鼠均进行1周环境适应,饲养于温度20~22℃,相对湿度50%~60%,12 h/12 h明暗交替的环境,自由饮水进食。本研究经过医院动物伦理委员会审核批准。
1.2 主要试剂及仪器 TRIM31过表达慢病毒及其阴性对照慢病毒质粒构建及慢病毒包装、浓缩和纯化均由汉恒生物工程(上海)有限公司完成;PrimeScriptTMRT reagent kit和SYBR®Premix Ex Taq Ⅱ试剂盒购自宝生物工程(大连)有限公司;TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;大鼠白介素1β(IL-1β)ELISA检测试剂盒和大鼠白介素18(IL-18)ELISA检测试剂盒均购自南京森贝伽生物科技有限公司;兔抗人NLRP3多克隆抗体购自武汉三鹰生物技术有限公司;兔抗人半胱天冬酶-1(Caspase-1)单克隆抗体购自英国Abcam公司;兔抗人TRIM31多克隆抗体购自美国Novus Biologicals公司;小鼠抗人凋亡相关斑点样蛋白(ASC)单克隆抗体、兔抗人GAPDH抗体多克隆抗体购自美国Cell Signaling Technology公司;脑立体定位仪购自美国Stoelting公司;Mk3酶标仪购自芬兰雷达公司。
1.3 方法
1.3.1 分组及SAH模型构建 将60只大鼠按照随机数字表法分为假手术组(sham组)、SAH模型组(SAH组)、阴性对照慢病毒干预组(Lv-NC组)和TRIM31过表达慢病毒干预组(Lv-TRIM31组),每组15只。采用血管内穿刺法[9]制备SAH大鼠模型:3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,取俯卧位,备皮消毒,沿颈部中线切开,依次暴露右颈总动脉、颈外和颈内动脉。采用动脉夹阻断颈外动脉和颈内动脉之间的吻合支,同时结扎并离断颈外动脉,3-0尼龙线由颈外动脉置入颈内动脉,缓慢进入颅内,有阻力感后继续前进3 mm,有空落感表示血管刺破成功,造成SAH,迅速拔出尼龙线,结扎颈外动脉残端,恢复血流,缝合并消毒伤口。其中sham组大鼠不刺破血管,其他各组均刺破血管。穿刺手术中以穿刺后无实质性脑损害的SAH或血凝块作为模型制备成功标准。术前24 h,采用脑立体定位装置经侧脑室注射慢病毒进行干预,Lv-TRIM31组大鼠经侧脑室注射10 μL TRIM31过表达慢病毒(1×108TU/mL),Lv-NC组大鼠经侧脑室注射10 μL 阴性对照慢病毒(1×108TU/mL),sham组和SAH组大鼠分别注射等量生理盐水。
1.3.6 ELISA检测 SAH造模后24 h,取部分海马组织,制备组织匀浆,4℃条件下12000×g离心10 min,收集上清,按照试剂盒说明书进行检测,采用酶标仪检测450 nm处吸光度值(OD值),根据标准曲线计算海马组织匀浆中IL-1β和IL-18水平。
1.3.3 脑组织含水量检测 SAH造模后24 h,从各组中随机取出5只大鼠,断颈处死并完整取出脑组织,去除脑膜并用滤纸清理表面血渍和积组织液体,称量整个脑组织质量为湿重,随后将其置于100℃烘箱内烘烤至恒重,再称量为干重。脑组织含水量=(湿重-干重)/湿重×100%。
1.3.2 神经功能评估 SAH造模后24 h,采用改良Garcia评分表[10]评估各组大鼠神经功能,该评分表包含6项内容:自发活动(0~3分)、四肢对称运动(0~3分)、前爪伸展活动(0~3分)、攀爬活动(1~3分)、身体本体感觉(1~3分)和触须反应(1~3分),总分3~18分,分数越低神经功能损伤越严重。
1.3.5 TUNEL染色 SAH造模后24 h,取部分海马组织,4%多聚甲醛固定24 h,石蜡包埋后切片、脱蜡,0.3% H2O2封闭30 min,滴加不含DNase的蛋白酶K(20 μg/ml)于37℃孵育15 min,PBS洗涤3次,滴加50 μL 生物素标记液置于37℃避光孵育60 min,PBS洗涤3次,滴加0.3 mL标记反应终止液,室温孵育10 min,PBS洗涤3次,滴加50 μL Streptavidin-HRP工作液,室温避光孵育30 min,PBS洗涤3次,滴加DAB显色液,室温避光孵育10 min,PBS洗涤3次,苏木素复染,梯度酒精复水,二甲苯透明,中性树脂封片,光学显微镜下观察,TUNEL染色阳性凋亡细胞核呈棕色。每张切片随机选取5个高倍镜视野计数500个细胞,以阳性细胞百分比表示细胞凋亡率。
1.3.4 qRT-PCR检测 SAH造模后24 h,取部分各组大鼠脑组织,并分离海马组织。取部分海马组织,采用Trizol法提取总RNA,测定总RNA浓度。采用PrimeScriptTMRT reagent kit将总RNA逆转录成cDNA,以cDNA为模板采用SYBR®PremixExTaqⅡ试剂盒进行PCR扩增反应。TRIM31,上游引物:5′-CCAG AGTCAAACCGTGAGC G-3′,下游引物:5′-GGCAACTTGGAGCCCGAA-3′;NLRP3,上游引物:5′-TGGG TTCTGGTCAGACACGAG-3′,下游引物:5′-GGCGG GTAATCTTCCAAATGC-3′;caspase-1,上游引物:5′-TGCCGTGGAGAGAAACA AGG-3′,下游引物:5′-CCCCTGACAGGATGTCTCCA-3′;GAPDH,上游引物:5′-GGTGGACCTCATGGCCTACAT-3′,下游引物:5′-GCCTCTCTC TTGCTCTCA GTATCCT-3′;ASC,上游引物:5′-GCCGAGCTCACCGCTAACG-3′,下游引物: 5′-CATCCAGCAGCC ACTCAACG-3′。PCR反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共40个循环。以GAPDH为内参,采用2-△△Ct法计算TRIM31、NLRP3、ASC和Caspase-1 mRNA相对表达水平。
镜头动作是微视频创作中的一种重要剪辑因素。它指因摄像机位置有目的的移动而带来和构成的镜头的运动变化。它是视频特有的艺术元素,剪辑时要尽可能的充分发挥其独特的功用[1]。专业拍摄中运动性镜头有推、拉、摇、移、跟等多种方式,各有特色和艺术感染力。比如推镜头,指对象位置不动,镜头与画面逐渐靠近,画面外框逐渐缩小,画面内的景物逐渐放大,使观众的视线从整体看到某一布局,引导观众更深刻地感受角色的内心活动,加强情绪气氛的烘托。再比如移镜头,指摄像机横向移动拍摄,可以把行动着的人物和景物交织在一起,形成一种富有流动感的拍摄方式,产生强烈的动感和节奏。
1.3.7 Western blot检测 SAH造模后24 h,取部分海马组织,加入适量RIPA细胞裂解液,冰上碾磨,4℃条件下12000×g离心20 min,收集上清,采用BCA法测定蛋白浓度。取30 μg蛋白样品沸水浴变性后上样,用10%的SDS-PAGE分离蛋白质并转移到PVDF膜,并用5%脱脂牛奶室温封闭1 h。分别加入TRIM31抗体(1:1000)、NLRP3抗体(1:1000)、ASC抗体(1:500)、Caspase-1抗体(1:1000)和GAPDH抗体(1:1000),置于4℃条件下孵育过夜。TBST洗膜3次,加入HRP标记的二抗室温孵育1 h,TBST洗膜3次,滴加化学发光液,显影。采用Image-Pro Plus6.0软件进行定量分析。
实验中将两组电池组分别置于高温和低温的情况下进行实验。考虑到两组电池组可能存在性能上的差异,所以在实验中将同组电池组进行了高温和低温的两组情况进行实验。表1为电池组不同温度下放电50%后的的剩余容量情况。
2.4 各组大鼠海马组织炎症因子IL-1β和IL-18含量 与sham组比较,SAH组细胞海马组织中IL-1β和IL-18含量升高(P<0.001);与SAH组比较,Lv-TRIM31组大鼠海马组织中IL-1β和IL-18含量降低(P<0.05),而Lv-NC组无显著性变化(P>0.05),见图4。

2 结果
2.3 各组大鼠海马神经元凋亡水平 与sham组比较,SAH组大鼠海马神经元凋亡水平升高(P<0.001);与SAH组比较,Lv-TRIM31组大鼠海马神经元凋亡水平降低(P<0.001),而Lv-NC组无显著性变化(P>0.05)。见图3。
式中,σ是随机力的标准差(或称为噪声振幅),γ是黏滞系数,也被称作摩擦因子,kB为Boltzmann因子,T为体系的绝对温度.
2.2 各组大鼠神经功能评分及脑组织含水量 与sham组比较,SAH组大鼠神经功能评分降低(P<0.001);脑组织含水量升高(P<0.01)。与SAH组比较,Lv-TRIM31组大鼠神经功能评分升高(P<0.001),脑组织含水量降低(P<0.05),而Lv-NC组无显著性变化(P>0.05)。见图2。

图2 各组大鼠神经功能评分及脑组织含水量比较Figure 2 Comparison of neurological score and brain water content in rats of various groups注:A. 神经功能评分;B. 脑组织含水量;与sham组比较,①P<0.01,②P<0.001;与SAH组比较,③P<0.05,④P<0.001
2.1 各组大鼠海马组织中TRIM31 mRNA和蛋白表达水平 与sham组比较,SAH组大鼠海马组织中TRIM31 mRNA和蛋白表达水平降低(P<0.05);与SAH组比较,Lv-TRIM31组大鼠海马组织中TRIM31 mRNA和蛋白表达水平升高(P<0.001),而Lv-NC组无显著性变化(P>0.05)。见图1。
1.利益困境。如前所述,现实主义国际合作观下阻碍国际合作有效开展的重要因素为国家利益趋向,在网络反恐中尤为突出。20世纪50年代至今,网络核心技术被发达国家垄断,发达国家在网络空间中拥有绝对话语权。发展中国家由于技术有限,被迫受制于发达国家,很难发挥自己对网络空间的主导权。发达国家甚至利用自身技术优势,在政治、经济、文化等各领域对发展中国家进行干预,威胁发展中国家利益,这种利益归属不同,导致在网络反恐中很难有实质性的合作。

图3 TUNEL染色(200×)Figure 3 TUNEL staining
第一,依据是“改写世界历史”。马克思主义唯物史观认为,一切社会的历史都是阶级斗争的历史。阶级斗争既创造了历史,又改写了历史。《共产党宣言》宣告了超越资本主义文明的一个基本前提,就是全面、彻底地反省资本主义对于人类历史所具有的“超出之前全部历史总和”的伟大革命作用。马克思恩格斯也肯定了资产阶级革命作用。这个作用就是改写世界历史。[6]P106

图4 各组大鼠海马组织中IL-1β和IL-18水平比较Figure 4 Comparison of the levels of IL-1βand IL-18 in hippocampus tissues of rats in various groups
2.5 各组大鼠海马组织中NLRP3、ASC和Caspase-1表达水平 与sham组比较,SAH组细胞海马组织中NLRP3、ASC和Caspase-1等蛋白表达水平升高(P<0.001)。与SAH组比较,Lv-TRIM31组大鼠海马组织中NLRP3、ASC和Caspase-1等蛋白表达水平降低(P<0.05),而Lv-NC组无显著性变化(P>0.05),见图5。
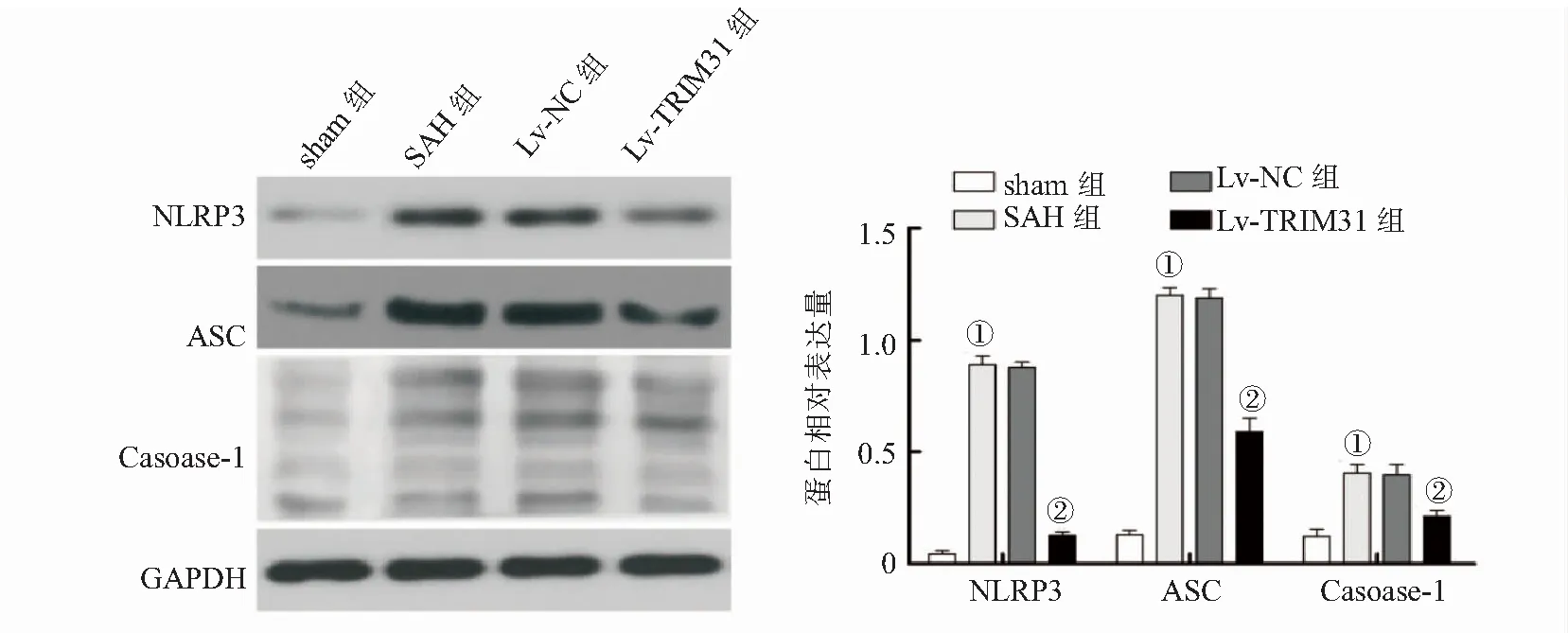
图5 各组大鼠海马组织中NLRP3、ASC和Caspase-1蛋白表达水平比较Figure 5 Comparison of the protein expression levels of NLRP3,ASC and Caspase-1 in hippocampus tissues of rats in various groups
3 讨论
TRIM31是TRIM蛋白家族新成员,属于环状E3泛素连接酶,含有三个典型的结构域即锌指结构域、B-Box结构域和卷曲螺旋结构域,可通过介导底物蛋白泛素化降解而发挥作用[11]。目前,有关TRIM31的研究主要集中在肿瘤领域,Xiao等[12]研究显示,TRIM31通过激活Wnt/β-catenin信号通路促进急性髓性白血病的发展及其柔红霉素的耐药性;Shi等[13]研究称,TRIM31通过激活Akt信号通路促进神经胶质瘤细胞增殖、侵袭与转移。此外,也有研究表明[14],TRIM31表达下调与小鼠葡萄糖代谢受损和肠道微生物群紊乱有关。然而,TRIM31与神经炎症介导的中枢神经系统疾病之间的研究鲜有报道,且目前也未有研究探讨TRIM31对SAH后早期脑损伤的影响。本研究结果发现,经侧脑室注射TRIM31过表达慢病毒可通过抑制NLRP3炎性小体通路介导的炎症反应减轻SAH大鼠早期脑损伤。
SAH后血脑屏障中断导致脑水肿,随后出现脑肿胀、颅内压升高、神经元死亡和神经功能缺损。既往研究表明[2],SAH后神经元凋亡和脑组织水肿是EBI的两个主要病理过程。本研究通过侧脑室注射TRIM31过表达慢病毒对SAH大鼠进行干预,结果发现SAH大鼠海马组织中TRIM31 mRNA和蛋白表达水平较sham组降低,说明TRIM31异常表达可能对SAH发展有影响。TRIM31过表达慢病毒干预后,SAH大鼠海马组织中TRIM31 mRNA和蛋白表达水平升高,说明成功介导SAH大鼠海马组织中TRIM31基因过表达。随后,本研究对大鼠神经行为学及病理学进行研究,结果显示,SAH大鼠神经功能评分降低,脑组织含水量和海马神经元凋亡水平升高,说明本研究构建的SAH大鼠模型出现了比较明显的EBI,与他人研究结果一致[15-16]。TRIM31过表达慢病毒干预后,SAH大鼠神经功能评分升高,脑组织含水量和海马神经元凋亡水平降低,说明TRIM31过表达可改善大鼠SAH后EBI。
神经炎症是决定许多神经系统疾病进展的重要因素,其所致脑损伤是SAH后EBI的重要病理机制[3,17]。NLRP3炎性小体是机体先天免疫系统核心成分,在神经炎症反应中发挥重要调节作用。NLRP3炎性小体是细胞内重要的多蛋白复合物,由NLRP3、ASC和caspase-1构成,可引导对致病性刺激的先天免疫应答,对caspase-1进行自身活化,促进IL-1和IL-18的成熟及分泌,以及诱导细胞死亡[18-19]。大量研究显示[5,6,20],NLRP3炎性小体在SAH后EBI过程中被激活,抑制NLRP3炎性小体活化可改善SAH后EBI。而有研究显示[8,21],TRIM31能够促进NLRP3蛋白泛素化降解,抑制NLRP3炎性小体的活化及IL-1和IL-18的分泌。王涛等[22]研究证实,TRIM31过表达可通过抑制NLRP3炎症小体活化,改善脂多糖诱导的神经细胞PC12的炎性损伤。因此,TRIM31过表达对大鼠SAH后EBI的改善作用机制可能与抑制NLRP3炎性小体活化有关。为进一步证实,本研究对大鼠海马组织中NLRP3炎性小体复合物蛋白NLRP3、ASC和caspase-1以及相关炎症因子IL-1和IL-18的表达水平进行了检测,结果显示SAH大鼠海马组织中NLRP3、ASC和caspase-1 mRNA和蛋白表达水平以及海马组织匀浆中IL-1和IL-18水平较sham组升高,说明SAH后EBI过程中NLRP3炎性小体确实被激活。而TRIM31过表达慢病毒干预后,SAH大鼠海马组织中NLRP3、ASC和caspase-1 mRNA和蛋白表达水平以及海马组织匀浆中IL-1和IL-18水平均降低,表明TRIM31过表达可抑制NLRP3炎性小体相关蛋白的表达及活化。
在此次研究中,实验组的治疗依从性评分为(19.56±1.28)分,参照组的治疗依从性评分为(14.15±1.40)分,实验组患者平均住院(5.55±0.49)天,参照组患者平均住院(9.57±0.94),结果存在统计学差异性,实验组患者的服务态度评分平均是(4.26±0.45)分、健康宣教评分平均是(4.90±0.30)分;参照组患者为(3.09±0.44)分、(2.90±0.30),两组结果对比存在统计学差异性(P<0.05)。说明使用优质护理能够让肾小球肾炎患者的临床病情得到改善,提升患者的满意度。
4 结论
本研究初步阐明TRIM31过表达可改善SAH后EBI,其机制可能与NLRP3炎性小体活化被抑制有关。鉴于TRIM31能够促进NLRP3蛋白泛素化降解已被其他学者证实,故本研究中未在动物水平再次进行证实,今后本课题组将继续深入研究TRIM31在SAH进程中的作用与功能,以期为SAH临床治疗提供更全面的理论依据。
