新冠肺炎患者和细菌性肺炎患者血清差异表达的细胞因子特征分析
2022-05-23罗斯威姚亚超钟丽梅胡亮杉肖威方晓琳曹东林
罗斯威 姚亚超 钟丽梅 胡亮杉 肖威 方晓琳 曹东林
【摘要】 目的 了解新型冠状病毒肺炎(新冠肺炎)患者与细菌性肺炎患者细胞因子的差异,探讨新冠肺炎免疫病理机制,为新冠肺炎提供新的治疗靶点。方法 收集轻型新冠肺炎患者(新冠肺炎组)、细菌性肺炎患者(细菌性肺炎组)和健康志愿者(健康对照组)3组各15份血清标本,进行48种细胞因子的检测,比较3组间细胞因子表达谱的差异。检测10例新冠肺炎患者在治疗不同时间点的血清标本中48种细胞因子表达,分析其与新冠肺炎患者的临床特征及疾病进展的相关性。结果 新冠肺炎组与细菌性肺炎组比较中,巨噬细胞迁移抑制因子(MIF)、生长调节致癌基因α(GROα)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)和TNF-β在新冠肺炎组中上调(P均< 0.05)。而 IL-10、IL-18、IL-2受体α和IFN-γ诱导的单核细胞因子(MIG)在细菌性肺炎组中上调(P均< 0.05)。巨噬细胞集落刺激因子(M-CSF)在新冠肺炎患者住院治疗的第2周有明显的下调;单核趋化蛋白-1(MCP-1)的变化与新冠肺炎患者的核酸检测结果变化一致。结论 新冠肺炎患者和细菌性肺炎患者体内存在不同的细胞因子表达谱。M-CSF和MCP-1在新冠肺炎疾病进展中起着重要作用。
【关键词】 新型冠状病毒肺炎;细菌性肺炎;细胞因子;表达谱
【Abstract】 Objective To investigate the differences of cytokine profiles between patients with novel COVID-19 and bacterial pneumonia, unravel the immunopathological mechanism of COVID-19, and provide evidence for new therapeutic targets in COVID-19. Methods In this study, 15 serum samples were collected from mild COVID-19 patients (COVID-19 group), bacterial pneumonia patients (bacterial pneumonia group), and healthy controls (healthy control group), respectively. The expression profile of 48 cytokines was determined to clarify the differences among three groups. The expression levels of 48 cytokines at different time points were measured in serum samples from 10 patients with COVID-19 to analyze their correlation with clinical features and disease progression. Results In the comparation between the COVID-19 group and the bacterial pneumonia group, the expression levels of MIF, GROα, GM-CSF and TNF-β were upregulated in COVID-19 patients(all P < 0.05), whereas those of IL-10, IL-18, IL-2Rα and MIG were upregulated in patients with bacterial pneumonia(all P < 0.05). The expression level of M-CSF was significantly downregulated in COVID-19 patients at the second week of hospitalization. The changes in the expression level of MCP-1 were consistent with the nucleic acid test results of COVID-19 patients. Conclusions The cytokine profiles differ between patients with COVID-19 and bacterial pneumonia. In addition, M-CSF and MCP-1 play critical roles in the progression of COVID-19.
【Key words】 COVID-19; Bacterial pneumonia; Cytokine; profile
在全球范围内传播的新型冠状病毒肺炎(新冠肺炎)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的。该病毒是冠状病毒科的一种单链RNA病毒,主要感染呼吸道和肠道,引起多种症状[1]。虽然大多数新冠肺炎患者仅有轻微或中度的症状,但也有一部分患者会发展为严重的肺炎乃至需要机械通气的ARDS[2]。人类感染SARS-CoV-2的发病机制尚不清楚。目前尚未有针对该病毒的特效抗病毒药物,因此该病的治疗主要集中在对症治疗和氧疗[3]。免疫功能是对侵入性病原体的强有力防御。机体受感染后,体内活跃的免疫反应被描述为细胞因子风暴,表现为分泌大量的促炎细胞因子及趋化因子。细胞因子风暴综合征(CSS)可由多种疾病引起,在临床上CSS通常表现为全身炎症,MODS和炎症因子水平迅速大幅度升高[4]。新冠肺炎患者体内存在的CSS与包括ARDS在内的广泛组织损伤有关[5]。然而其与普通细菌性肺炎致病机制之间的差异仍未阐明。本研究选择调控细胞间信号通路并在炎症、急性或慢性疾病中发挥重要作用的48种细胞因子,评价新冠肺炎患者和细菌性肺炎患者、健康人的细胞因子特征差异,以明确新冠肺炎与细菌性肺炎细胞因子表达谱间的差异,为开展针对性防控新冠肺炎提供科學理论依据。
材料与方法
一、研究对象
选择2020年1月24日至3月6日在广东省第二人民医院住院治疗的15例轻型新冠肺炎患者(新冠肺炎组),共收集其住院前和住院后不同时间点的57份血清样本,该批样本均为常规生化检查后的剩余血清样本。诊断标准依据《新冠肺炎诊疗方案》(试行第五版):SARS-CoV-2核酸检测阳性,有发烧、干咳等临床表现,且CT显示肺部有毛玻璃状阴影。收集同期住院的15例细菌性肺炎患者(细菌性肺炎组),诊断标准为:SARS-CoV-2核酸检测阴性,有肺炎临床表现且痰液或血液培养出革兰阳性或阴性菌。收集同期15名健康志愿者(健康对照组),入组标准为:SARS-CoV-2核酸检测阴性,无任何不适。本研究经广东省第二人民医院伦理委员会批准(批件号:2021-KZ-141-01),所有患者均已签署知情同意书。
二、标本处理及48种细胞因子检测
非抗凝血的收集步骤:3500转/分离心5 min,在离体6 h内收集常规生化检查后的剩余血清样本,冻存于−20℃备用。采用细胞因子48-plex筛选检测试剂盒以液相芯片法检测48种细胞因子,按试剂盒说明书要求操作。在比较3组间差异表达的细胞因子时,新冠肺炎组与细菌性肺炎组均使用入院后首次采集的血清标本。从新冠肺炎组15例患者中选取动态血清数据较为完善的10例,收集其治疗不同时间点的血清标本检测48种细胞因子,分析其水平与新冠肺炎患者的疾病进展间的相关性,并从10例中选取3例,收集其核酸由阳性转为阴性的动态追踪的血清样本共24份,分析细胞因子与新冠肺炎患者的疾病进展和细胞因子特征之间的相关性。
三、统计学处理
使用Graphpad 8.0处理数据。3组受检者的血清细胞因子水平采用Kruskal-Wallis H检验,若组间比较差异有统计学意义,再采用Nemenyi检验。新冠肺炎患者治疗不同时间点的统计采用重复测量资料的方差分析,同一患者治疗前和治疗后第2周的数据采用配对t检验。检验水准:α= 0.05。
结 果
一、3组受检者的临床特征
新冠肺炎组中,男9例、女6例,年龄(42.7± 15.7)岁,淋巴细胞绝对值为(1.48±0.61)×109/L,3例合并基础性疾病,分别为糖尿病、COPD和慢性肝脏疾病,初始症状主要为发烧、干咳、咳痰、气促、咽痛、肌痛和腹泻。细菌性肺炎组中,男9例、女6例,患者年齡(69.0±24.0)岁,淋巴细胞绝对值为(1.28±0.67)×109/L,9例合并基础性疾病,分别为高血压、糖尿病、COPD、慢性心力衰竭和脑梗死等多种疾病。健康对照组中,男8名、女7名,志愿者年龄(55.8± 15.0)岁,淋巴细胞绝对值为(2.09±0.58)×109/L。
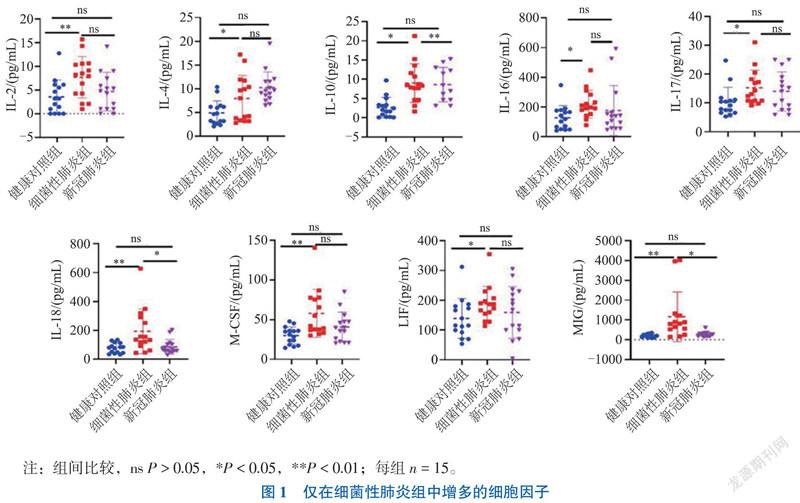
二、仅在细菌性肺炎组中增多的细胞因子
与健康对照组比较,IL-2、IL-4、IL-10、IL-16、IL-17、IL-18、巨噬细胞集落刺激因子(M-CSF)、白血病抑制因子(LIF)和IFN-γ诱导的单核细胞因子(MIG)仅在细菌性肺炎组中升高(P均< 0.05),而在新冠肺炎组中未见升高(P均> 0.05),见图1。
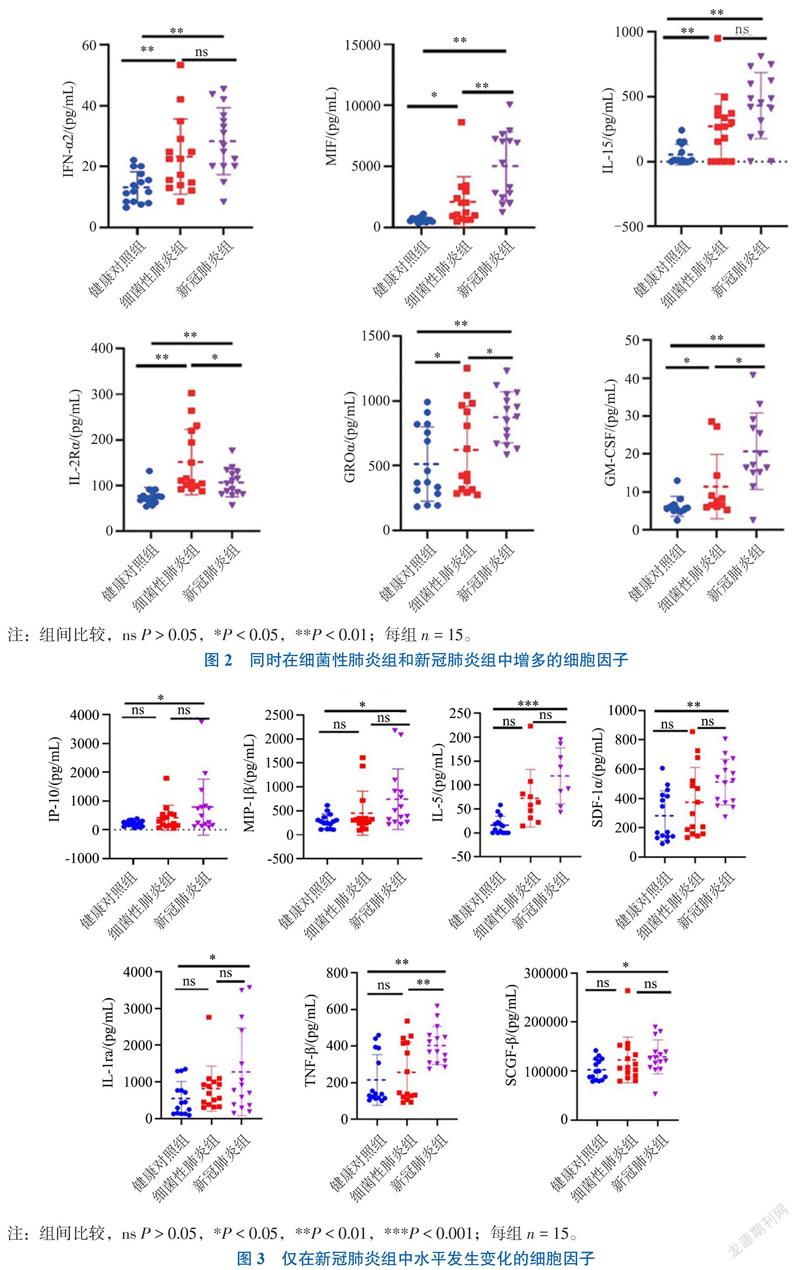
三、同时在细菌性肺炎组和新冠肺炎组中增多的细胞因子
与健康对照组比较,IFN-α2、巨噬细胞迁移抑制因子(MIF)、IL-15、IL-2受体α(IL-2Rα)、生长调节致癌基因α(GROα)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)同时在细菌性肺炎组和新冠肺炎组中升高(P均< 0.05),见图2。
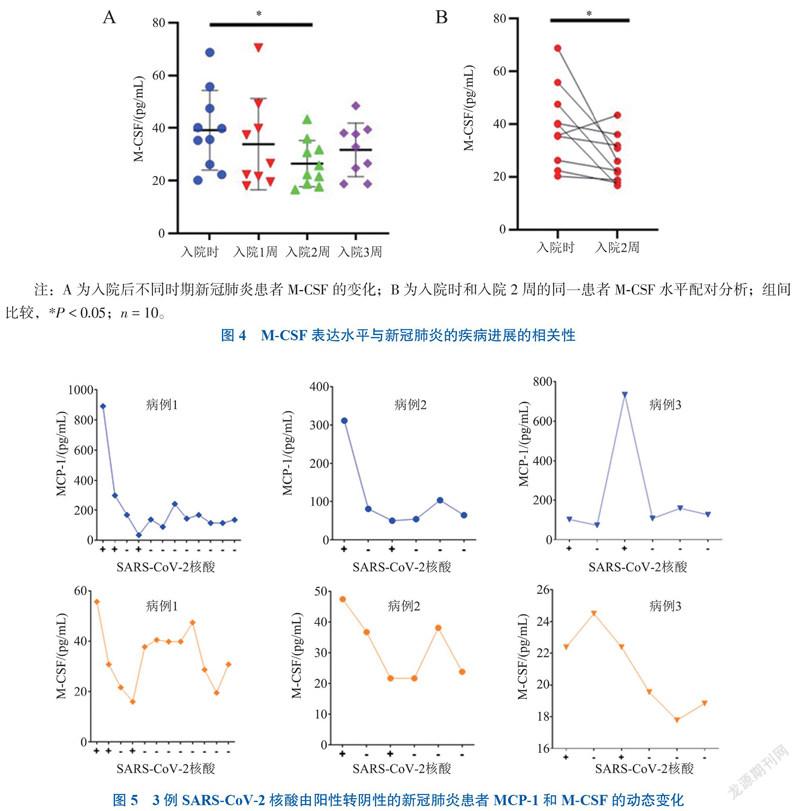
四、仅在新冠肺炎组中水平发生变化的细胞因子
与细菌性肺炎及健康对照组比较,IFN-γ 诱导蛋白10 (IP-10)、巨噬细胞炎症蛋白-1 β(MIP-1β)、IL-5、基质细胞衍生因子-1α(SDF-1α)、IL-1受体拮抗剂(IL-1ra)、TNF-β和干细胞生长因子-β(SCGF-β)等细胞因子仅在新冠肺炎组中升高(P均< 0.05),见图3。
五、细菌性肺炎组和新冠肺炎组差异表达的细胞因子
新冠肺炎组与细菌性肺炎组的比较中,MIF、GROα、GM-CSF和TNF-β 在新冠肺炎组中上调(P均< 0.05),而 IL-10、IL-18、IL-2Rα和 MIG在细菌性肺炎组中上调(P均< 0.05),见图1~3。
六、新冠肺炎组中与疾病进展相关的细胞因子
新冠肺炎组中,与治疗前相比,M-CSF的含量在治疗第2周下降。在SARS-CoV-2核酸转阴的进程中先下降随后维持在一定水平;单核趋化蛋白-1(MCP-1) 的含量与SARS-CoV-2核酸阳性有关,即在SARS-CoV-2核酸转阴的进程中MCP-1水平逐渐下降,见图4。3例核酸由阳性转阴性的新冠肺炎患者 MCP-1和 M-CSF 的动态变化见图5。
讨 论
新冠肺炎发病过程中(尤其是危重症患者)会出现的许多症状和相关病理过程,均是由细胞因子和CSS引发的。在危重症患者中,免疫反应可能失控,因此细胞因子暴发类似于继发性噬血细胞淋巴组织细胞增生症,可能导致MODS,如果救治不及时,可造成患者死亡[6]。结合抗菌药物和免疫疗法的治疗策略可能会产生更好的效果[7-8]。因此,本研究期望寻找新冠肺炎区别于细菌性肺炎的发生机制,阐明与新冠肺炎发病及与其病程密切相关的细胞因子,为后续开发加强抗病毒免疫和避免过度炎症损害的免疫调节疗法,以防止或减少导致器官损伤和疾病进展的细胞因子释放的策略提供更多的证据。
本研究根据国家卫生健康委员会SARS-CoV-2诊疗方案(试行第五版)纳入了15例轻型新冠肺炎患者,并详细分析了其血清细胞因子和趋化因子的变化。细胞因子在SARS-CoV-2感染的病理生理学中起着重要作用,已有报道IL-2、sIL-2Rα、IL-7、MCP-1、M-CSF、IFN-γ等多个细胞因子在SARS-CoV-2、SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)感染患者中升高[9-10]。本研究显示,与健康对照组相比,入院时新冠肺炎组患者I型IFN中的IFN-α2、LIF、MIF、IL-5、IL-15、SDF-1α等13种细胞因子升高。既往文献报道,重型新冠肺炎患者均存在CSS,2组间大部分细胞因子在发病不同阶段水平相当[11]。本研究表明,轻型新冠肺炎患者体内也存在CSS。本研究所分析的新冠肺炎或者细菌性肺炎患者血清均为入院后首次采集的治疗前的血清标本,新冠肺炎采血前患者未给予肾上腺皮质激素、静脉注射Ig或利巴韦林等免疫调节剂。本研究的轻型新冠肺炎患者中并没有出现IL-1、IL-6和TNF-α的上调,提示包括IL-1、IL-6和TNF抑制剂的抗细胞因子疗法不适用于轻型新冠肺炎患者。上述特异改变的细胞因子有可能作为细菌性肺炎和新冠肺炎的鉴别诊断标志物,此外对于合并细菌性肺炎感染的新冠肺炎患者的免疫治疗具有一定的指导意义。
有研究者发现,新冠肺炎患者的IL-6水平可根据疾病的严重程度而有所不同[12]。文献报道,使用妥珠单抗即IL-6受体的抗体治疗新冠肺炎患者的效果差,并且没有阻止其进展为继发性噬血细胞淋巴组织细胞增多症[13]。这表明IL-6可能是疾病进展的主要指标,但并不是唯一的驱动因素。与之相反的是,本研究中轻型新冠肺炎患者血清中IL-6未出现统计学意义的上调,可能是样本量差异,或者可能是不同亚型病毒导致的细胞因子改变情况不一致。阻断IL-6受体的抗体妥珠单抗,用于临床治疗轻型新冠肺炎患者的免疫抑制疗法值得商榷。笔者在比较新冠肺炎和细菌性肺炎2组细胞因子差异时发现,MIF、GROα、GM-CSF和TNF-β在新冠肺炎组有较高的表达水平,而 IL-10、MIG、IL-2Rα和IL-18 在细菌性肺炎中有较高的表达水平,提示这些细胞因子在不同类别病原微生物导致的肺炎中的免疫致病机制和机体反应存在差异。
本研究进一步分析了上述细胞因子是否可以用来预测新冠肺炎的疾病进展,应用新冠肺炎患者住院治疗的不同时期收集的连续血清标本分析细胞因子在个体疾病进展中的动态变化。其中有3例患者的血标本收集时间点较多,与核酸检测结果配合,可用于监测细胞因子在病毒核酸转阴过程中细胞因子的动态变化。结果显示MCP-1在核酸检测结果从阳性变为阴性的过程中明显下降。这与之前报道MCP-1在新冠肺炎和SARS等疾病急性期早期迅速升高,并随着疾病进展逐渐降低结论一致,进一步证实MCP-1与新冠肺炎患者的疾病进展相关[14-15]。
目前对人类感染SARS-CoV-2发病机制提出的假说认为重型新冠肺炎患者经历3个临床阶段:病毒血症期、急性期和恢复期。急性期大约为发病后第7~14日,急性期患者病情加重,中性粒细胞、D-二聚体、血尿素氮和血清肌酐水平升高[16]。有文献报道M-CSF水平在轻型新冠肺炎患者中升高,但并未详细分析治疗后第2周的改变情况,也没有分析M-CSF动态变化与临床特征的相关性[11]。本研究中,轻型新冠肺炎患者的M-CSF水平在住院治疗第2周出现下降,推测新冠肺炎患者治疗第2周M-CSF处于抑制状态,随后恢复期患者血清中M-CSF水平增高,维持到一定水平后发挥免疫调节作用。提示M-CSF可用于监测新冠肺炎患者的病程,并可用于新冠肺炎疾病疗效评估。有学者对感染SARS-CoV-2早期康复者的单细胞RNA序列分析结果表明,IL-1β和M-CSF可能是与细胞因子风暴相关的炎症反应新介质[17]。本研究结果加深了对SARS-CoV-2感染的免疫病理机制的理解,并提出了使用针对这些细胞因子特别是M-CSF这一新的免疫调节剂治疗策略。
综上所述,本研究分析了新冠肺炎患者和细菌性肺炎患者鉴别诊断的标志物,与SARS-CoV-2感染病程密切相关的细胞因子MCP-1和M-CSF有望成为新冠肺炎病情监测的标志物。
参 考 文 献
[1] Zheng J. SARS-CoV-2: an emerging coronavirus that causes a global threat. Int J Biol Sci, 2020, 16(10): 1678-1685.
[2] Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med, 2020, 8(5): 475-481.
[3] Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis, 2020, 71(15): 732-739.
[4] Tisoncik J R, Korth M J, Simmons C P, et al. Into the eye of the cytokine storm. Microbiol Mol Biol Rev, 2012, 76(1): 16-32.
[5] Vaninov N. In the eye of the COVID-19 cytokine storm. Nat Rev Immunol, 2020, 20(5): 277.
[6] 嚴丽,李永胜.新型冠状病毒肺炎重症患者的识别和处理策略.新医学,2020,51(3): 161-167.
[7] Nile S H, Nile A, Qiu J, et al. COVID-19: pathogenesis, cytokine storm and therapeutic potential of interferons. Cytokine Growth Factor Rev, 2020, 53: 66-70.
[8] Li H, Zhou Y, Zhang M, et al. Updated approaches against SARS-CoV-2. Antimicrob Agents Chemother, 2020, 64(6): e00483-e00420.
[9] Hadjadj J, Yatim N, Barnabei L, et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science, 2020, 369(6504): 718-724.
[10] Liu J, Li S, Liu J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. EBioMedicine, 2020, 55: 102763.
[11] Yang Y, Shen C, Li J, et al. Plasma IP-10 and MCP-3 levels are highly associated with disease severity and predict the progression of COVID-19. J Allergy Clin Immunol, 2020, 146(1): 119-127.
[12] Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet, 2020, 395(10229): 1054-1062.
[13] Radbel J, Narayanan N, Bhatt P J. Use of tocilizumab for COVID-19-induced cytokine release syndrome: a cautionary case report. Chest, 2020, 158(1): e15-e19.
[14] Huang K J, Su I J, Theron M, et al. An interferon-gamma-related cytokine storm in SARS patients. J Med Virol, 2005, 75(2): 185-194.
[15] Azkur A K, Akdis M, Azkur D, et al. Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. Allergy, 2020, 75(7): 1564-1581.
[16] Lin L, Lu L, Cao W, et al. Hypothesis for potential pathogenesis of SARS-CoV-2 infection — a review of immune changes in patients with viral pneumonia. Emerg Microbes Infect, 2020, 9(1): 727-732.
[17] Wen W, Su W, Tang H, et al. Immune cell profiling of COVID-19 patients in the recovery stage by single-cell sequencing. Cell Discov, 2020, 6: 31.
(收稿日期:2021-11-09)
(本文編辑:林燕薇)
