哈茨木霉和葡萄座腔菌对亚甲基蓝染料的脱色试验初报
2022-05-22魏鸿锦吴林应尚晓静侯瑞
魏鸿锦 吴林应 尚晓静 侯瑞








摘 要 以女贞树树干上分离、纯化得到的哈茨木霉Trichoderma harzianum菌株(B7)和从杨树树干上分离、纯化得到的葡萄座腔菌Botryosphaeria dothidea菌株(N38)为对象。研究了2种菌株产生的3种木质素降解酶:漆酶(laccase,Lac)、木质素过氧化物酶(lignin peroxidase,LiP)和锰过氧化物酶(manganese peroxidase,MnP)的活性。结果显示,B7在培养第6 d时Lac活性最大,达到13.3 U·L-1,同时MnP活性也达到11.29 U·L-1,LiP在培养第8 d活性达到峰值为5.24 U·L-1;N38在培养第8 d时MnP活性最大,达到16.53 U·L-1,同时Lac活性也达到9.27 U·L-1,LiP在培养第6 d活性达到峰值为5.24 U·L-1。通过染料固体培养基进行预脱色筛选,发现2个菌株对亚甲基蓝脱色效果最佳。菌株B7对亚甲基蓝的脱色优化结果为20.0 g·L-1葡萄糖、1.0 g·L-1硝酸钠、1.0 g·L-1硫酸锌、pH3.0、装液量10.0 mL;菌株N38对亚甲基蓝的脱色优化结果为20.0 g·L-1葡萄糖、1.0 g·L-1氯化铵、1.0 g·L-1硫酸镁、pH7、装液量30.0 mL。
关键词 哈茨木霉;葡萄座腔菌;亚甲基蓝;脱色优化;木质素降解酶
中图分类号:Q948.12+2.3 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.07.019
亚甲基蓝(Methylene blue)是一种噻嗪类染料,已被广泛应用于纺织品和纸张的染色。其污水已被证实可引发多种疾病,如休克、黄疸、组织坏死、呕吐、眼灼伤、恶心、头晕等[1]。因此,如何高效处理染料废水,已成为全世界关注的主要问题之一[2]。目前处理染料废水的方法主要分为物理法、化学法和生物法3类[3]。其中生物法运行成本低,绿色环保,具有较大的研究价值。现有研究显示,具有脱色染料功能的生物有细菌、真菌和藻类等[4]。杨春霖研究发现黄丝衣霉菌(Byssochlamys Fulva)对亚甲基蓝染料废水具有良好的脱色效果[5];张桐等人研究的一栓孔菌ZT-197(Trametes versicolor)对亚甲基蓝染液的脱色率高达98%[6]。
木质素降解酶作用是生物脱色的主要机制,木质素降解酶包括:漆酶(laccase,Lac)、木质素过氧化物酶(lignin peroxidase,LiP)和锰过氧化物酶(manganese peroxidase,MnP)[7]。漆酶具有较强的氧化还原能力,可对多种染料进行脱色[8],木质素过氧化物酶和锰过氧化物酶是两种常见的过氧化物酶,能够有效分解木质素和多种有机物[9]。木霉菌是目前产纤维素酶量最高的菌株,能够有效降解纤维素[10-11]。有效利用纤维素酶,将纤维素转化成人类可利用的能源十分重要[12]。
本试验从女贞树树干上分离得到菌株B7,从杨树树干上分离得到菌株N38,并对其进行固体脱色筛选。菌株B7、N38对孔雀石绿、亚甲基蓝的脱色效果均为明显。在进行固体培养基脱色筛选时,两株菌株在添加孔雀石绿染料的培养基里生长速度明显慢于其他染料培养基,因此选择对亚甲基蓝进行脱色优化试验。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株
N38、B7菌株均来源于贵州大学校园内杨树、女贞树枝干,通过真菌分离法获得,于4 ℃冰箱中保存备用。
1.1.2 培养基
PD培养基:马铃薯200 g,蒸馏水1 000 mL;PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、一次蒸馏水1 000 mL;PDB培养基:马铃薯200 g、葡萄糖20 g、蒸馏水1 000 mL;碳源筛选培养基:添加可溶性淀粉、麦芽糖、葡萄糖、麦芽糖、果糖作为碳源,分别添加20 g·L-1至PD培养基中,pH未调节;氮源筛选培养基:添加硝酸钠、氯化铵、硫酸铵、蛋白胨、尿素作为氮源,分别添加1.0 g·L-1至PDB培养基中,pH未调节;金属源筛选培养基:添加硫酸锌、硫酸钾、硫酸铁、硫酸镁、硫酸锰作为金属源,分别添加1.0 g·L-1至PDB培养基中,pH未调节。
1.1.3 染料與试剂
活性染料:活性黑、活性红;碱性染料:孔雀石绿、亚甲基蓝、刚果红、结晶紫;酸性染料:铬黑T。次氯酸钠溶液、无水乙醇、75%酒精、蒸馏水。
1.2 方法
1.2.1 菌株形态学鉴定
在超净工作台中,用9 mm的无菌打孔器截取已活化的菌株B7、N38的菌柄至新的PDA固体培养基上,在28 ℃恒温箱中避光培养,记录菌落的生长情况(形态、直径)[13]。培养6 d后,用光学显微镜进行形态学观察、鉴定,参照《真菌鉴定手册》[14]。
1.2.2 菌株分子生物学鉴定
提取菌株的DNA时使用Plant Direct PCR Kit (Finnzymes,Finland)真菌DNA提取试剂盒,通过PCR扩增得到引物ITS1和ITS4[15]。并送至重庆擎科兴业生物技术有限公司进行测序。同时从NCBI获得相关可靠的结果进行比对,利用MEGA7.0对上述分子序列进行多序列比对,采用MEGA7.0中邻接法(Neighbor joining,NJ)构建系统进化树,并结合菌株的形态特征证实该菌株的物种种类[16]。
1.2.3 菌株B7、N38漆酶、木质素过氧化物酶和锰过氧化物酶活性测定
将70 mL PDB分别装入250 mL的三角瓶中,高温下用低压的热蒸汽在每个灭菌锅121 ℃下,灭菌30 min后在每个新的三角瓶内分别重新接入4片菌柄(d=9 mm)后并置于每一个新的三角瓶中,置于28 ℃下的恒温中心后进行一次避光灭菌培养,将第2 d、4 d、6 d、8 d和10 d的发酵液吸取1.0 mL,再将其进行5 min转速为7 000 r·min-1的离心,然后用紫外分光光度计测定其酶活性。
Lac活性测定[17-18]:将PH值为5的1.95 mL羟基柠檬酸-羟基磷酸氢二钠缓冲液、1.0 mmol·L-1 2,2′-联氮-双-3-乙基苯并噻唑-6-磺酸[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]和0.05 mL的上清发酵液置于30℃的电热水浴中3 min后,测定它在3 min内420 nm处的强度吸光剂在照射下的强度及其值的变化改变,每个测定过程及其中的吸光处理均需要重复3次。一个氧化酶的生物活力学计量单位(U)被定义为每分钟可以通过酶催化底物氧化1.0 μmol ABTS底物时所需酶的总数量(ABTS:ε420=3.6×104 L·mol-1·cm-1)。
MnP活性测定光剂[18-19]:0.84 mL上清浓度为0.05 mol·L-1的羟基丙二酸钠盐水溶液、0.05 mL上清浓度为0.01 mol·L-1的硫酸锰溶液、0.05 mL上清浓度为0.01 mol·L-1的2,6-二甲氧基乙酰苯酚(2,6-dimethoxyphenol,2,6-dmp)、0.05 mL上清浓度发酵液和0.01 mL上清浓度按照比例测量为0.01 mol·L-1的双氧水装入一个吸光比色皿中,测定1 min内468 nm内皿处的各种吸光剂在照射下的强度和数值的活性变化,每个比色皿中的强度处理均匀后可以同时重复3次。一个氧化酶的整体活力学计量单位(U)被定义为每分钟可以通过催化底物氧化1.0 μmol 2,6-dmp底物的整体所需氧化酶量(2,6-DMP:ε468=4.68×104 L·mol-1·cm-1)。
LiP活性测定[6,18]:将混合后的溶液1.7 mL 浓度相差为0.25mol·L-1的四水合酒石酸钾钠溶液和0.05 mL浓度相差为0.1 mol·L-1的藜芦醇(veratryl alcohol,VA溶液置于30 ℃的水浴中进行预热后,依次在锅中加入0.05 mL上清发酵液和浓度为0.1mol·L-1的0.05 mL双氧水,测定其在3 min内310 nm处吸光光度值的变化,每个处理均重复3次。一个酶的活力学单位(U)被定义为每分钟可以通过催化氧化1.0 μmol VA物所需酶量(VA:ε310=9.3×103 L·mol-1·cm-1)。
1.2.4 固体培养基脱色筛选
添加50.0 mg·L-1活性红、活性黑、孔雀石绿、刚果红、亚甲基蓝、铬黑T、结晶紫至PDA培养基中,121 ℃下高温高压蒸汽灭菌30 min。在超净工作台中将加入不同染料的PDA(20 mL)倒入直径90 mm的培养皿中,用9 mm的无菌打孔器截取已活化菌株B7、N38的菌柄至不同染料的PDA固体培养基上,上述操作重复3次。再做一组不接菌的空白对照,每个染料作一组空白对照(7组)。在28 ℃恒温培养箱避光培养10 d,根据接菌组的脱色圈大小及颜色变化与对照组相比较,计算菌株B7、N38对不同染料的脱色率,RD为染料脱色率,A1为脱色圈直径,A0为对照组染料区域直径,计算公式为:RD(%)=A1/A0×100[20]。
1.2.5 碳源种类对菌株B7、N38脱色亚甲基蓝的影响
添加麦芽糖、葡萄糖、蔗糖、可溶性淀粉、果糖作为碳源,分别添加20 g·L-1的碳源至染料终质量浓度50.0 mg·L-1的PD培养基作为碳源筛选培养基,在100 mL三角瓶中装入50 mL碳源筛选培养基。以同样浓度的PD染料培养基作为对照组。
1.2.6 氮源种类对菌株B7、N38脱色亚甲基蓝的影响
添加硝酸钠、氯化铵、硫酸铵、蛋白胨、尿素作为氮源,分别添加1.0 g·L-1的氮源至染料终质量浓度50.0 mg·L-1的PDB培养基作为氮源筛选培养基,将50 mL氮源筛选培养基装入100 mL三角瓶中。以同样浓度的PDB染料培养基作为对照组。
1.2.7 金属源种类对菌株B7、N38脱色亚甲基蓝的影响
添加硫酸锌、硫酸钾、硫酸铁、硫酸镁、硫酸锰作为金属源,分别添加1.0 g·L-1的金属源至染料终质量浓度50.0 mg·L-1的PDB培养基作为金属源筛选培养基,将50 mL金属源筛选培养基装入100 mL三角瓶中。将同样浓度的PDB染料培養基作为对照组。
1.2.8 装液量对菌株B7、N38脱色亚甲基蓝的影响
将浓度为50.0 mg·L-1 PDB染料培养基分装90.0 mL、70 mL、50 mL、30 mL、10 mL于100 mL三角瓶瓶中。
1.2.9 pH值对菌株B7、N38脱色亚甲基蓝的影响
将PDB培养基染料浓度调至50.0 mg·L-1,分别倒入100 mL三角瓶中,高温高压蒸汽灭菌30 min。在超净工作台中用已灭菌的过滤器过滤NaOH、HCL,用NaOH、HCL将培养基调整为pH3、pH5、pH7、pH9、pH11。
1.2.10 染料吸光值的测定、脱色率的计算及数据分析
分别取4片菌柄(d=6 mm)于上述三角瓶中,重复3次。28 ℃恒温培养箱中避光培养10 d,每2 d在超净工作台中取1.8 mL染料发酵液,经1 2000 r·min-1离心2 min,取1.0 mL上清液于紫外分光光度计波长为662 nm测量其OD值。液体染料脱色公式为RD=(C0-C1)/C0×100%[17]。C0为未接菌PDB染料培养基的光度值,C1为已接菌的染料发酵液,RD为液体染料脱色率。
2 结果与分析
2.1 菌株N38和B7形态学观察、DNA的提取及ITS系统发育树的构建
菌株N38和B7于恒温培养箱中,4 d即可长满培养皿(见图1)。提取菌株B7、N38的DNA后,进行引物扩增得到PCR产物送其测序,构建系统发育树(见图2)。获得测序结果后登录网站GenBank,得到菌株N38的登录号MZ461912.1,菌株B7的登录号OK021633.1。
2.2 漆酶、木质素过氧化物酶和锰过氧化物酶的活性变化
培养第2 d开始监测菌株N38产酶活性,其酶活性随时间的增长呈现先增长再降低的趋势。Lac活性在第8 d时达到峰值,其酶活力为9.27 U·L-1;MnP活性也在第8 d达到最大值,为16.53U·L-1;而LiP活性在第6 d达到最大值,为7.66U·L-1(见图3a)。
培养第2 d开始监测菌株B7产酶活性,其酶活性随时间的增长呈现先增长再降低的趋势。Lac活性与MnP活性均在第6 d达到峰值,其酶活力分别为13.31 U·L-1、11.29 U·L-1;LiP活性在第8 d达到峰值,为5.24 U·L-1(见图3b)。
2.3 菌株B7、N38对7种分属不同类别染料脱色筛选
将菌株接种在添加孔雀石绿、刚果红、铬黑T、活性黑、活性红、结晶紫、亚甲基蓝的固体染料培养基上。观察后发现,菌株B7对孔雀石绿和亚甲基蓝脱色都很明显,脱色率分别为92.78%、92.22%,对剩余染料的脱色率由高到低依次为:结晶紫(79.22%)、铬黑T(64.44%)、活性红(50.00%)、刚果红(44.44%)、活性黑(41.11%)(见图4a);菌株N38对亚甲基蓝的脱色效果最佳,脱色率为92.78%,对活性红、结晶紫、刚果红三种染料脱色率相同,均为88.89%,对剩余染料的脱色率由高到低依次为:孔雀石绿(82.22%)、活性黑(5.00%)、铬黑T(3.33%)(见图4b)。
2.4 菌株N38、B7脱色亚甲基蓝受碳源种类的影响
脱色第10 d,添加葡萄糖作为碳源时的脱色效果最好,脱色率达84.92%;其次果糖与麦芽糖效果较为接近,脱色率分别为73.38%、70.43%;蔗糖和淀粉脱色率略低,依次是68.64%、48.13%。依结果可见淀粉作为碳源对N38脱色效果并不佳,与其他碳源差距明显(见图5a)。
脱色第10 d,添加葡萄糖作為碳源时的脱色效果最好,脱色率达83.01%;果糖、蔗糖与淀粉效果较为接近,脱色率分别为77.99%、70.74%、69.57%;麦芽糖脱色率最低,仅54.66%。结果显示麦芽糖作为碳源对N38脱色效果不佳,与其他碳源差距明显(见图5b)。
2.5 菌株N38、B7脱色亚甲基蓝受氮源种类的影响
五种氮源中,以氯化铵为氮源的脱色效果最佳,脱色率为93.21%;添加蛋白胨与尿素脱色效果次之,脱色率依次为74.28%、76.12%;添加硫酸铵的脱色率为65.09%;而硝酸钠添加后脱色效果最差,脱色率为54.34%。综上所述,添加氯化铵作为氮源对菌株N38脱色亚甲基蓝效果明显(见图6a)。
五种氮源中,以硝酸钠为氮源的脱色效果明显,脱色率为80.31%;添加蛋白胨,脱色效果次之,脱色率为75.44%;添加尿素、氯化铵和硫酸铵的脱色效果明显降低,脱色率依次为:27.17%、25.38%、15.29%。综上所述,添加硝酸钠作为氮源对菌株B7脱色亚甲基蓝效果明显(见图6b)。
2.6 菌株N38、B7脱色亚甲基蓝受金属离子种类的影响
镁离子的添加对菌株N38脱色亚甲基蓝效果最佳,脱色率为88.80%;其余四种金属离子脱色效果都较为接近,添加锌离子、铁离子、锰离子、钾离子为金属源对菌株N38脱色亚甲基蓝效果十分接近,脱色率分别为78.47%、76.60%、76.21%、71.42%(见图7a)。
锌离子的添加对菌株B7脱色亚甲基蓝效果最佳,脱色率为91.18%;钾离子、镁离子脱色效果都较为接近,其脱色率依次是:85.73%、82.78%;添加锰、铁离子作为金属源的脱色率较低,依次为69.93%、59.62%(见图7b)。
2.7 菌株N38、B7脱色亚甲基蓝受装液量的影响
装液量为30 mL时,脱色效果最佳,脱色率为99.11%;装液量为10 mL时脱色效果也同样很好,脱色率为95.75%;其余3种装液量脱色效果随着装液量增加,脱色率下降,装液量为50 mL、70 mL、90 mL时,脱色率依次为85.01%、65.41%、50.56%。当装液量达到90 mL时脱色率明显低于其余4种装液量(见图8a)。
装液量为10 mL时,脱色效果最佳,脱色率为90.56%;装液量为30 mL时脱色效果略低于10 mL时,脱色率为86.86%;随着装液量增加脱色率不断下降,装液量为50 mL、70 mL和90 mL时,脱色率依次为68.59%、67.07%、31.95%。当装液量达到90 mL时,脱色率明显低于其余4种装液量(见图8b)。
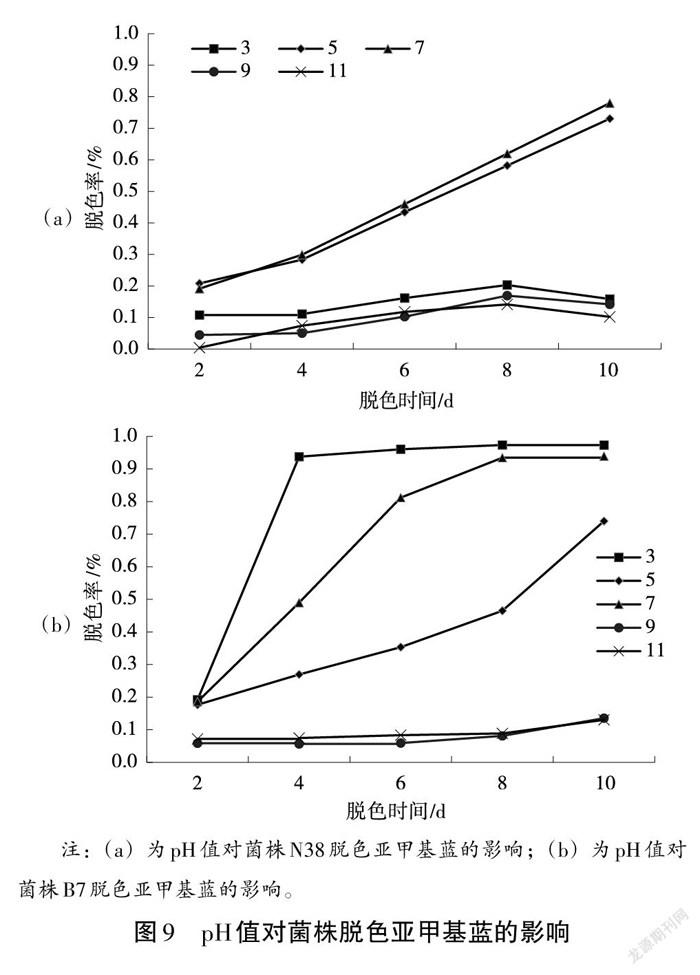
2.8 菌株N38、B7脱色亚甲基蓝受 pH值的影响
培养基pH值不同,菌株的脱色能力也差异显著。当pH值由3.0增加至5.0时,脱色效果明显增加,脱色率由15.88%增加为73.05%;当pH值为7时脱色效果最佳,脱色率为77.99%;随着pH值继续增大时,脱色率下降趋势明显,pH值为9时脱色率为14.19%;pH值为11时脱色率为10.22%。综上所述,菌株N38在极酸极碱的条件下脱色能力差(见图9a)。
受pH值的影响,菌株的脱色能力也差异显著。当pH值为3.0时,脱色效果最佳,脱色率为97.30%;而pH值为5时脱色率为73.99%;当pH值为7时脱色率也,脱色率为93.93%;但随着pH值继续增大时,脱色率下降趋势明显,pH值为9时脱色率为13.54%;pH值为11时脱色率为13.03%。综上所述,菌株N38在极碱的条件下脱色能力差,培养基pH值位于3时,菌株B7脱色亚甲基蓝能力最强(见图9b)。
3 讨论
本试验从贵州大学校园内的女贞树枝干上分离、纯化得到菌株B7,从杨树树干上分离、纯化得到菌株N38。根据菌株的形态学特征、ITS序列相似性比对以及进化树分析,鉴定B7为哈茨木霉菌Trichoderma harzianum;N38为葡萄座腔菌Botryosphaeria dothidea。哈茨木霉为半知菌亚门丝孢纲丛梗孢目科木霉属,广泛分布于森林生态系统中,其适应性极强,对多种病原真菌和细菌都有拮抗作用[21],是一类重要的生防真菌,广泛存在于空气、土壤以及植物体表面等生境中,具有强适应力、存在范围广和广谱、高效等优点[22]。葡萄座腔菌是一种重要的植物内生菌[23]。通过木质素过氧化物酶的测定,可知两菌株具有一定的脱色能力。B7、N38的漆酶、木质素过氧化物酶、锰过氧化物酶的酶活峰值出现在6~8 d,与乔乔研究的木质素过氧化物酶的酶活峰值为第6~8 d结果相同[24]。为了研究两菌株在不同条件下对亚甲基蓝脱色能力,本试验测定了不同碳源、氮源、金属离子、pH值和装液量条件下对菌株脱色亚甲基蓝的影响。结果显示添加葡萄糖作为碳源,菌株N38、B7脱色亚甲基蓝效果最佳,推测菌株N38、B7在添加葡萄糖时,可促进其对亚甲基蓝脱色。徐红云在一色齿毛菌的脱色试验中,添加葡萄糖作碳源的脱色效果也最佳[25];添加氯化铵作为氮源,菌株N38脱色效果最佳。菌株B7在添加硝酸钠作为氮源时,脱色效果最佳。而一色齿毛菌脱色刚果红时,添加硝酸铵作氮源效果最佳[26],考虑是菌株不同,对氮源的需求也不同;添加硫酸镁作为金属源,菌株N38脱色亚甲基蓝效果最佳。菌株B7在加入锌离子作为金属源时,脱色率高达91.18%。由此可见,金属离子是微生物生长中不可或缺的一部分,少量的金属离子可以促进菌株的生长[27];培养基pH值为7时,菌株N38脱色亚甲基蓝效果最佳。菌株B7在pH值为5的条件下,脱色效果明显。与周菲结论相对应,其研究的哈茨木霉脱色活性艳蓝KN-R的最适培养条件为pH值为5.5[28],推测pH值为5左右时,最适合哈茨木霉生长;当装液量为10 mL时,菌株N38、B7脫色亚甲基蓝脱色率均达到90%以上。随着装液量的升高,脱色率逐渐降低,印证了姚英等的结论:当装液量为10 mL时,脱色效果最佳,但是在染液量超过菌株自身承载范围时,脱色效果大大降低[26]。推测菌株对染料脱色有一定的能力范围,因此当接菌量一定时,装液量越少脱色效果越明显。葡萄座腔菌在脱色优化方面暂无报道,在生态发展的时代,微生物降解染料废液备受关注。综合本研究结果,菌株N38、B7可脱色染料亚甲基蓝,这对染料废水的治理具有一定借鉴和指导价值。
参考文献:
[1] 刘岿,张建斌,葛勐.非均相类Fenton纳米催化剂α-Fe2O3-Co3O4的制备及降解亚甲基蓝模拟废水研究[J].化工设计通讯,2021,47(5):111-113.
[2] 陈潮军,王丹青,韩伟.化工染料废水处理技术的应用[J].化工管理,2020(30):102-103.
[3] Kaushik P, Malik A. Fungal dye decolourization: recent advances and future potential[J]. Environment International, 2009,35(1):127-141.
[4] Saratale R G, Saratale G D, Chang J S, Govindwar SP. Bacterial decolorization and degradation of azo dyes: a review[J]. Journal of the Taiwan Institute of Chemical Engineers, 2011, 42(1):138-157.
[5] 杨春霖.黄丝衣霉处理亚甲基蓝废水的研究[J].化学工程与装备,2016(10):274-276.
[6] 张桐,张波,李玉.三种白腐真菌脱色噻嗪染料亚甲基蓝[J].菌物学报,2018,37(9):1243-1250.
[7] 司静,崔宝凯,戴玉成.东方栓孔菌在染料脱色中的应用及其脱色条件的优化[J].基因组学与应用生物学,2011,30(3):364-371.
[8] 朱林,洪宇植,方泽民,等.真菌漆酶对蒽醌和偶氮类活性染料的脱色[J].中国科技论文在线,2010,5(3):224-227.
[9] 韦元雅.高产锰过氧化物酶菌株的筛选、诱变选育及固体发酵条件优化[D].西安:西北大学,2009.
[10] 耿冰,郭美锦,张嗣良,等.pH值对绿色木霉(Trichoderma viride)产纤维素酶的影响[J].工业微生物,2008(5):1-6.
[11] 季更生,林弦,曹阳.pH值对绿色木霉合成纤维素酶的影响[J].安徽农业科学,2007(27):8593-8594.
[12] 张宇婷,宋明珠,王雪峰,等.侧耳木霉产漆酶酶活力测定和脱色方法[J].吉林农业大学学报,2021,43(3):317-323.
[13] 尚晓静,张富美,程伟,等.裂褶菌菌株G18对孔雀石绿染料的脱色优化[J].菌物学报,2020,39(8):1580-1592.
[14] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[15] 李俊凝,李通,魏玉莲.丰林国家级自然保护区木腐真菌多样性与寄主倒木的关系[J].生物多样性,2019,27(8):880-886.
[16] 张富美,侯瑞.一株槭射脉革菌MY51的分离鉴定及对染料的脱色能力[J].应用与环境生物学报,2020,26(2):332-338.
[17] 司静,崔宝凯,戴玉成.栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J].微生物学通报,2011,38(3):405-416.
[18] 张富美,侯瑞.烟管孔菌G11对活性染料的脱色[J].菌物学报,2019,38(9):1527-1537.
[19] 周金燕,张发群,舒远才.愈创木酚法测定锰过氧化物酶活力[J].纤维素科学与技术,1993(1):34-37.
[20] 于存,池玉杰.一色齿毛菌锰过氧化物酶2基因克隆及生物信息学分析[J].中国生物化学与分子生物学报,2016,32(12):1366-1373.
[21] 徐同,钟静萍,李德葆.木霉对土传病原真菌的拮抗作用[J].植物病理学报,1993(1):65-69.
[22] 唐琳,赵辉.哈茨木霉菌T6对茄子幼苗根部防御酶系的研究[J].广东农业科学,2011,38(14):79-81.
[23] 李如华,严东辉,冯小慧,等.基于分子可操作分类单元的北京地区杨树内生葡萄座腔菌属真菌多样性[J].林业科学,2014,50(1):109-115.
[24] 乔乔.木质素降解微生物的筛选及其降解特性的研究[D].合肥:合肥工業大学,2013.
[25] 徐红云,于存,苏帮.一色齿毛菌对直接大红4BS染料的脱色[J].纺织学报,2020,41(4):78-83.
[26] 姚英,于存.一色齿毛菌对刚果红的脱色优化及其毒性变化研究[J].菌物学报,2019,38(2):272-280.
[27] 许飘.白腐真菌对重金属的吸附富集特性及其重金属耐受性和抗性机制研究[D].长沙:湖南大学,2016.
[28] 周菲.产漆酶木霉ZF-2分离、发酵与初步应用研究[D].泰安:山东农业大学,2011.
(责任编辑:敬廷桃)
[ ]
收稿日期:2021-12-16
基金项目:黔科合平台人才(〔2018〕5781);贵州大学州SRT计划项目(〔2021〕213)。
作者简介:魏鸿锦(2000—),男,贵州息烽人,在读本科生,研究方向为林木病理。E-mail:903369337@qq.com。
*为通信作者,E-mail:jiayouhourui123@163.com。
