检测环境水体中银离子含量的新型碳基光学传感器
2022-05-21陈中庸周芯吉刘美红
胡 云, 陈中庸, 周芯吉, 刘美红, 周 希,*
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042; 2.南通大学 化学化工学院,江苏 南通 226019)
金属银作为工业社会的重要原料,被普遍用于制药、电气和航空航天等领域[1]。银离子较易被生物体吸收,经过食物链富集会对人体的免疫系统、消化和神经系统造成损害,是最具毒性的贵金属离子之一[2]。根据我国新版生活饮用水卫生标准,饮用水中Ag+含量不得高于0.05 mg/L,因此,对水体环境中Ag+检测一直是热点研究问题[3]。目前常规的Ag+检测方法有原子吸收光谱测定法、电感耦合等离子体发射光谱法、电化学法等[4]。然而,这些方法涉及的仪器设备昂贵且样品前处理过程繁琐,限制了它们在银离子快速检测领域的应用。因此,亟需开发一种简单高效且灵敏度高的银离子检测技术。近年来,碳量子点(别名碳纳米点,CQDs)作为尺寸在10 nm以下具有光学性质的新型碳基材料,可作为光学传感器广泛应用于环境检测、化学与生物传感、食品分析等领域[5]。目前制备碳量子点的方法有电化学氧化法、微波辐照法、电弧放电法、水热炭化法等[6]。碳量子点在制备过程中通常是由微波辐照、酸处理、电化学或加热技术引发,从而形成共轭碳芯[7]。因此,发展低成本、简单易行且可大规模生产的制备技术成为碳量子点目前研究的难点与热点。池毓务团队[8]于2012年首次通过热解柠檬酸合成了碳基荧光材料,得到具有显著荧光效应的碳量子点。Liu等[9]通过将秸秆粉碎处理后,在250 ℃条件下水热反应10 h,制得碳点并成功应用于铜离子光学探针检测。
木质素是一种芳香族天然聚合物,在自然界中来源广泛、储量巨大且无毒[10-12]。木质素结构中丰富的芳香基团和较高的含碳量,被认为是制备CQDs优良的前驱体。本研究将木质素磺酸钙作为制备CQDs的主要原料,通过超声波辅助处理及大分子自组装得到具有光学性能的CQDs,探究木质素及还原剂NaBH4浓度对CQDs荧光性能的影响,考察CQDs对Ag+的响应识别性能及其细胞毒性,以期为将CQDs应用于环境水体中Ag+浓度检测及食品医药分析提供技术支撑。
1 材料与方法
1.1 原料、试剂与仪器
木质素磺酸钙,上海阿拉丁生化科技股份有限公司;pH值7.0磷酸缓冲溶液(0.1 mol/L,PBS)、NaBH4、硫酸喹啉、AgNO3、无水乙醇,二甲亚砜,均为市售分析纯。超纯水、Hela细胞,南京凯基生物科技发展有限公司。四甲基偶氮唑盐(MTT),西亚化学科技(山东)有限公司。胎牛血清(FBS)和DMEM达尔伯克细胞培养基(DMEM),美国Sigma-Aldrich公司。
Nicolet IS50型傅里叶红外光谱(FT-IR)仪,美国Thermo Fisher Scientific公司;JEM-2100 PLUS透射电子显微镜(TEM),日本电子株式会社;Nano ZS ZEW 3600激光粒度测试仪,英国马尔文公司;RS-5301荧光光谱仪和UV-2600i紫外可见分光光度计,日本岛津公司;UPHI 5700 Versa ProbeX射线光电子能谱(XPS)仪,日本UIVAC-PHI公司。
1.2 木质素基碳量子点(CQDs)的制备
取20 mL无水乙醇,分别按质量浓度10~100 g/L称取木质素磺酸钙,加入并搅拌至完全溶解。随后超声波处理1 h,移入50 mL反应釜中,在150 ℃温度下反应12 h,冷却至室温后,离心分离去除不溶物得到上清液。
在上述上清液中加入还原剂NaBH4(50 g/L),室温反应2 h。反应结束后,利用截留分子质量1 000 u透析袋将所得反应液透析48 h除去钙离子,最后冷冻干燥得到CQDs粉末。
按上述操作实验还考察了木质素磺酸钙质量浓度60 g/L时,不同质量浓度(10~100 g/L)还原剂NaBH4对CQDs的荧光强度的影响。
1.3 分析与表征
1.3.1激光粒度及TEM分析 先使用去离子水配制10 g/L CQDs溶液置于U型样品池中,采用激光粒度测试仪对样品粒径进行分析。将CQDs溶液滴于超薄碳膜表面,待自然风干后采用透射电子显微镜观察其形貌与尺寸,测试加速电压200 kV。
1.3.2FT-IR分析 通过KBr压片制得测试样品,采用红外光谱仪扫描样品,波长范围500~4000 cm-1。
1.3.3XPS分析 通过光电子能谱仪考察CQDs表面化学组成与化学态,采用Al Kα射线(hv=1 340 eV)为X射线源,污染碳C1α(Ea=230 eV)为能量校正。
1.3.4紫外光谱分析 采用紫外可见分光光度计对CQDs溶液进行扫描,波长范围200~800 nm,扫描间隔为0.5 nm。
1.3.5荧光光谱分析 采用荧光光谱仪对CQDs溶液进行扫描,扫描范围200~600 nm,发射和激发光谱波长分别为340~600 nm和200~425 nm,激发和发射狭缝均为5 nm。
1.3.6荧光量子产率的测定 采用参比法测定荧光量子产率。分别测定参比标准物硫酸喹啉(YQ为55%)和CQDs溶液在相同激发波长下的荧光积分面积(I)和吸光度值(A),再根据式(1)计算荧光量子产率(YCQDs):
(1)
式中:YQ—硫酸喹啉荧光量子产率,55%;ACQDs、AR—CQDs和硫酸喹啉吸光度;ICQDs、IR—CQDs和硫酸喹啉荧光积分面积;nCQDs、nR—CQDs和硫酸喹啉溶剂折光率。
1.4 CQDs的应用
1.4.1荧光光谱法测定Ag+采用PBS溶液配制0.05 g/L的CQDs溶液。取300 μL混合CQDs溶液、 1 200 μL AgNO3溶液(0~500 μmol/L)和1 500 μL超纯水置于比色皿中混合,摇匀后在室温下静置5 min,随后测定在340 nm激发波长下的荧光发射光谱,平行测定3次。按相同操作测定其他不同金属离子(400 μmol/L)与CQDs混合溶液在340 nm激发波长下的荧光发射光谱。
1.4.2细胞毒性实验 利用10%的胎牛血清(FBS)的DMEM细胞,将细胞培养基中Hela细胞浓度调整至60 000个/mL,随后按每孔100 μL(6 000个细胞)转移至96孔培养板中,在37 ℃、 5% CO2条件下培养24 h。随后,除去上层清液,将培养液替换成200 μL CQDs溶液(质量浓度分别为0.01、 0.05、 0.1、 0.5、 1.0 g/L)继续培养24 h(对照组加入200 μL DMEM培养基),去除CQDs溶液,并加入20 μL MTT溶液。在37 ℃、 5%CO2条件下连续培养4 h后用150 μL二甲亚砜去除MTT并充分震荡,然后于490 nm波长处测定实验组和对照组溶液吸光度。采用相同操作测定未加Hela细胞空白组的吸光度。细胞成活率(η)计算公式见式(2)。
η=(ACQDs-A0)/(Ac-A0)×100%
(2)
式中:ACQDs、A0、Ac—在490 nm处CQDs、空白组和对照组的吸光度。
2 结果与讨论
2.1 CQDs制备工艺优化
实验中考察了还原剂NaBH450 g/L条件下木质素磺酸钙的质量浓度对CQDs荧光性能的影响,结果如图1所示。
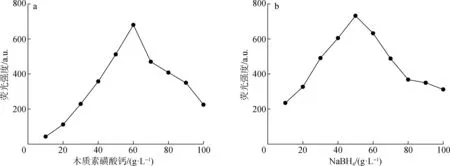
图1 木质素磺酸钙(a)和NaBH4(b)对CQDs荧光强度的影响
由图可知,在木质素磺酸钙质量浓度低于60 g/L时,随着反应过程中木质素磺酸钙质量浓度增加,所得CQDs浓度增加,其荧光强度逐渐增强。当质量浓度达到60 g/L时,其荧光强度最强。当木质素质量浓度高于60 g/L时,因为内滤效应导致所得CQDs溶液荧光强度减弱。在木质素磺酸钙为60 g/L条件下,考察NaBH4质量浓度对CQDs荧光性能的影响,结果亦见图1。由图可知,当NaBH4质量浓度低于50 g/L时,由于CQDs表面官能团未被充分还原,使得其荧光强度较弱,当NaBH4质量浓度为50 g/L 时其荧光强度最强。继续提升NaBH4质量浓度,由于CQDs表面含有的羟基、羧基等含氧官能团解离程度发生改变,使得其荧光强度减弱。
2.2 CQDs的结构分析

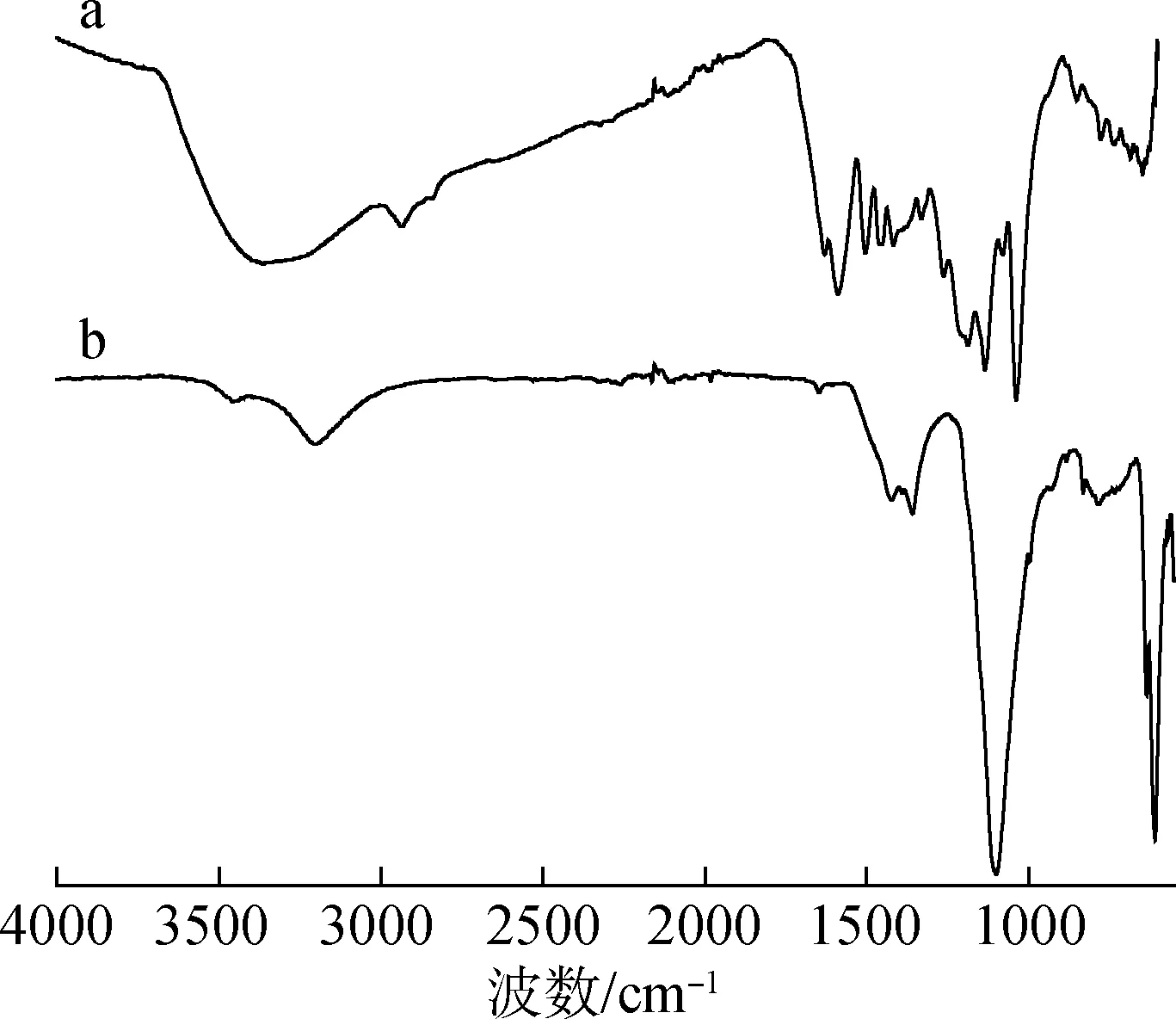
图2 木质素磺酸钙(a)及其碳量子点(b)的红外谱图

图3 木质素基碳量子点的透射电镜图Fig.3 The TEM of CQDs

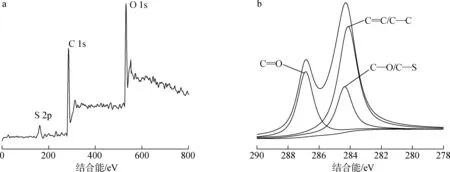
图4 CQDs的XPS图(a)及分峰图(b)
2.3 CQDs的光学性质
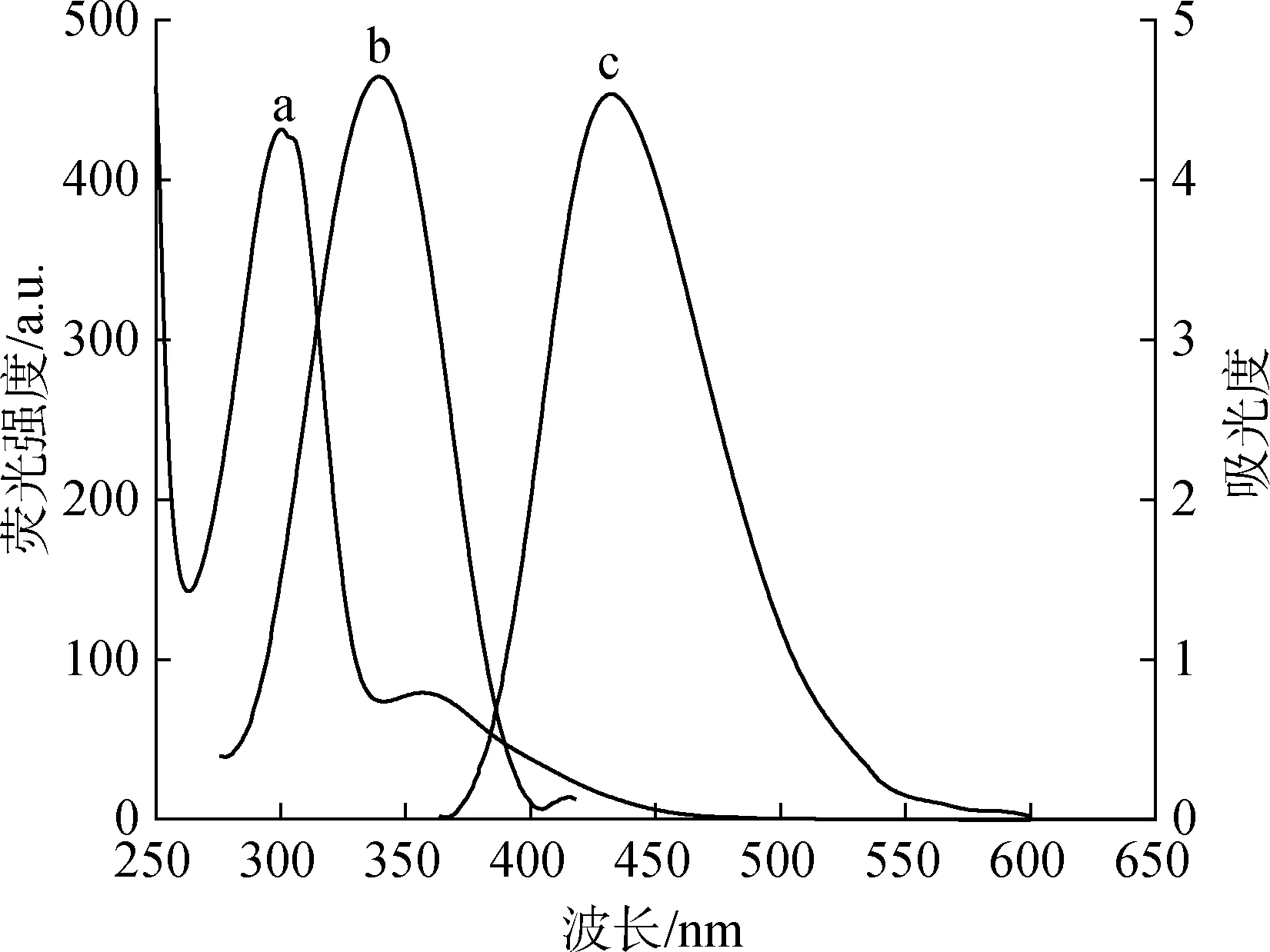
图5 CQDs溶液的紫外吸收(a)与荧光激发(b)、发射(c)光谱图Fig.5 The spectra of ultraviolet absorption(a), fluorescence excitation(b), and emission(c) of CQDs solution
通过紫外光谱和荧光光谱对CQDs的光学性质进行分析,结果见图5和图6。由图可知,曲线a在300及360 nm处有两个明显的紫外吸收峰,前者证实了源自木质素磺酸钙中多芳基发色团存在,后者归因于芳香族π结构及含氧官能团[6]。曲线b为发射波长在450 nm处测得的激发光谱(激发波长230~425 nm),由图可知最大激发波长为340 nm。曲线c为在340 nm激发光作用下的发射光谱,发现CQDs的最大发射波长在432 nm。同时,通过参比法(以硫酸喹啉为参比物)得到该CQDs的YCQDs为12.4%。当激发波长在310~400 nm之间变化时,对应的CQDs荧光发射强度也随之变化,表现出明显的依赖于激发波长变化的特性(图6(a))。在激发波长340 nm下测定不同pH值(用1 mol/L HCl或NaOH溶液调pH值)的CQDs溶液在432 nm处荧光强度变化情况(图6(b))显示:当所得CQDs溶液pH值在1~8之间时,对应荧光强度随pH值增大而增强。当pH值处于8~10之间时,其荧光发射强度达到最强且较稳定,随后荧光强度逐渐减弱。这主要是因为在强碱性环境下,生成的羧酸盐会破坏CQDs表面钝化层,从而使得荧光强度减弱;当CQDs处于酸性条件下时,CQDs表面的羧基和羟基等含氧官能团易形成氢键,诱导CQDs发生聚集并使得荧光猝灭[5]。
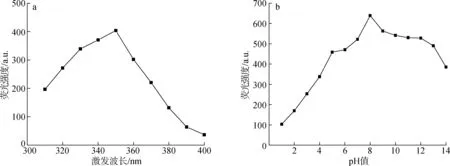
图6 不同激发波长下的CQDs荧光强度(a)及pH值对CQDs荧光强度的影响(b)
2.4 CQDs的应用
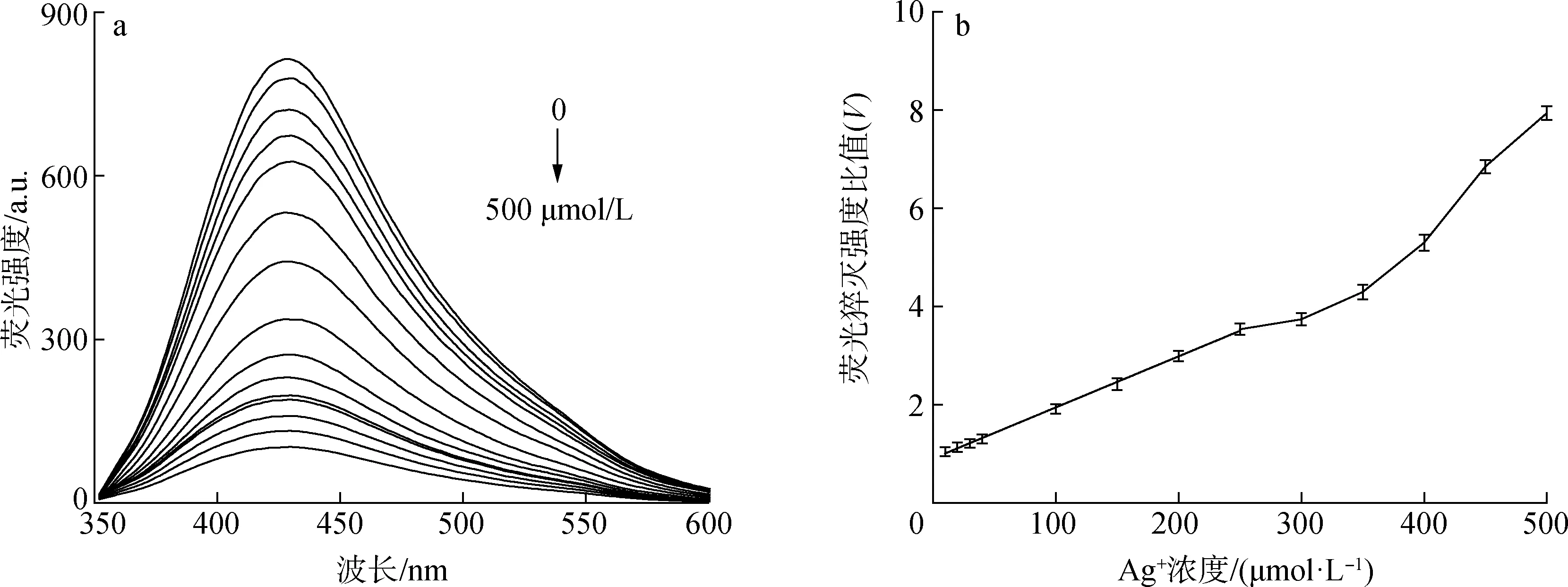
图7 不同浓度Ag+对CQDs荧光强度(a)与荧光猝灭强度比值(b)的变化图
2.4.2CDQs对细胞的毒性检测 低生物毒性是纳米碳点的优势之一,同时也是其在细胞内发挥关键作用的重要前提[12]。为了验证所制备CQDs良好的生物相容性和低毒性,通过MTT法检测其对Hela细胞的生物毒性。实验结果显示:随着CQDs溶液质量浓度(0、 0.01、 0.05、 0.1、 0.5和1.0 g/L)逐渐增加,Hela细胞存活率(分别为99%±2.95%、 94%±2.85%、 93%±2.65%、 92%±2.6%、 95%±2.5% 和90%±2.5%)并未发现有显著的下降趋势,甚至当CQDs质量浓度达到1.0 g/L时,并未出现明显抑制细胞活性的效果。上述实验结果说明,该CQDs对Hela细胞无明显生物毒性。
3 结 论
3.1以木质素磺酸钙为碳源,通过超声波处理及大分子组装,设计合成了一种具有荧光特性的水溶性碳量子点(CQDs),通过FT-IR、XPS和TEM等确证结构。紫外-可见光谱和荧光光谱实验结果表明:其最大发射波长和最大激发波长分别为432 nm和340 nm,且具有较高的荧光量子产率(12.4%)。
3.2不同质量浓度Ag+溶液对CQDs荧光强度的影响规律:随着Ag+浓度增加,CQDs荧光逐渐猝灭;在0~250 μmol/L范围内,Ag+浓度与CQDs荧光猝灭强度比值有良好线性关系(R2=0.998),检测限低至525 nmol/L。
3.3离子选择性试验和细胞毒性测试表明:其他金属离子对CQDs荧光猝灭作用较小,CQDs对Ag+荧光选择性较高且无明显细胞毒性,有望将其应用于环境水体中Ag+浓度检测及食品医药分析。
