组织透明化技术在神经退行性疾病中的应用研究进展
2022-05-21陈小玉罗连响潘韵琪鲍波
陈小玉,罗连响,潘韵琪,鲍波*
1广东医科大学病理生理学教研室,广东湛江 524000;2广东医科大学海洋医药研究院,广东湛江 524000;3广东医科大学第一临床医学院,广东湛江 524000
目前,全球约有4700万人受到神经退行性疾病的影响[1]。在常见的神经退行性疾病中,阿尔茨海默病(Alzheimer's disease,AD)[2-3]、帕金森病(Parkinson's disease,PD)[4]、多发性硬化(multiple sclerosis,MS)[5]等的发病率逐渐升高,且治疗效果不佳,造成了巨大的社会和经济负担。大脑是一个结构极其复杂的动态神经功能网络。目前,人类对于大脑的认识远远不够,即使对于仅为人脑体积数百分之一的啮齿动物脑的结构和功能机制,也无法进行确切地阐述[6]。在全脑范围内对特定类型的神经环路进行高分辨率多维成像,分析病理性结构(如淀粉样斑块、神经纤维斑块缠结)的分布及形态学变化,对于脑功能及相关疾病的研究至关重要。然而,传统二维组织切片技术无法客观地获得目标区域真实的立体空间结构,且在机械切片过程中易破坏组织结构的连续性,导致某些关键信息丢失。
组织透明化技术以细胞分辨率对大脑结构进行3D成像,并作为连接影像学成像技术如电子计算机断层扫描(computed tomography,CT)[7]、正电子发射型计算机断层显像(positron emission computed tomography,PET)[8]、磁共振成像(magnetic resonance imaging,MRI)[9]与经典显微组织学和免疫组织化学技术之间的桥梁。为了获取全脑范围内神经元的结构形态和蛋白分布信息,不仅需要具有较高空间分辨率的光学成像系统,同时还需要能够将大体积样品进行快速成像的技术。光学显微镜如激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)[10]、双光子激发荧光显微镜(two-photon excitation fluorescence microscopy,TPEFM)[11]和光片荧光显微镜(light sheet fluorescence microscope,LSFM)[12]的发展解决了不同层面焦距变化和成像深度的问题,神经科学家开始尝试无需切片直接进行3D成像,组织透明化技术由此应运而生。这为优化大体积组织成像提供了较好的途径,可使光线渗透到组织内更深的区域,在细胞或亚细胞水平提高了成像分辨率和对比度,并逐渐地应用于多个生物医学研究领域。本文对脑组织透明化技术的基本原理和特点及其在神经退行性疾病中的应用研究进行综述。
1 组织透明化技术的原理
由于生物组织结构复杂,含有不同折射率(refraction index,RI)的生物大分子(如脂质、色素、蛋白质复合物等)分布不均,当局部生物大分子聚集较多时,形成了一个特定RI的异质性空间。光通过组织内部时发生不均匀散射或折射[13],导致不透明。组织透明化技术通过多种有机化合物或离子去污剂组成混合试剂对生物组织进行一系列处理,以去除、替换或匹配RI不均一的物质,增加组织器官透明度,从而提高光的穿透深度,有利于实现生物组织的空间结构解析和三维重建,其技术流程如图1所示。
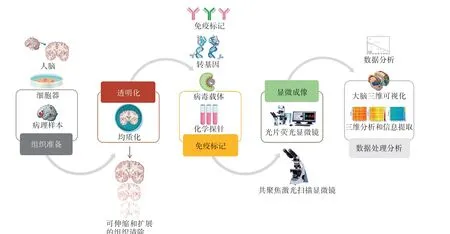
图1 组织透明化技术工作流程Fig.1 Workflow of tissue clearing techniques
现有透明化方法多通过以下几种方式:(1)使用洗涤剂和(或)清除剂提高组织通透性;(2)脱脂和脱钙,去除RI相对较高的成分;(3)脱水,去除RI相对较低的组分,并允许疏水性透明化试剂渗透;(4)变性或消化,将RI大的隔室分解成小而均匀的隔室。为保持组织成分和生物分子自然地分布于三维空间,且同时实现RI均质化,需要借助一些外力,如电泳驱动[14-15]、被动热扩散[16]和灌注[17]等加压方式,加速洗涤剂分子移动、化学渗透和去除脂质等成分。对于富含色素或发色团的有色组织(如黑色素、肌红蛋白中的血红素、脑中的脂褐素等),开发了包含脱色步骤的组织透明化方法,如CUBIC-L(clear unobstructed brain imaging cocktails of N-butyl-diethanolamine and triton X-100)[18]、PEGASOS[polyethylene glycol(PEG)-associated solvent system][19]。然而,黑色素和脂褐素等大分子色素用有机溶剂或水性试剂很难脱色,DEEPClear(depigmentation-plus-clearing)采用疏水和亲水试剂的混合物以及过氧化物漂白步骤,可去除包括黑色素在内的各种色素[20],为研究各种模式动物的神经网络和亚细胞结构提供了方案。然而,化学清除剂可能会对组织造成损伤,丢失某些生物分子和亚细胞结构的完整性,故需采取一定的保护性预处理,如固定或网状凝胶聚合物包埋。Park等[21]利用生物分子与环氧化物连接的原理开发了SHIELD(stabilization under harsh conditionsviaintramolecular epoxide linkages to prevent degradation)方法,将组织与柔性聚环氧化物交联,以形成稳定性较高、均匀且透明的基质,从而在苛刻的化学/物理处理过程中保护组织结构和荧光蛋白。然而,组织透明化方法中更复杂的作用机制尚不明确,有待进一步研究。
2 透明化技术的代表性方法及其分类
组织透明化技术结合多种荧光标记技术如转基因动物、病毒示踪、荧光染料及原位杂交等,可在器官甚至全身水平获取生物组织的三维结构信息;结合高分辨率光学显微成像技术,可呈现大脑和脊髓组织中复杂而又紧密连接的三维结构,有助于进一步理解中枢神经与周围神经、血管的连接机制,为研究中枢神经系统的发育、损伤修复、可塑性、神经连接,以及分析各类脑细胞的空间结构等提供了重要工具。
1914年,Spalteholz最先使用有机溶剂苯甲醇和水杨酸甲酯混合透明化试剂,对透明的心脏组织进行3D观察[22];2003年,Liu等[23]开发了使用水溶性化合物进行组织透明化的方法,开拓了近代组织透明化技术发展的道路;2007年,Dodt等[24]使用苯甲醇-苯甲酸苄酯(BABB)试剂透明新生小鼠大脑得到了透明脑,首次可视化了完整的小鼠大脑神经网络结构;2013年,Chung和Deisseroth[25]发明的CLARITY(clear lipid-exchanged acrylamide-hybridized rigid imaging/immunostaining/in situhybridizationcompatible tissue-hydrogel)透明化技术,出色地展示了将整个生物组织透明后获得精细图像的能力。迄今为止,已经开发了60多种离体组织透明化方法[26],表1总结了具有代表性的脑透明化方法学参数[17,19,21,25,27-45],为研究者选用和进一步开发扩展方法提供简要索引。
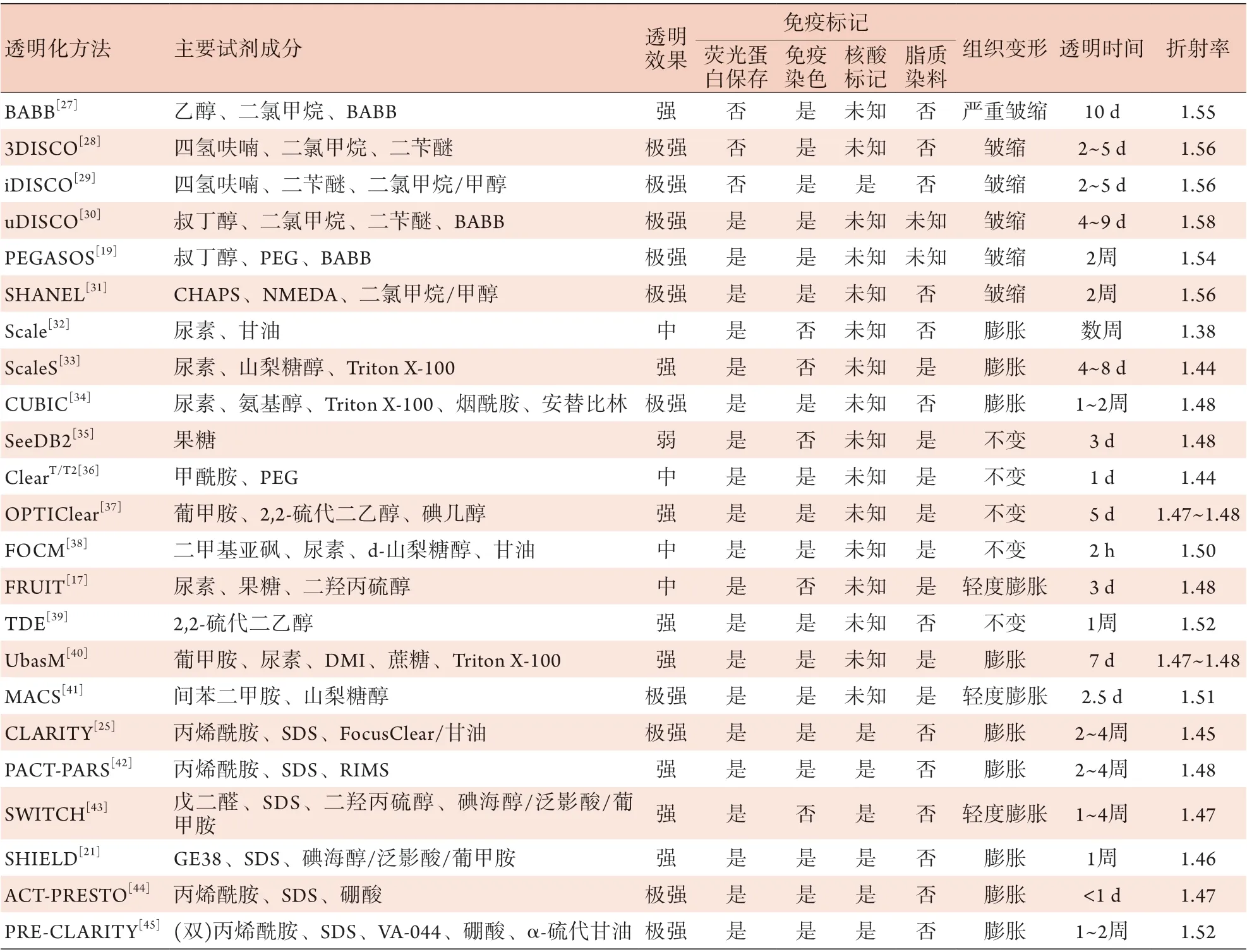
表1 脑组织透明化方法学比较Tab.1 Comparison of methods of brain tissue transparency
根据所用主要试剂的性质,组织透明化技术可分为两类,即有机溶剂型透明化技术和亲水溶剂型透明化技术,其优缺点如图2所示。(1)有机溶剂型透明化技术可将组织在几天内实现较高地透明度,但内源性荧光信号极易淬灭,如3DISCO(3D imaging of solvent-cleared organs)[28]。近年来开发了一些新型的有机溶剂透明化技术,如iDISCO(immunolabeling-enabled DISCO)[29]、uDISCO(ultimate DISCO)[30]、vDISCO[nanobody(VHH)-boosted DISCO][46]等,可在一定程度上保存荧光蛋白。(2)亲水溶剂型透明化技术,可进一步分类。一类包括ScaleS[33]、SeeDB2(see deep brain)[35]、FOCM[38]等水合溶剂,以良好的荧光保存和维持原组织大小而著称,通过高浓度透明化试剂CUBIC系列[34,47]简单孵育可较好地透明化胚胎、新生小鼠大脑或厚切片。另一类包括离子去污剂联合水凝胶包被的CLARITY技术[25]及其变体,可以实现完整成年小鼠大脑的高度透明,这极大地拓宽了组织透明化技术研究的范围,可应用于果蝇、蟑螂、斑马鱼、小鼠、大鼠、兔、狗、狨猴甚至人类的多种组织。
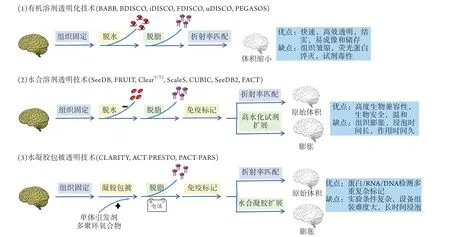
图2 组织透明化技术的分类及特点Fig.2 Classification and characteristics of tissue clearing techniques
2.1 D I S C O 系列 有机溶剂型透明化技术以3 D I S C O[28]、i D I S C O[29]、P E G A S O S[19]、SHANEL(small-micelle-mediated human organ efficient clearing and labeling)[31]等为代表。技术流程主要包括两个步骤:脱水/脱脂和高折射率成像介质浸泡。因高折射率成像介质(RI均为1.56左右)与水(RI为1.33)不相溶[48],首先使用有机溶剂四氢呋喃代替乙醇进行组织脱水,因乙醇会严重破坏荧光蛋白信号;脱水后应用脱脂试剂(如BABB、二苄醚)可大幅度提高透明介质向深层组织渗透的效率。此类方法的优势是透明速度快而彻底,透明后的组织变硬,体积缩小,而在中枢神经系统中体积呈等向性缩减,有助于标本长期保存以及多次成像。尽管改进了GFP荧光保存方法,但内源性GFP荧光损伤仍然显著。此外,因大多数有机溶剂对人体和环境均具有毒性,使用时需做好生物安全防护措施,废液应集中处理。DISCO及其衍生方法在透明组织的同时,可进行深层免疫标记,已广泛应用于成年小鼠脑及全身、人类胚胎、肿瘤活检样本、人脑组织等的研究。
2.2 CUBIC系列 亲水性组织透明化试剂可高浓度溶解于水,与组织中的蛋白质、水分子等成分形成氢键,稳定荧光蛋白信号,并保留组织的3D结构,依靠渗透压驱动逐渐完成透明。常用方法包括ScaleS[33]、CUBIC[34]及SeeDB2[35]等。实验流程包括脱色、脱脂和RI匹配。此类方法生物安全性更高,具有多种生物兼容性(如亲脂性染料)和保留荧光蛋白的优势。由于未去除脂质,透明效果不及疏水性有机溶剂,但可通过延长透明化时间达到良好的透明效果。CUBIC非常适合于光照或给药后即刻早期基因的检测,已应用于脑部肿瘤迁移灶、全脑范围内单个神经元的追踪、全脑谷氨酸能神经元突触连接、下丘脑神经元分型及视网膜神经投射等研究。
2.3 CLARITY系列 与其他透明化技术相比,CLARITY系列兼具水溶性透明化方法保持生物分子功能的特性和疏水性方法高效透明的优势,包括PACT-PARS[42]、ACT-PRESTO[44]、SHIELD[22]等。代表性方法CLARITY采用聚丙烯酰胺凝胶,使蛋白质、神经递质及核酸等生物分子通过化学键与水凝胶偶联,并将其固定在组织原位,极大地减少了结构破坏,同时凝胶的大分子渗透性支持免疫标记在整个组织中的扩散,且折射率匹配解决方案可通过进一步减少透明和未透明样品中的光散射来实现深度高分辨率成像。结合示踪实验,进行系统性无偏倚地自动化分析,可在高分辨率水平进行单个神经元成像;结合自动化细胞检测、大脑之间的对齐方式,能快速获取高通量数据。
3 透明化技术在神经退行性疾病中的应用
组织透明化技术结合多种免疫标记方法,完美地实现了在细胞水平可视化大脑完整结构(如健康人脑皮质中锥体神经元、中间神经元、小脑浦肯野细胞、颗粒细胞等)和功能脑图谱,以及单个细胞在不同脑区活动的关联等。该技术提供了多维度视角(宏观和微观尺度),可揭示潜在分子标志物在疾病发生发展中的作用。通过透明化技术对病理性人脑组织样本或各种退行性疾病动物模型进行高分辨率成像,如可视化AD的淀粉样斑块,PD的多巴胺能轴突、浦肯野细胞、α-突触核蛋白包涵体,以及MS的脑皮质萎缩和突触等病理性结构,可在神经环路水平探究疾病的病理发展过程。详见表2。
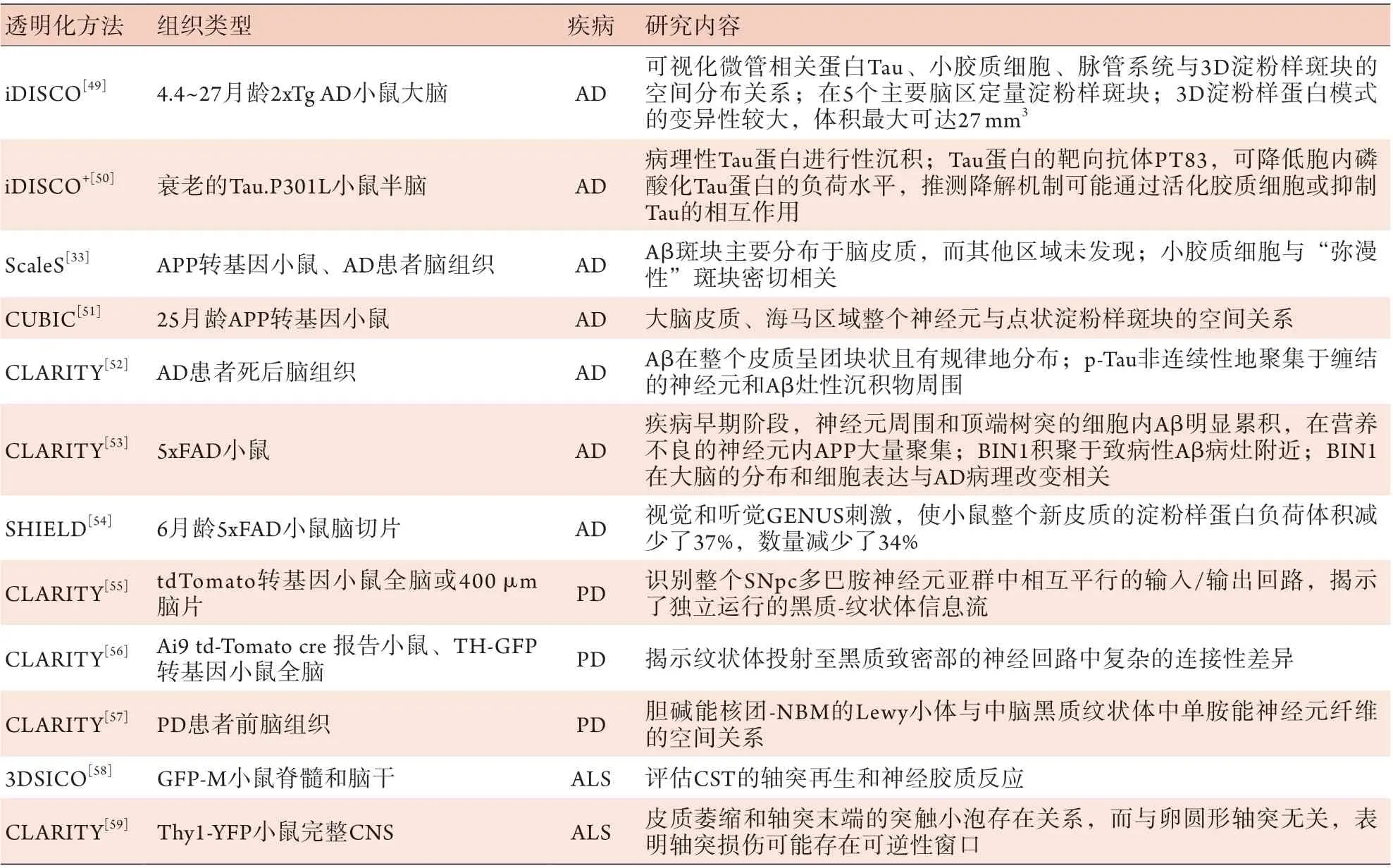
表2 透明化技术在神经退行性疾病中的应用Tab.2 Application of tissue clearing in neurodegenerative diseases
3.1 AD AD是一种渐进性神经退行性疾病,主要表现为记忆障碍、认知功能障碍及语言障碍,是老年痴呆症最主要的病因。65岁以上人群患病率为11.3%[2]。AD患者大脑皮质萎缩,神经元长期受β淀粉样斑块(amyloid β-protein,Aβ)及神经纤维缠结(neurofibrillary tangles,NFTs)等侵蚀,突触功能出现不同程度的紊乱甚至丢失[60]。组织透明化技术直观地展示了AD病理标志物在三维立体空间中的分布、结构异质性,以及与神经元、胶质细胞、血管等周围环境的相互关系,可促进AD病理机制的研究。Hama等[33]开发ScaleS清除APP转基因小鼠,结合AbScale深层免疫标记Aβ斑块,发现其主要分布于脑皮质;在AD患者脑组织中,致密Aβ斑块与小胶质细胞毗邻而存。Vints等[51]使用CUBIC处理25月龄APP转基因小鼠,结合高尔基-科克斯(Golgi-Cox)与硫代黄素-S染色,解析大脑皮质、海马区整个神经元与点状Aβ斑块的空间关系。Ando等[52]通过CLARITY获得了均匀透明的脑组织,结合Aβ、微管相关蛋白Tau和神经丝三重免疫标记,发现在整个皮质致密实心Aβ大斑块呈局灶性分布,松散点状斑块表现为弥漫性分布,过度磷酸化Tau蛋白则非连续性聚集于缠结的神经元和Aβ灶性沉积物周围区。
为研究斑块的形成机制,Liebmann等[49]利用iDISCO清除4.4月龄(不含斑块)到27月龄(斑块高负荷)的2xTg AD小鼠,精确定位5个脑区的淀粉样斑块沉积的时空顺序,其中皮质最先累积,而小脑比海马更早发生聚集;Aβ斑块周围的小胶质细胞较大,呈巢状聚集,表明反应性小胶质细胞在募集或转移斑块中发挥作用。此外,研究发现,小胶质细胞-神经元网络结构的慢性损伤,将导致AD和PD患者的突触丢失以及神经元细胞永久性受损[61]。De Rossi等[53]使用被动CLARITY处理5xFAD小鼠脑,对BIN1(bridging integrator 1,一种核质衔接蛋白,参与髓鞘膜的重塑,与迟发性AD相关)、淀粉样前体蛋白(amyloid precursor protein,APP)和β位点APP裂解酶1(beta-site APP-cleaving protease 1,BACE1)进行定位分析,发现APP和BACE1位于皮质和海马区Aβ沉积物周围的球状结构中,而BIN1积聚于Aβ病灶附近。该研究明确了BIN1在大脑中的分布及营养不良性神经元中的表达,为AD相关的病理变化提供了新见解。
如何降低Tau蛋白尚不清楚,通过脑内针对性注射药物试验,评估不同阶段病理性Tau的时空动态变化及其区域脆弱性,有望成为临床前筛选延缓或阻止Tau病理进程药物的有力工具。Detrez等[50]使用iDISCO+透明衰老Tau.P301L小鼠半脑,在图谱引导下的体积分析显示,整个病理性Tau蛋白从注射部位顺行或逆行扩散至周边,也可能波及次级区域。颅内和全身联合给予PT83,可靶向降低胞内磷酸化Tau蛋白水平,推测其机制可能是活化胶质细胞或抑制Tau的相互作用。此外,Martorell等[54]采用SHIELD透明6月龄5xFAD小鼠脑切片,发现同时使用视觉和听觉GENUS刺激1周,小鼠整个新皮质的淀粉样蛋白负荷体积降低了37%,数量减少了34%;单独使用听觉GENUS刺激Tau P301S模型小鼠可引起小胶质细胞活化和血管扩张反应,使磷酸化Tau蛋白水平降低。组织透明化技术结合全脑免疫标记提供了检测大组织样本的能力,实现了单细胞水平下观察立体空间结构中各种致病分子与神经细胞间的相互作用,为更客观地理解神经退行性病变机制提供了一种有效途径。
3.2 PD PD是常见的第二大中枢神经退行性疾病,以黑质-纹状体系统病变为主,在我国65岁以上人群中发病率为1.7%[62]。PD典型的病理学特征是黑质致密部(substantia nigra pars compacta,SNpc)多巴胺能神经元变性丢失,路易小体(Lewy bodies,LBs)异常沉积[4]。在运动控制过程中胆碱能和多巴胺能两个系统相互拮抗,多巴胺能神经元变性坏死导致纹状体接收的多巴胺水平降低70%以上时可出现静止性震颤、肌肉僵直等一系列症状;除了多巴胺神经系统外,PD患者前脑胆碱能核团-Meynert基底核(nucleus basalis of meynert,NBM)的胆碱能神经元退化[63],是导致早期甚至进展期认知功能损伤的主要机制。
目前,已有学者在应用组织透明化技术研究小鼠脑及PD患者多巴胺能神经元多源信息的输入、整合、编码、输出及投射通路方面进行了初步尝试。Lerner等[56]利用CLARITY透明全脑后,观察到两种平行的黑质-纹状体多巴胺神经元亚群投射的差异性,证实了新的神经回路追踪和记录方法,这为完整大脑内丰富的细胞类型及全局连接关系提供了信息。Menegas等[55]使用CLARITY和全脑光片成像,无偏倚地识别了整个SNpc多巴胺神经元亚群中相互平行的输入回路和输出回路,揭示了独立运行的黑质-纹状体信息流,为理解多巴胺能神经元回路的反馈机制、研究不同类型神经元群的全脑映射提供了一个可推广的框架。Liu等[57]使用CLARITY技术,通过正交投影图像表征了PD患者前脑NBM区域LBs与中脑黑质纹状体中单胺能神经元纤维的空间分布关系,提示α-Syn可作为病理性“种子”在细胞间沿神经元网络传播和扩增,形成特征性的α-Syn聚集体。组织透明化技术在神经环路水平为分子追踪提供了可能,可大范围地研究退行性病变大脑中致病性成分或某一类细胞在整个神经网络中的作用。
3.3 MS MS是一种病因不明的慢性炎症性中枢神经系统脱髓鞘疾病,其晚期典型的病理改变是进行性灰质萎缩,大脑和脊髓出现严重脱髓鞘改变,伴有轴索消失、胶质细胞局灶性增生[56]。为更好地了解髓鞘变性和脱髓鞘的机制,髓鞘病理学研究聚焦于轴突-少突胶质细胞-髓鞘单位损伤所涉及的细胞间相互作用。Ertürk等[58]采用3DSICO方法对成年GFP-M小鼠脊髓和脑干进行透明,以评估完整皮质脊髓束(complete corticospinal tract,CST)的轴突再生和神经胶质反应,发现了损伤1年后具有生长能力的轴突绕过损伤部位大量再生的特征。在完整CNS中可视化细胞,有望用于评估脊髓损伤和其他神经疾病的实验性疗法。Spence等[59]应用改良CLARITY方法清除Thy1-YFP小鼠的完整CNS,揭示了皮质萎缩与轴突末端的突触小泡存在关系,而与卵圆形轴突无关,表明轴突损伤可能存在可逆性窗口。通过组织透明化技术对啮齿动物MS模型中完整的脑-脊髓结构进行解析,可在整体水平观察神经脱髓鞘、轴突以及神经元的病理结构变化,进一步探索潜在的发病机制,为开发轴突再生策略和临床前研究新疗法提供技术支持。
此外,组织透明化技术已经应用于人类胚胎学领域,可观察毫米级3D脑器官的细胞结构[64]。利用DISCO透明技术,实现了妊娠3个月内厘米级人类胚胎的完全透明[65-66],结合全免疫标记技术发现,分泌促性腺激素释放激素的神经元以两种独立的途径迁移,并在下丘脑外的许多大脑区域定居。研究表明,在10周岁时人脑齿状回(dentate gyrus,DG)中可观察到数千个未成熟的神经元[67],而成人海马是否有新神经元生成尚需进一步研究。对死后人脑组织的处理方式,在很大程度上阻碍了人类DG中AHN标记物的检测[68]。组织透明化技术可获得脑样本中完整的大脑神经网络信息,有助于追踪、评估神经元的变化,因此对观察死亡后人类脑组织样本有巨大的潜力,可能为特定病理条件下保存和刺激新神经元的存活和成熟提供新的方法。
4 总结与展望
组织透明化技术因保持了组织标本的完整性,对神经网络的损坏较小,为实现大体积生物组织的神经、血管等结构的三维可视化及分析研究提供了新的病理诊断视角。快速高效的组织透明化方案有利于增加实验组规模,以识别较小的生物学效应(如年龄、性别和生活环境)和微小而重要的临床差异,并为从细胞水平研究器官结构提供了新的方向,且有望为神经退行性疾病的精准治疗提供可能。
目前,大多数透明化方法基于啮齿类动物大脑,虽为人脑透明化的可行性提供了理论验证,但要实现人类大脑全面的神经回路分析,仍面临着巨大的挑战。现有透明化技术对完整组织器官的透明及成像效果仍有待提高,如超快的清除速度、整体器官的高透明度、亲脂性染料(用于追踪神经元结构和脉管系统)的兼容性以及生物安全性等。此外,还需要对成像技术、数据处理加以改善。首先,较大体积的组织需要工作距离更长、视野更大的光学显微镜,有的显微镜功能并非完全兼容,且图像采集效率较低。目前,光片荧光显微镜成像系统提供了有前途的解决方案,未来期待能实现任意大小组织亚微米级分辨率的光学显微镜,以打破三维成像中组织体积以及分辨率的限制。其次,数据存储和处理方面要求大容量智能化,因大规模体积成像期间会生成千兆字节甚至TB级数据集,手动提取分析有意义的数据较为困难。因此,高性能工作站对于数据存储和分析确实是必需的。
综上所述,不同学科组织透明化方法的融合,为无偏倚3D组织成像铺平了道路,将促进组织透明化技术更广泛地应用,如作为药物向中枢神经系统转运新的定量分析工具等。靶向神经系统的生物制剂或其他大分子药物如何克服血脑屏障和其他可能限制疗效的微环境,仍需进一步深入探讨。组织透明化技术可在保持结构完整性和蛋白质免疫原性的同时使脑组织足够透明,能高分辨率地获取药物的生物分布及单细胞水平的作用靶点,针对此特性的研究为了解药物作用的分子机制、开发新型高效药物提供了重要数据,可能为生物制药带来突破性变革。
