安五脂素对小鼠肺纤维化的改善作用及其机制研究
2022-05-21陈悦琪陈奕良郭春花徐铭晨方菁王宇瑶郝凯敏王春靖王春梅庄文越
陈悦琪,陈奕良,郭春花,徐铭晨,方菁,王宇瑶,郝凯敏,王春靖,王春梅,庄文越*
1北华大学医学技术学院,吉林省吉林市 132013;2吉林医药学院附属医院呼吸内科,吉林省吉林市 132013;3北华大学附属医院呼吸内科,吉林省吉林市 132013;4北华大学药学院,吉林省吉林市 132013
肺纤维化是一种以成纤维细胞增殖分化、肺纤维灶不断生成聚集和大量细胞外基质沉积,并伴有炎症损伤、组织结构破坏等特征的肺部疾病,会对肺部造成不可逆转的损害[1],目前临床主要应用免疫抑制剂联合糖皮质激素、肺移植等方法进行治疗,或使用吡非尼酮、尼达尼布等药物延缓其进展,但一直未发现疗效好且不良反应少的特效药物。氧化应激是多种器官(包括肺)纤维化的重要分子机制[2],主要包括大量的活性氧(reactive oxygen species,ROS)产生和(或)耗尽的抗氧化防御引起的所有分子、细胞和组织异常[3]。铁死亡最早由Dixon发现并提出[4],是一种铁依赖的非凋亡细胞死亡形式,通过积累ROS和脂质过氧化产物,引发大量铁沉积促使细胞死亡。细胞发生铁死亡时,可产生大量ROS,超过机体的清除能力,导致氧化与抗氧化系统失衡[5],从而诱发氧化应激,引起肺纤维化。有研究发现,使用铁死亡抑制剂(Fer-1)可改善肺纤维化[6]。安五脂素是近年来从南五味子中新提纯的单体,研究发现其具有抗炎[7]、抗氧化[8]、保肝[9]等功效。目前有研究发现,安五脂素在小鼠疲劳模型中可通过Nrf2/ARE信号通路发挥抗氧化作用[10],但其在肺纤维化中对氧化应激与铁死亡的干预作用尚不清楚。本研究应用博来霉素(bleomycin,BLM)诱导的肺纤维化小鼠模型及转化生长因子(TGF)-β1诱导的HFL-1细胞模型探讨安五脂素的抗纤维化作用,以期为临床治疗肺纤维化提供新的药物靶点。
1 材料与方法
1.1 主要材料 BLM购自杭州瀚晖制药有限公司;安五脂素购自成都普菲德生物技术有限公司;TGF-β1(GF346)购自美国Sigma公司;N-乙酰半胱氨酸(S0077)、CCK-8试剂盒(C0042)购自上海碧云天生物技术有限公司;超氧化物歧化酶(SOD,A001-3)、丙二醛(MDA,S0131S)、谷胱甘肽(GSH,A006-2-1)、ROS(E004-1-1)、谷胱甘肽过氧化物酶(GSH-Px,A005-1-2)、过氧化氢酶(CAT,A007-1-1)及羟脯氨酸(HYP,A030-2-1)试剂盒购自南京建成生物工程研究所;β-actin(AC038)、α-平滑肌肌动蛋白(α-SMA,A7248)、谷胱甘肽过氧化物酶4(GPX4,A13309)、溶质载体家族7成员11(SLC7A11,A2413)、转铁蛋白(TF,A1448)、下调转铁蛋白受体1(TFR1,A5865)多克隆抗体购自武汉ABclonal生物科技有限公司;RNA抽提试剂盒(RC101-01)、HiScript Ⅱ Q RT SuperMix for qPCR(R223-01)、2×ChamQ Universal SYBR qPCR Master Mix (Q711-02/03)购自美国Vazyme公司。
1.2 动物实验方法
1.2.1 动物分组及给药 雄性ICR小鼠65只,体重(20±2) g,购自长春亿斯实验动物技术有限公司[实验动物合格证号:SCXK(吉)-2018-0007]。随机分成对照组、BLM模型组、安五脂素低剂量组、安五脂素高剂量组[11]与N-乙酰半胱氨酸组,每组13只。BLM模型组、安五脂素低剂量组、安五脂素高剂量组[10]及N-乙酰半胱氨酸组采用气管灌注方法给予5 mg/kg BLM诱导肺纤维化,对照组经气管灌注给予等量生理盐水。造模24 h后,对照组、BLM模型组灌胃给予0.5%羧甲基纤维素钠(CMC-Na)溶液,N-乙酰半胱氨酸组和安五脂素低、高剂量组分别灌胃给予N-乙酰半胱氨酸(150 mg/kg)[11]和安五脂素(1 mg/kg、4 mg/kg)[10]治疗21 d。饲养过程中,小鼠自由进食及饮水,每天观察小鼠的行为状态,每2 d记录1次小鼠体重,观察体重变化。末次给药后小鼠禁食不禁水12 h,眶周静脉取血,待凝固后3000 r/min离心10 min收集血清,并取肺组织。本研究经北华大学实验动物伦理委员会审批(20191202),实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2.2 肺组织病理学染色 取各组小鼠左肺,于4%甲醛溶液中固定24 h、脱水、石蜡包埋、切片(厚度4 μm),行HE染色和Masson三色染色。使用光学显微镜(200×)观察肺组织病理形态并采集图像,用ImageJ软件进行图像分析,参照Ashcroft评分标准进行肺纤维化评分,评分越高表明肺纤维化程度越严重。Ashcroft评分标准如下。0分:正常肺组织;1分:肺泡或支气管壁轻微增厚;3分:肺泡或支气管壁中度增厚,但肺泡结构没有明显破坏;5分:条索状纤维带或小范围纤维灶形成,肺泡结构明显破坏;7分:肺泡结构严重变形,广泛的纤维灶形成,呈“蜂窝肺”;8分:肺组织全视野纤维化病变;2、4、6分介于相应分数之间。Masson染色的阳性区域使用ImageJ软件进行定量分析。
1.2.3 肺组织HYP含量测定 取各组小鼠右肺,按照HYP试剂盒说明书步骤操作,测定HYP含量。
1.2.4 qRT-PCR检测肺组织中铁死亡相关基因mRNA的表达 取各组小鼠右肺,使用RNA抽提试剂盒提取总RNA,按照HiScript Ⅱ Q RT SuperMix for qPCR反转录试剂盒说明书步骤合成cDNA。按照ChamQ Universal SYBR qPCR Master Mix试剂盒说明书步骤行实时荧光定量PCR扩增反应,在NCBI(National Coalition Building Institute)中查找基因序列,用Primer Premier 6.0软件设计引物。反应条件:95 ℃ 30 s;95 ℃ 10 s、60 ℃ 30 s (40个循环);95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。制备熔解曲线,采用2-ΔΔCt法进行相对定量分析。引物序列如表1所示。

表1 qRT-PCR引物序列Tab.1 Primer sequence of qRT-PCR
1.2.5 Western blotting检测肺组织中α-SMA及铁死亡通路相关蛋白的表达 取各组小鼠右肺,加入RIPA裂解液冰上裂解1 h,4 ℃下12 000 r/min离心5 min,取上清;使用BCA试剂盒测定总蛋白浓度,10% SDS-PAGE凝胶电泳分离45 μg蛋白并转移至PVDF膜上;5%脱脂奶粉室温封闭90 min,加入α-SMA(1∶500)、TF(1∶500)、TFR1(1∶500)、GPX4(1∶500)、SLC7A11(1∶500)特异性抗体4 ℃孵育过夜;用含Twin-80的Tris缓冲液(TBS-T)洗涤,加入抗兔或抗鼠辣根过氧化物酶抗体(1∶10 000)孵育1 h。增强型ECL显影液显色,利用全自动凝胶成像系统采集和分析数据。
1.2.6 小鼠血清氧化应激指标检测 取各组小鼠血清,按照SOD、GSH-Px、CAT、GSH、MDA试剂盒说明书步骤操作,检测抗氧化物酶SOD、GSHPx、CAT活性,抗氧化剂GSH水平,以及脂质过氧化代谢产物MDA含量。
1.3 细胞实验方法 HFL-1细胞购自中国科学院分子细胞科学卓越创新中心细胞库,用含10%胎牛血清的F12K培养基于37 ℃、5% CO2培养箱中培养。待细胞生长至80%融合时,用0.25%胰蛋白酶消化,按照1∶2比例瓶传代。
1.3.1 CCK-8法检测细胞增殖情况 取对数生长期HFL-1细胞,消化后接种于96孔板中(每孔8×103个/100 μl),于37 ℃、5% CO2培养箱内培养24 h,待细胞贴壁后,随机分成对照组与安五脂素给药组(0.3125、0.625、1.25、2.5、5、10、20、40、80 μmol/L),每组设置3个复孔,作用48h后每孔加入10 μl CCK-8溶液孵育1 h。使用酶标仪检测450 nm波长处的光密度值(OD)。
1.3.2 细胞分组、造模及形态观察 待培养瓶中HFL-1细胞生长至80%融合时,设置对照组,TGF-β1模型组及安五脂素低、高剂量组。对照组使用含1%血清的F12K培养基培养,TGF-β1模型组使用5 ng/ml TGF-β1[12]诱导24 h,安五脂素低、高剂量组使用5 ng/ml TGF-β1诱导24 h后分别给予浓度为5、10 μmol/L的安五脂素继续培养48h。相应浓度安五脂素及TGF-β1溶液均由含1%血清的F12K培养基稀释而成。各组HFL-1细胞造模给药后,于倒置相差显微镜下拍照观察HFL-1细胞的形态变化。
1.3.3 HFL-1细胞中氧化应激指标检测 待培养瓶中HFL-1细胞生长至80%融合时,按照1.3.2方法分组处理后,用0.25%胰蛋白酶消化,PBS洗涤3次,取各组细胞沉淀,按照试剂盒说明书步骤操作,检测SOD、GSH-Px、CAT活性,GSH水平,以及MDA含量。
1.3.4 ROS水平检测 HFL-1细胞接种于6孔板中(1×105个/ml),每孔加入10 μmol/L DCFH-DA荧光探针,于37 ℃培养箱内作用45 min,胰酶消化后,PBS洗涤2次,用PBS重悬后接种于6孔板中,于荧光显微镜下(200×)拍照观察各组HFL-1细胞ROS活性变化。
1.3.5 qRT-PCR检测铁死亡相关基因mRNA的表达待培养瓶中HFL-1细胞生长至80%融合时,按照
1.3.2方法分组处理后,用0.25%胰蛋白酶消化,PBS洗涤3次,取各组细胞沉淀使用RNA抽提试剂盒提取总RNA,按照1.2.4方法进行后续操作。引物序列如表1所示。
1.3.6 Western blotting检测α-SMA及铁死亡通路相关蛋白的表达 取各组HFL-1细胞,按照1.2.5方法进行后续操作。
1.4 统计学处理 采用SPSS 24.0软件进行统计分析。计量资料以±s表示,行方差齐性检验。若方差齐,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;若方差不齐,组间比较采用Welch法行近似方差分析,进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结 果
2.1 安五脂素对BLM诱导的小鼠肺纤维化的影响
HE染色结果显示,对照组小鼠肺组织结构完整,肺泡大小、结构正常,肺泡壁较薄,无充血、炎症等表现;BLM模型组肺泡间隔明显增厚,几乎没有正常的肺泡结构,可见大量炎性细胞浸润;与BLM模型组比较,安五脂素组炎症病变有所减轻;与安五脂素低剂量组比较,安五脂素高剂量组炎症病变明显减轻。Masson染色结果显示,胶原纤维被苯胺蓝染成蓝色,BLM模型组肺泡间隔明显增厚,肺泡结构被破坏,可见大量蓝染的胶原纤维(P<0.01);与BLM模型组比较,安五脂素组的胶原沉积有所减少,且安五脂素高剂量组少于安五脂素低剂量组(P<0.001) (图1A、B)。
肺纤维化程度评分结果显示,与对照组比较,BLM模型组肺纤维化评分明显升高(P<0.001);与BLM模型组比较,安五脂素低剂量组肺纤维化评分无明显变化(P>0.05),但安五脂素高剂量组肺纤维化评分有所降低(P<0.001),且安五脂素高剂量组明显低于安五脂素低剂量组(P<0.001,图1B)。
与对照组比较,BLM模型组小鼠体重明显下降(P<0.01);与BLM模型组比较,安五脂素低、高剂量组小鼠体重均有所上升,安五脂素高剂量组小鼠体重明显上升(P<0.05,图1C)。与对照组比较,BLM模型组小鼠肺组织HYP含量明显增加(P<0.001);与BLM模型组比较,安五脂素低剂量组小鼠肺组织HYP含量无明显变化(P>0.05),但安五脂素高剂量组小鼠肺组织HYP含量明显降低(P<0.001),且安五脂素高剂量组低于安五脂素低剂量组(P<0.001,图1D)。

图1 安五脂素对BLM诱导的小鼠肺纤维化的影响(±s,n=3)Fig.1 Effects of anwulignan on BLM-induced pulmonary fibrosis in mice (±s, n=3)
2.2 安五脂素对BLM诱导的小鼠肺纤维化氧化应激的影响 与对照组比较,BLM模型组小鼠血清SOD、CAT、GSH-Px、GSH活性明显下降(P<0.05或P<0.001),MDA含量明显增高(P<0.001)。与BLM模型组比较,安五脂素低剂量组小鼠血清SOD、CAT、GSH-Px、GSH及MDA含量无明显变化(P>0.05),但安五脂素高剂量组小鼠血清SOD、CAT、GSH-Px、GSH活性明显升高(P<0.01),MDA含量明显降低(P<0.001),且安五脂素高剂量组小鼠血清SOD、CAT、GSH-Px活性高于安五脂素低剂量组,MDA含量低于安五脂素低剂量组(P<0.05、P<0.01或P<0.001,表2)。
表2 安五脂素对BLM诱导的小鼠肺纤维化氧化应激的影响(±s,n=3)Tab.2 Effects of anwulignan on oxidative stress in mice with BLM-induced pulmonary fibrosis (±s, n=3)

表2 安五脂素对BLM诱导的小鼠肺纤维化氧化应激的影响(±s,n=3)Tab.2 Effects of anwulignan on oxidative stress in mice with BLM-induced pulmonary fibrosis (±s, n=3)
BLM. 博来霉素;SOD. 超氧化物歧化酶;CAT. 过氧化氢酶;GSH-Px. 谷胱甘肽过氧化物酶;GSH. 谷胱甘肽;MDA. 丙二醛;与对照组比较,(1)P<0.05,(2)P<0.001;与BLM模型组比较,(3)P<0.01,(4)P<0.001;与安五脂素低剂量组比较,(5)P<0.05,(6)P<0.01,(7)P<0.001
组别 SOD (U/ml) CAT (U/ml) GSH-Px (U/ml) GSH (U/ml) MDA (μmol/ml)对照组 58.48±3.48 48.31±0.69 703.21±21.75 45.82±0.21 9.34±2.24 BLM模型组 37.44±3.49(1) 29.57±4.44(2) 585.28±13.41(1) 15.86±5.08(2) 22.13±1.58(2)安五脂素低剂量组 47.16±2.77 35.62±2.34 656.51±13.56 25.32±4.89 19.91±1.36安五脂素高剂量组 65.29±7.89(3)(6) 45.44±0.95(3)(5) 770.36±60.42(3)(5) 35.21±3.47(3) 10.34±0.77(4)(7)N-乙酰半胱氨酸组 78.22±9.87(4) 51.45±4.72(4) 826.38±47.94(4) 48.15±0.71(4) 8.71±2.64(4)
2.3 安五脂素对BLM诱导的肺纤维化小鼠铁死亡相关基因表达的影响 qRT-PCR和Western blotting检测结果显示,与对照组比较,BLM模型组小鼠肺组织中GPX4、SLC7A11、TFmRNA和蛋白表达水平降低(P<0.05,P<0.01或P<0.001),TFR1mRNA和蛋白表达水平升高(P<0.001)。与BLM模型组比较,安五脂素低剂量组小鼠肺组织中GPX4、SLC7A11、TFmRNA表达水平升高(P<0.05),TFR1mRNA表达水平明显降低(P<0.01);安五脂素高剂量组小鼠肺组织中GPX4、SLC7A11、TFmRNA和蛋白表达水平升高(P<0.01或P<0.001),TFR1mRNA和蛋白表达水平明显降低(P<0.001)。与安五脂素低剂量组比较,安五脂素高剂量组小鼠肺组织中SLC7A11蛋白表达水平明显升高(P<0.001),GPX4、TFmRNA和蛋白表达水平明显升高(P<0.05或P<0.001),TFR1mRNA和蛋白表达水平明显降低(P<0.01或P<0.001)(图2A、B)。
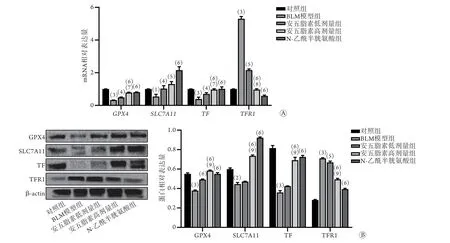
图2 安五脂素对BLM诱导的肺纤维化小鼠铁死亡相关基因表达的影响(±s,n=3)Fig.2 Effects of anwulignan on ferroptosis in mice with BLM-induced pulmonary fibrosis (±s, n=3)
2.4 安五脂素对HFL-1细胞增殖及TGF-β1诱导的HFL-1细胞形态的影响 CCK-8法检测结果显示,安五脂素浓度<20 μmol/L时对HFL-1细胞增殖没有明显影响(P>0.05,图3A),因此选用5、10 μmol/L浓度进行后续实验。
倒置相差显微镜观察显示,对照组HFL-1细胞呈梭形且边界清晰,排列规则;TGF-β1模型组HFL-1细胞呈扁平状,边界不清晰,细胞核比例增大,而当给予5、10 μmol/L浓度安五脂素后,TGF-β1诱导的细胞形态改变被逆转,恢复了梭形形态,且安五脂素高剂量组较低剂量组形态改变明显(图3B)。
Western blotting检测结果显示,与对照组比较,TGF-β1模型组α-SMA表达明显上调(P<0.001),安五脂素低、高剂量组α-SMA表达均下调(P<0.05,P<0.01),且安五脂素高剂量组低于安五脂素低剂量组(P<0.05,图3C)。

图3 安五脂素对HFL-1细胞增殖及形态的影响(±s,n=3)Fig.3 Effects of anwulignan on proliferation and morphology of HFL-1 cells (±s, n=3)
2.5 安五脂素对TGF-β1诱导的HFL-1细胞氧化应激的影响 与对照组比较,TGF-β1模型组HFL-1细胞的SOD、CAT、GSH-Px、GSH活性明显下降(P<0.001),MDA含量明显增高(P<0.001);安五脂素给药后,HFL-1细胞的SOD、CAT、GSH-Px、GSH活性均明显升高(P<0.01或P<0.001),MDA含量明显降低(P<0.01或P<0.001),且安五脂素高剂量组HFL-1细胞CAT活性高于安五脂素低剂量组(P<0.001),MDA含量低于安五脂素低剂量组(P<0.001,表3)。
表3 安五脂素对TGF-β1诱导的HFL-1细胞氧化应激的影响(±s,n=3)Tab.3 Effects of anwulignan on oxidative stress in TGF-β1-induced HFL-1 cells (±s, n=3)

表3 安五脂素对TGF-β1诱导的HFL-1细胞氧化应激的影响(±s,n=3)Tab.3 Effects of anwulignan on oxidative stress in TGF-β1-induced HFL-1 cells (±s, n=3)
TGF-β1. 转化生长因子-β1;SOD. 超氧化物歧化酶;CAT. 过氧化氢酶;GSH-Px. 谷胱甘肽过氧化物酶;GSH. 谷胱甘肽;MDA. 丙二醛;与对照组比较,(1)P<0.001;与TGF-β1模型组比较,(2)P<0.01,(3)P<0.001;与安五脂素低剂量组比较,(4)P<0.001
组别 SOD (U/mg prot) CAT (U/mg prot) GSH-Px (U/mg prot) GSH (μmol/mg prot) MDA (μmol/mg prot)对照组 106.04±8.36 22.11±0.86 111.81±6.81 180.98±11.47 2.74±0.19 TGF-β1模型组 54.97±13.21(1) 7.17±0.35(1) 40.06±6.09(1) 40.26±5.01(1) 7.51±0.32(1)安五脂素低剂量组 90.41±2.56(2) 15.49±0.18(3) 69.86±8.74(2) 231.72±15.91(3) 6.17±0.41(2)安五脂素高剂量组 105.52±6.37(3) 25.86±0.67(3)(4) 80.89±2.37(3) 249.11±17.34(3) 2.59±0.15(3)(4)
与对照组比较,TGF-β1模型组HFL-1细胞荧光明显增强(P<0.001),提示ROS水平明显升高。与TGF-β1模型组比较,安五脂素低剂量组ROS水平无明显变化(P>0.05),但安五脂素高剂量组ROS水平明显降低(P<0.01),且安五脂素高剂量组低于安五脂素低剂量组(P<0.01,图4)。

图4 安五脂素对TGF-β1诱导的HFL-1细胞ROS水平的影响(±s,n=3)Fig.4 Effects of anwulignan on the contents of ROS in TGF-β1-induced HFL-1 cells (±s, n=3)
2.6 安五脂素对TGF-β1诱导的HFL-1细胞铁死亡相关基因表达的影响 qRT-PCR和Western blotting检测结果显示,与对照组比较,TGF-β1模型组HFL-1细胞GPX4、SLC7A11、TFmRNA和蛋白表达水平明显降低(P<0.01或P<0.001),TFR1mRNA和蛋白表达水平明显升高(P<0.01)。与TGF-β1模型组比较,安五脂素低剂量组HFL-1细胞GPX4mRNA表达水平明显升高(P<0.001),SLC7A11、TFmRNA和蛋白表达水平明显升高(P<0.05,P<0.01或P<0.001),TFR1mRNA和蛋白表达水平明显降低(P<0.05或P<0.01);安五脂素高剂量组HFL-1细胞GPX4、SLC7A11、TFmRNA和蛋白表达水平升高(P<0.01或P<0.001),TFR1mRNA和蛋白表达水平明显降低(P<0.01)。与安五脂素低剂量组比较,安五脂素高剂量组HFL-1细胞SLC7A11mRNA表达水平升高(P<0.05),GPX4、TFmRNA和蛋白表达水平明显升高(P<0.05,P<0.01),TFR1mRNA和蛋白表达水平明显降低(P<0.05)(图5)。

图5 安五脂素对TGF-β1诱导的HFL-1细胞铁死亡相关基因表达的影响(±s,n=3)Fig.5 Effects of anwulignan on expression of ferroptosis related genes in TGF-β1-induced HFL-1 cells (±s, n=3)
3 讨 论
近年来,肺纤维化的发病率和病死率呈不断上升趋势,新冠肺炎重症患者炎症后肺纤维化情况尤为显著。肺纤维化很难逆转,因此临床开发有效的治疗药物刻不容缓。安五脂素是近年来发现的具有抗氧化功效的一种中药单体,属南五味子木脂素成分。有研究发现,在D-半乳糖诱导的小鼠衰老模型中,安五脂素发挥了显著的抗氧化作用[13]。本研究采用气管灌注BLM建立小鼠肺纤维化动物模型,TGF-β1诱导HFL-1细胞建立肺纤维化细胞模型,分别通过体内和体外实验探讨安五脂素对肺纤维化进程中氧化应激、铁死亡及相关信号通路的干预作用,为临床应用中药治疗肺纤维化提供了一定的理论依据。
本研究发现,当给予肺纤维化小鼠不同剂量的安五脂素后,小鼠体重明显上升,肺组织HYP含量明显降低,HE染色和Masson染色结果提示小鼠肺纤维化病理改变发生逆转,表明安五脂素能够改善小鼠的肺纤维化表型。细胞内和细胞外氧化剂与抗氧化剂之间的平衡是正常肺稳态的先决条件。当肺部遭遇急性损伤发生炎症反应后,产生多种重要的内源性ROS,包括过氧化物自由基、过氧化氢(H2O2)和羟基自由基等[14]。而当机体清除ROS的功能低下时,体内产生过多的ROS,导致氧化还原失衡,引发氧化应激。有研究发现,氧化应激损伤后修复失败是肺纤维化非常重要的诱因之一[2]。本研究发现,安五脂素可明显提高肺纤维化动物模型和细胞模型的抗氧化物酶SOD、CAT、GSH-Px活性及抗氧化剂GSH水平,降低脂质过氧化产物MDA的含量,从而逆转氧化应激对肺组织造成的损伤,减轻肺纤维化(表3,图4、6)。
铁死亡是近年来在哺乳动物细胞中发现的一种新型铁依赖性细胞死亡形式,其特征是细胞内铁积累和脂质过氧化增加。在生理条件下,细胞内铁通过吸收和代谢始终处于动态平衡。膳食铁主要以Fe3+的形式被肠上皮细胞吸收,与TF结合后通过膜上的TFR1进入细胞,被还原为Fe2+释放进入细胞质中的不稳定铁池,该过程中相关蛋白的异常表达会引起细胞产生过量的Fe2+,并催化ROS的产生,导致细胞内脂质过氧化产物的持续积累并引起铁死亡[15-17]。SLC7A11是细胞内胱氨酸/谷氨酸反向转运系统的重要组成部分,可通过促进胱氨酸的吸收及GSH的合成保护细胞免受氧化应激和铁死亡[18]。SLC7A11减少会导致细胞内半胱氨酸缺失,阻碍GSH的合成。GSH是GPX4发挥功能的辅助因子,其合成受阻会使GPX4的抗氧化活性减弱[19]。有研究发现,ROS、脂质过氧化和GPX4在Erastin诱导的肺纤维化和铁死亡中起重要作用[20]。本研究发现,安五脂素可通过上调GPX4、SLC7A11和TF的表达,下调TFR1的表达,减少铁的过度沉积来抑制铁死亡,从而改善肺纤维化(图5)。

图6 安五脂素体内体外抑制肺纤维化的作用Fig.6 Inhibition of pulmonary fibrosis with anwulignan in vivo and in vitro
综上所述,本研究结果表明,安五脂素在体内、体外均可发挥抗氧化作用,同时抑制铁死亡的发生,从而改善肺纤维化。该结果为临床开发肺纤维化治疗药物提供了新的靶点,但安五脂素抑制铁死亡的更深层次的机制有待进一步研究。
