针刺通过lncRNA MEG3调控AKT/mTOR自噬途径治疗大鼠多囊卵巢综合征的作用机制
2022-05-21钟毅征谢蓬蓬陈晶晶何浪弛梁秋芬
钟毅征,林 静,谢蓬蓬,陈晶晶,何浪弛,刘 丹,梁秋芬
(1广州市妇女儿童医疗中心中医妇科,广州 510000;2广西中医药大学第一附属医院中医妇科;*通讯作者,E-mail:yzz0114@163.com)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种女性特发的内分泌紊乱性疾病,以卵巢的多囊性改变为主要特征,可导致患者排卵减少或不排卵、不孕、月经不调、肥胖等,不仅危害女性生殖功能,还会增加肿瘤产生的风险[1,2]。炎症和自噬是PCOS发病的重要病理环节,研究显示,PCOS患者体内抗炎因子水平明显减少,自噬活性降低,通过抑制炎症、增强自噬可改善PCOS引发的卵泡过度激活和生长等症状[3,4]。针刺是一种广泛应用于临床的中医疗法,可有效减轻PCOS患者体内炎症,改善其胰岛素抵抗,进而修复卵巢正常排卵功能[5],还可通过抑制mTOR信号促进自噬,减轻PCOS大鼠线粒体功能障碍及高雄激素血症[6],对PCOS起到很强的治疗功效,但其确切的作用机制目前尚未有明确阐述。
蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是调控炎症和自噬作用的重要信号,在PCOS的发生及病情进展过程中起到关键作用,抑制AKT/mTOR激活,可增强自噬,阻碍炎症发生发展,改善溃疡性结肠炎小鼠结肠损伤[7],还可抑制卵巢颗粒细胞增殖,减轻PCOS大鼠卵巢多囊性病理改变[8]。lncRNA MEG3是一种可介导自噬过程的长链非编码RNA[9],在对胶质瘤的研究中发现,过表达lncRNA MEG3,可抑制PI3K/AKT/mTOR通路蛋白磷酸化,促进人胶质瘤细胞自噬[10],因而推测通过上调lncRNA MEG3抑制AKT/mTOR信号,进而增强自噬,可能是针刺治疗PCOS的作用机制。本研究通过建立PCOS大鼠模型,对此进行探讨验证。
1 材料与方法
1.1 实验动物
雌性SD大鼠,7~8周龄,体质量180~220 g,SPF级,购自广西梧州制药(集团)股份有限公司,生产许可证号SCXK(桂)2018-0002,广西中医药大学屏障环境动物房中适应分笼饲养,每笼4~6只大鼠,温度设为23~25.5 ℃,相对湿度设为52%~60%,每天通风换气13~18次。
1.2 主要试剂
来曲唑(纯度:HPLC≥98%)、羧甲基纤维素钠,北京索莱宝科技有限公司;腺病毒包装的lncRNA MEG3 siRNA及其阴性对照、lncRNA MEG3与β-actin引物、一步法反转录荧光定量试剂盒、大鼠促黄体生成素(LH)酶联免疫(ELISA)试剂盒、睾酮(T)ELISA试剂盒,生工生物工程(上海)股份有限公司;RNAiso Plus,日本TaKaRa公司;血清活性氧(ROS)测定试剂盒,北京百奥莱博科技有限公司;IL-17测试盒、IL-18测试盒、高强度RIPA裂解液,南京建成生物工程研究所;BCA蛋白检测试剂盒、兔源anti-Beclin1一抗、羊抗兔二抗、兔源anti-p-AKT一抗、兔源anti-β-actin一抗、兔源anti-mTOR一抗、兔源Anti-微管相关蛋白1轻链3(LC3)一抗、HE染色试剂盒、兔源anti-AKT、兔源anti-p-mTOR一抗,美国Abcam公司。
1.3 主要仪器
KWD-808-Ⅰ型脉冲针灸治疗仪,常州英迪电子医疗器械有限公司;Biotek aQuant型酶标仪,上海坤肯生物化工有限公司;LEIKA-RM2135型病理切片机、DM4000 B LED型显微镜,德国Leika公司;Tissue-Tek VIP6型全自动脱水机,日本樱花公司;Y6-6LF型生物组织包埋机,湖北亚光易用电子技术有限公司;Stepone plus型荧光定量PCR仪,美国ABI公司;L00686C型快速智能蛋白湿转仪,南京金斯瑞生物科技有限公司;Tanon 4600型全自动化学发光图像分析系统、EPS300型电泳仪,上海天能科技有限公司。
1.4 PCOS大鼠模型制备及分组处理
参照文献[11,12]中方法:以高脂饲料喂养SD大鼠12周,并于第3周开始每日灌胃来曲唑(溶于0.5%羧甲基纤维素钠溶液)1次,剂量为1 mg/kg,共灌胃9周,然后检测发现血清T、LH水平显著升高,表示造模成功,将其随机分为5组:模型组、针刺组、lncRNA MEG3 siRNA组、lncRNA MEG3 siRNA阴性对照组、针刺+lncRNA MEG3 siRNA组,每组12只;另取12只大鼠喂养高脂饲料并灌胃等剂量0.5%羧甲基纤维素钠溶液,设为对照组。
根据《实验针灸学》定位双侧“带脉”,参照文献[13]避光固定大鼠,电针仪直接对其进行针刺20 min,电针强度0.6~1.4 mA,频率2 Hz/100 Hz,每日针刺1次,连续针刺治疗14 d;lncRNA MEG3 siRNA组、lncRNA MEG3 siRNA阴性对照组、针刺+lncRNA MEG3 siRNA组静脉注射腺病毒包装的lncRNA MEG3 siRNA及其阴性对照(剂量均为1×1011PFU),每周1次,共注射2周,对照组、模型组和针刺组大鼠每周静脉注射等量生理盐水1次,共注射2周。
1.5 大鼠体质量、卵巢质量测定及标本采集
第14次针刺干预结束后24 h,麻醉大鼠(吸入乙醚)后称量其体质量,采集腹主动脉血,静置离心,吸出上清(血清)保存于-80 ℃。处死大鼠,开腹取出卵巢,称其质量,然后以小剪刀取下0.4 g保存于液氮;再次取下0.5 g,剪碎、匀浆、离心,以试剂盒通过BCA法测得上清中蛋白总浓度,分组标记后保存于-80 ℃;剩余卵巢进行固定、脱水、包埋后进行常规病理切片备用。
1.6 ELISA及荧光探针法分别测定大鼠血清T、LH、IL-17、IL-18、ROS水平
以冰水浴缓慢解冻1.4中血清,采用试剂盒严格按照各组说明书指导操作步骤:取96孔板包被后,封闭、加样、孵育酶标抗体、加底物液显色、终止反应,采用酶标仪测出各孔吸光度后,计算出其中T、LH、IL-17、IL-18水平;通过荧光探针法测定ROS水平:取96孔板中依次滴加100 μl新鲜血清样本、10 μl荧光探针,混匀后37 ℃避光孵育30 min,采用酶标仪测出各孔荧光强度,计算出其中ROS水平。
1.7 HE染色观察大鼠卵巢形态
以二甲苯对1.4中的卵巢组织切片做脱蜡处理,水化后进行HE染色,严格按照各组说明书指导操作,随机选出200倍显微镜下5个视野拍照,并采用病理分析软件Image J分析计数每个视野中卵泡数量,取平均值。
1.8 实时荧光定量PCR检测大鼠卵巢组织lncRNA MEG3表达
以RNAiso Plus提取1.4中卵巢组织总RNA,并用试剂盒进行实时荧光定量PCR扩增,反应体系配制及实验条件设定均参照试剂盒说明书指导进行,具体反应条件为:反转录50 ℃ 5 min;预变性95 ℃ 3 min;PCR反应95 ℃ 10 s,60 ℃ 30 s,40个循环,以β-actin作为lncRNA MEG3的内参基因,通过2-ΔΔCt算法对所得Ct值进行分析,得出lncRNA MEG3的相对表达,引物序列见表1。
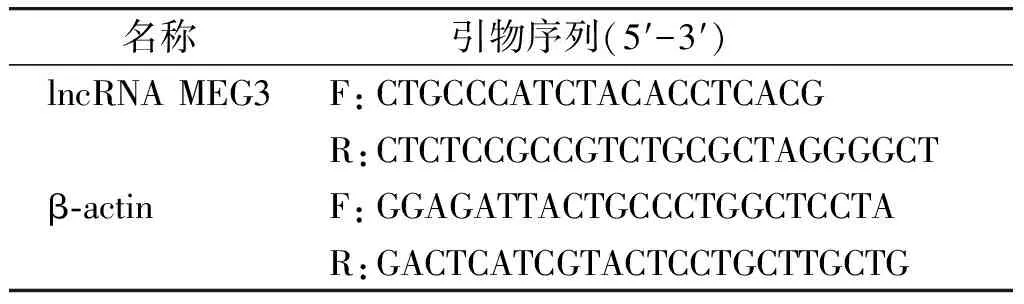
表1 引物序列
1.9 免疫印迹法检测大鼠卵巢组织自噬相关蛋白及AKT/mTOR通路相关蛋白表达
取出1.2.2中卵巢组织蛋白样品液,每组取20 μg蛋白变性,电泳分离蛋白后,接着湿转,膜上蛋白经封闭后,分别孵育Beclin-1、β-actin、mTOR、p-mTOR、AKT、p-AKT、LC3一抗(稀释比例均为1 ∶2 000),然后孵育二抗(稀释比例为1 ∶1 000),化学发光法显色,采集蛋白条带图像并用Image J软件定量其灰度值,进行统计学分析后得到各蛋白相对表达水平。
1.10 统计学分析
所有数据均是计量资料,采用平均数±标准差表示,并运用SPSS 24.0软件进行统计学分析,多组间比较采用单因素方差分析,多组间两两比较进行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA MEG3对大鼠体质量及卵巢质量的影响
与对照组比较,模型组大鼠体质量及卵巢质量均明显升高(P<0.05,见表2)。与模型组比较,针刺组大鼠体质量及卵巢质量均降低(P<0.05),lncRNA MEG3 siRNA组大鼠体质量及卵巢质量均升高(P<0.05),lncRNA MEG3 siRNA阴性对照组大鼠体质量及卵巢质量无明显变化(P>0.05,见表2)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠体质量及卵巢质量均升高(P<0.05)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠体质量及卵巢质量均降低(P<0.05,见表2)。
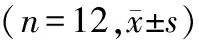
表2 各组大鼠体质量及卵巢质量
2.2 lncRNA MEG3对大鼠性激素水平的影响
与对照组比较,模型组大鼠血清中T、LH水平均明显升高(P<0.05,见表3)。与模型组比较,针刺组大鼠血清中T、LH水平均降低(P<0.05),lncRNA MEG3 siRNA组大鼠血清中T、LH水平均升高(P<0.05),lncRNA MEG3 siRNA阴性对照组大鼠血清中T、LH水平无明显变化(P>0.05,见表3)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠血清中T、LH水平均升高(P<0.05)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠血清中T、LH水平均降低(P<0.05,见表3)。
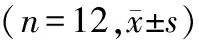
表3 各组大鼠血清中T、LH水平
2.3 lncRNA MEG3对大鼠囊状卵泡数量的影响
与对照组比较,模型组大鼠囊状卵泡数量明显升高(18.64±4.32vs0.75±0.24,P<0.05,见图1)。与模型组比较,针刺组大鼠囊状卵泡数量降低(1.46±0.58vs18.64±4.32,P<0.05);lncRNA MEG3 siRNA组大鼠囊状卵泡数量升高(29.36±5.21vs18.64±4.32,P<0.05);lncRNA MEG3 siRNA阴性对照组大鼠囊状卵泡数量无明显变化(18.95±4.73vs18.64±4.32,P>0.05)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠囊状卵泡数量升高(17.48±4.15vs1.46±0.58,P<0.05,见图1)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠囊状卵泡数量降低(17.48±4.15vs29.36±5.21,P<0.05,见图1)。

黑色箭头表示卵泡图1 各组大鼠卵巢形态的HE染色结果 (×200)Figure 1 Morphology of ovarian in rats in each group by HE staining (×200)
2.4 lncRNA MEG3对大鼠血清炎性介质水平的影响
与对照组比较,模型组大鼠血清IL-17、IL-18及ROS水平明显升高(P<0.05,见表4)。与模型组比较,针刺组大鼠血清IL-17、IL-18及ROS水平均降低(P<0.05),lncRNA MEG3 siRNA组大鼠血清IL-17、IL-18及ROS水平均升高(P<0.05),lncRNA MEG3 siRNA阴性对照组大鼠血清IL-17、IL-18及ROS水平无明显变化(P>0.05,见表4)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠血清IL-17、IL-18及ROS水平均升高(P<0.05)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠血清IL-17、IL-18及ROS水平均降低(P<0.05,见表4)。
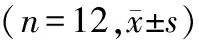
表4 各组大鼠血清IL-17、IL-1β及TNF-α水平
2.5 lncRNA MEG3对大鼠卵巢组织自噬相关蛋白的影响
与对照组比较,模型组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平明显降低(P<0.05,见图2、表5)。与模型组比较,针刺组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平均升高(P<0.05),lncRNA MEG3 siRNA组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平均降低(P<0.05),lncRNAMEG3 siRNA阴性对照组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平无明显变化(P>0.05,见图2、表5)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平均降低(P<0.05)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平均升高(P<0.05,见图2、表5)。

图2 免疫印迹检测各组大鼠卵巢组织自噬相关蛋白表达Figure 2 Expression of autophagy-associated protein in ovarian tissue of rats in each group detected by Western blot
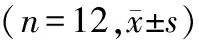
表5 各组大鼠卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白相对表达水平
2.6 各组大鼠卵巢组织lncRNA MEG3及AKT/mTOR通路相关蛋白表达的检测结果
与对照组比较,模型组大鼠卵巢组织lncRNA MEG3水平明显降低(P<0.05),AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平明显升高(P<0.05,见图3、表6)。与模型组比较,针刺组大鼠卵巢组织lncRNA MEG3水平均升高(P<0.05),AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平均降低(P<0.05),lncRNA MEG3 siRNA组大鼠卵巢组织lncRNA MEG3水平均降低(P<0.05),AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平均升高(P<0.05),lncRNA MEG3 siRNA阴性对照组大鼠卵巢组织lncRNA MEG3水平与AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平无明显变化(P>0.05,见图3、表6)。与针刺组比较,针刺+lncRNA MEG3 siRNA组大鼠卵巢组织lncRNA MEG3水平降低(P<0.05),AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平升高(P<0.05)。与lncRNA MEG3 siRNA组比较,针刺+lncRNA MEG3 siRNA组大鼠卵巢组织lncRNA MEG3水平升高(P<0.05),AKT/mTOR通路相关蛋白p-AKT/AKT、p-mTOR/mTOR水平降低(P<0.05,见图3、表6)。
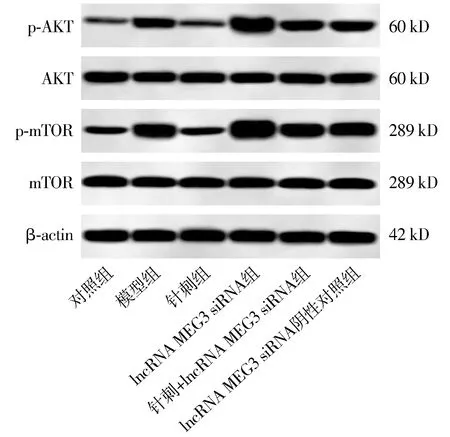
图3 免疫印迹检测各组大鼠卵巢组织AKT/mTOR通路蛋白表达Figure 3 Expression of AKT/mTOR pathway proteins in ovarian tissue of rats in each group detected by Western blot
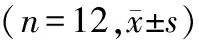
表6 各组大鼠卵巢组织lncRNA MEG3及AKT/mTOR通路蛋白相对表达水平
3 讨论
PCOS严重影响女性的生殖健康和生活质量,目前临床以药物治疗为主,主要包括调经药、胰岛素增敏药、雄激素抑制药和促排卵药,但长期服用会出现副作用和不良反应,因此积极探寻更好的治疗药物是临床亟待解决的难点[1,2,14]。本实验通过高脂饲料喂养并灌胃来曲唑的方法制备PCOS大鼠模型,结果显示,建模大鼠血清T、LH、IL-17、IL-18及ROS水平显著升高,显示大鼠性激素水平分泌异常,体内产生明显炎症,引起大鼠体质量和卵巢质量显著提高,促使囊状卵泡产生,表明大鼠产生PCOS样症状,建模成功。
自噬作用和炎症反应在PCOS的发生发展过程中发挥着关键的调控作用,通过促进自噬,并进行抗炎治疗,可有效减轻PCOS排卵功能障碍和卵巢雄激素分泌过多等临床症状[3,4,15]。研究显示,针刺在PCOS的临床治疗中有广泛应用,可恢复PCOS大鼠动情周期,降低大鼠体内炎症水平,减轻其性激素水平分泌异常[16,17],并可通过增强自噬改善PCOS症状[6],本实验以针刺干预处理PCOS大鼠,可显著降低大鼠体质量、卵巢质量、血清T、LH、IL-17、IL-18及ROS水平、囊状卵泡数量,并升高卵巢组织Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达水平,表明针刺干预可有效降低PCOS大鼠体内炎性因子水平,促进自噬,减少囊状卵泡生成,改善大鼠肥胖及性激素水平分泌异常,与上述研究结果[6,16,17]相似,均证实了针刺可通过抑制炎症,增强自噬来治疗PCOS。
AKT/mTOR是重要的自噬及炎症调控信号,参与介导结肠炎[7]、肺损伤[18]、PCOS等疾病的发病及病情进展过程,下调AKT/mTOR通路可增强自噬活性,修复卵巢功能,改善PCOS临床症状[8,19]。另有研究发现,lncRNA MEG3可通过抑制Akt/mTOR途径激活促进神经元自噬,且针刺可通过抑制mTOR信号增强自噬[6,20],因而推测针刺可能通过lncRNA MEG3抑制AKT/mTOR信号,进而增强自噬,最终达到治疗PCOS的功效。本研究结果显示,PCOS大鼠卵巢组织lncRNA MEG3水平、Beclin-1与LC3Ⅱ/LC3Ⅰ蛋白表达水平降低,p-AKT/AKT、p-mTOR/mTOR水平升高,而针刺治疗可减轻上述变化趋势,且lncRNA MEG3 siRNA起到相反作用,并加重PCOS大鼠肥胖、性激素分泌异常、多囊状卵泡等临床症状,表明lncRNA MEG3可调控AKT/mTOR信号,并介导针刺对PCOS的治疗过程。另外以lncRNA MEG3 siRNA处理PCOS大鼠同时进行针刺治疗,可减弱针刺干预对炎症及肥胖、性激素分泌异常、多囊状卵泡等临床症状的缓解作用,拮抗其对大鼠卵巢功能的修复作用,最终逆转针刺对PCOS大鼠的治疗作用,表明针刺治疗可通过促进lncRNA MEG3表达,抑制AKT/mTOR信号激活,进而增强自噬活性,抑制炎症,对PCOS发挥治疗作用。
综上所述,针刺可通过上调lncRNA MEG3,降低AKT/mTOR通路蛋白的磷酸化水平,促进自噬,抑制炎症产生及进展,改善PCOS大鼠性激素分泌异常,减轻大鼠体质量,减少囊状卵泡形成,有效改善大鼠PCOS样临床症状,通过lncRNA MEG3调控AKT/mTOR介导的自噬途径是其作用机制,本实验为针刺治疗PCOS的临床推广提供了新的科学支持,对提高女性生殖健康水平有积极意义。
