免疫增强剂CVC1302辅助抗原诱导小鼠机体产生长效体液免疫应答的研究
2022-05-21杜露平侯立婷于晓明程海卫郑其升陈瑾
杜露平,侯立婷,于晓明,程海卫,郑其升,陈瑾*
(1.江苏省农业科学院动物免疫工程研究所/江苏省国家兽用生物制品工程技术研究中心/江苏省食品质量安全重点实验室,江苏 南京 210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
口蹄疫(FMD)发病急,传播速度快,对畜牧业造成严重的经济损失,世界卫生组织将其列为A类烈性传染病,我国将其列为一类传染病,同时将其列入强制免疫计划。目前口蹄疫免疫接种主要使用灭活疫苗。报道称,育肥猪首免后40 d抗体水平基本消失,因此需首免后1个月进行加强免疫,种猪1年则需进行3~4次免疫[1],多次免疫无法保障动物福利,且提高了养殖成本。本研究室结合畜牧业实际需求,研制出一种免疫增强剂CVC1302,其与口蹄疫灭活疫苗配伍使用,单剂量免疫猪只即可检测到显著增强的高水平液相阻断抗体,且高水平抗体持续至少6个月[2]。
滤泡辅助性T细胞(follicular helper T cells,TFH)是一种定位于淋巴结滤泡区的CD4+T细胞亚群,是体液免疫的重要调控细胞亚群,辅助B细胞建立生发中心(germinal center,GC)[3]。在GC,B细胞在增殖的同时伴随体细胞高频突变,通过亲和力筛选产生高亲和力抗体和长效体液免疫。CVC1302由Toll样受体和NOD样受体激动剂复配组成,其主要成分为单磷酰脂质A、胞壁酰二肽和β-葡聚糖。前期研究发现,CVC1302可通过促进TFH细胞分化介导FMD灭活疫苗诱导的GC应答,产生分泌高亲和力抗体的长寿浆细胞(long-lived plasma cells,LLPC),为机体提供长效体液免疫应答[4]。然而,由于缺少针对口蹄疫病毒(FMDV)全病毒的特异性荧光抗体,使前期试验仅局限于定性分析。本研究以NP-OVA作为模式抗原,对CVC1302促进TFH细胞、抗原NP特异性GC B细胞、浆母细胞、LLPC分化进行定量分析,以解析CVC1302辅助抗原诱导小鼠机体产生长效体液免疫应答的机制,为新型免疫增强剂及FMDV疫苗的研制提供基础。
1 材料与方法
1.1 试验材料
6周龄BALB/c雌性小鼠购自扬州大学比较医学中心;NP-OVA、NP15-BSA、NP1-BSA和NP-Biotion购自美国Bioscience Technologies公司;单磷酰脂质A(MPLA)购自北京邦定生物医学公司;胞壁酰二肽(MDP)购自上海瀚泓科技有限公司;β-葡聚糖购自河北克隆多生物科技有限公司;佐剂ISA206购自上海Seppic赛彼科特殊化学品有限公司;荧光抗体(anti-CD4 PE-Vio770、anti-CXCR5 FITC、anti-PD-1 APC、anti-B220 FITC、anti-B220 APC、anti-GL-7 PE、anti-GL-7 PE-Vio770、anti-CD138 PE、anti-CD38 PE-Vio770)、Streptavidin-FITC、DAPI和胞内因子染色试剂盒及凋亡检测试剂盒均购自上海优宁维生物科技股份有限公司;Trizol试剂和qPCR mix购自上海皓嘉科技发展有限公司;Hank’s平衡液及DMEM培养基购自Gibco公司。
1.2 试验方法
1.2.1 疫苗制备免疫增强剂CVC1302依据专利(ZL 201310042983.0)配制,MPLA、MDP和β-葡聚糖按照一定比例溶于蒸馏水中,与NP-OVA按照体积比1∶50混合后得到水相。先将ISA206与水相分别放置于室温下约30 min,再将ISA206放入乳化罐中,在200 r·min-1搅拌过程中将水相溶液倒入乳化罐中,搅拌均匀,随后2 000 r·min-1搅拌10 min,获得疫苗NP-CVC1302,其中水相与ISA206的体积比为1∶1,最终每100 μL疫苗中含有50 μg NP-OVA、1 μL CVC1302。
1.2.2 小鼠免疫试验将6周龄BALB/c雌性小鼠21只随机均分为3组,分别于后腿肌肉接种ISA206,NP 或者NP-CVC1302,每只100 μL。利用NP1-BSA或NP15-BSA包被的ELISA板分别检测小鼠免疫后7、14、42、90、120和150 d血清中总NP(NP1)及高亲和力NP(NP15)特异性抗体水平及免疫后42 d血清中NP1特异性IgG1和IgG2a分型抗体水平。
将6周龄BALB/c雌性小鼠9只随机均分为3组,分别于后腿肌肉接种ISA206、NP或者NP-CVC1302,每只100 μL。于免疫后14 d收集腹股沟淋巴结,制备单个淋巴细胞,利用流式细胞仪检测TFH细胞、NP+GC B细胞、NP+浆母细胞分化水平;利用间接免疫荧光法检测GC数目。
将6周龄BALB/c雌性小鼠9只随机均分为3组,分别于后腿肌肉接种ISA206、NP或者NP-CVC1302,每只100 μL。于免疫后14 d收集骨髓液,制备单个淋巴细胞,利用流式细胞仪检测NP+LLPC分化水平。
1.2.3 ELISA检测小鼠NP特异性抗体和分型抗体水平参照文献[5-6],利用NP1-BSA或NP15-BSA包被的ELISA板分别检测小鼠免疫后7、14、42、90、120和150 d血清中NP特异性抗体水平及免疫后42 d血清中NP特异性IgG1和IgG2a分型抗体水平。
1.2.4 间接免疫荧光法观察GC数目免疫后14 d,取小鼠腹股沟淋巴结,纵向剖开并用PBS彻底清洗,之后用4%多聚甲醛室温固定1~4 h,冷冻切片机(CM1950,德国徕卡公司)将淋巴结切成10 μm厚度的切片,再将其置于防脱载玻片上,用PBS清洗以去除多余的部分,用含5% FBS的PBS封闭30 min后,加anti-B220 FITC、GL-7 PE、DAPI染色,用激光共聚焦显微镜(美国铂金埃尔默公司)观察[7]。
1.2.5 小鼠腹股沟淋巴结及骨髓单个淋巴细胞制备免疫后14 d分别收集小鼠腹股沟淋巴结,用含100 U·mL-1青霉素、100 U·mL-1链霉素的预冷PBS缓冲液冲洗4~6次,用眼科剪将其剪成约1 mm3的碎块,随后利用Medimachine系统(美国BD公司)制备单个淋巴细胞[8]。
免疫后42 d收集小鼠后腿胫骨和腓骨,利用无菌PBS缓冲液冲洗获得骨髓冲洗液,200 r·min-1离心 5 min,弃上清液后加入红细胞裂解液重悬细胞,洗涤细胞2次,经70 μm过滤后的滤液于200 r·min-1离心5 min,弃上清液后加入DMEM重悬,制备得到单个淋巴细胞悬液[9-10]。
1.2.6 流式细胞术检测GC应答水平为分析CVC1302对GC应答的影响,流式细胞术检测TFH细胞、NP+GC B细胞和NP+浆母细胞分化水平。各取制备的小鼠腹股沟淋巴结单个淋巴细胞1×106mL-1细胞于3支1.5 mL无菌离心管中,1支利用anti-CD4 PE-Vio770、anti-CXCR5 FITC、anti-PD-1 APC进行染色,利用BD Accuri C6流式细胞仪检测TFH细胞(CD4+CXCR5+PD-1+)数;1支利用胞内细胞因子染色试剂盒对细胞进行破膜固定,然后利用anti-B220 FITC、anti-GL-7 PE-Vio770、NP-Biotion、Streptavidin-FITC进行染色,再用BD Accuri C6流式细胞仪检测NP+GC B细胞(NP+B220+GL-7+CD38+)数;1支利用胞内细胞因子染色试剂盒对细胞进行破膜固定,随后用anti-B220 APC、anti-CD38 PE-Vio770、NP-Biotion、Streptavidin-FITC进行染色,再用BD Accuri C6流式细胞仪检测NP+浆母细胞(NP+B220+CD38+)数目,进而分析小鼠腹股沟淋巴结GC应答水平。
1.2.7 流式细胞术检测骨髓NP+LLPC分化水平取制备的小鼠骨髓单个淋巴细胞1×106mL-1于1支1.5 mL无菌离心管中,利用胞内细胞因子染色试剂盒对细胞进行破膜固定,随后利用anti-B220 APC、anti-CD138 PE、NP-Biotion、Streptavidin-FITC进行染色,再利用BD Accuri C6流式细胞仪检测NP+LLPC(NP+B220+CD138+)数,进而分析小鼠骨髓NP+LLPC分化水平。
1.2.8 相对定量PCR(qPCR)检测抗凋亡转录因子转录水平免疫后42 d,制备小鼠骨髓淋巴细胞,取相同数目的淋巴细胞提取RNA[11]。利用表1中的引物经qPCR[12]检测骨髓淋巴细胞抗凋亡转录因子Mcl-1、Bcl-2、BCMA和BAFF的转录水平。

表1 本试验用引物对序列Table 1 Sequences of primers used in the experiments
1.3 数据处理与差异性分析
利用Graph Prism 8.0软件对数据进行处理分析。采用ANOVA分析各组之间的差异显著性。
2 结果与分析
2.1 CVC1302对小鼠NP特异性抗体及分型抗体水平的影响
利用NP-BSA包被的ELISA平板分别检测免疫后7、14、42、90、120和150 d小鼠NP特异性抗体及分型抗体滴度。结果显示:免疫后7 d,NP和NP-CVC1302组小鼠血清中总NP(NP1)及高亲和力NP(NP15)特异性抗体滴度差异均显著(P<0.05),其余时间点,NP-CVC1302组小鼠血清中NP1或NP15抗体滴度均显著高于NP组小鼠(P<0.001),各检测时间点,ISA206组小鼠血清中NP1或NP15抗体滴度均为所有组最低值(图1-A);免疫后42 d,NP-CVC1302组小鼠NP15/NP1比值显著高于NP组(P<0.01,图1-B),且 NP-CVC1302 组小鼠NP1抗体的IgG1及IgG2a分型抗体均显著高于NP组(P<0.01,P<0.001,图1-C)。上述结果表明,CVC1302不仅可以使免疫小鼠获得长达5个月的体液免疫应答,且抗体亲和力得到显著提高,同时分型抗体滴度也显著提升。

图1 免疫小鼠NP特异性抗体及分型抗体的检测结果Fig.1 NP-specific antibody titers in mice following vaccinated with NP-CVC1302 A.总NP(NP1)及高亲和力NP(NP15)特异性抗体滴度;B. 免后42 d,NP1和NP15特异性抗体滴度及NP15/NP1特异性抗体滴度比值;C. 免后42 d,NP1特异性IgG1及IgG2a分型抗体滴度。 *P<0.05,**P<0.01,***P<0.001。A. Total NP(NP1)and high affinity NP(NP15)specific antibody titers;B. At 42 days post immunization(dpi),NP1 and NP15 specific antibody titers,and the ratio of NP15/NP1 specific antibody titers;C. At 42 dpi,NP1 specific antibody IgG1 and IgG2a titers. *P<0.05,**P<0.01,***P<0.001.
2.2 CVC1302对小鼠腹股沟淋巴结GC应答的影响
小鼠免疫后14 d,取腹股沟淋巴结,利用激光共聚焦显微镜检测小鼠腹股沟淋巴结GC数。结果(图2)显示,免疫后14 d,NP-CVC1302组小鼠单个腹股沟淋巴结中GC数(红色箭头)平均值约为6,而NP组小鼠单个腹股沟淋巴结GC数平均值约为2,2组之间差异极显著(P<0.01)。

图2 免疫后14 d小鼠腹股沟淋巴结生发中心(GC)数检测结果Fig.2 The number of germinal center(GC)in inguinal lymph nodes of mice at 14 dpi following vaccinated with NP-CVC1302
免疫后14 d,取腹股沟淋巴结,制备单个淋巴细胞,流式细胞术检测TFH、NP+GC B细胞和NP+浆母细胞比例。结果(图3)显示:免疫后14 d,NP-CVC1302组小鼠腹股沟淋巴结中TFH占CD4+T细胞比例极显著高于NP组(P<0.01),NP+GC B细胞比例及NP+浆母细胞比例也显著高于NP组小鼠(P<0.01,P<0.05)。
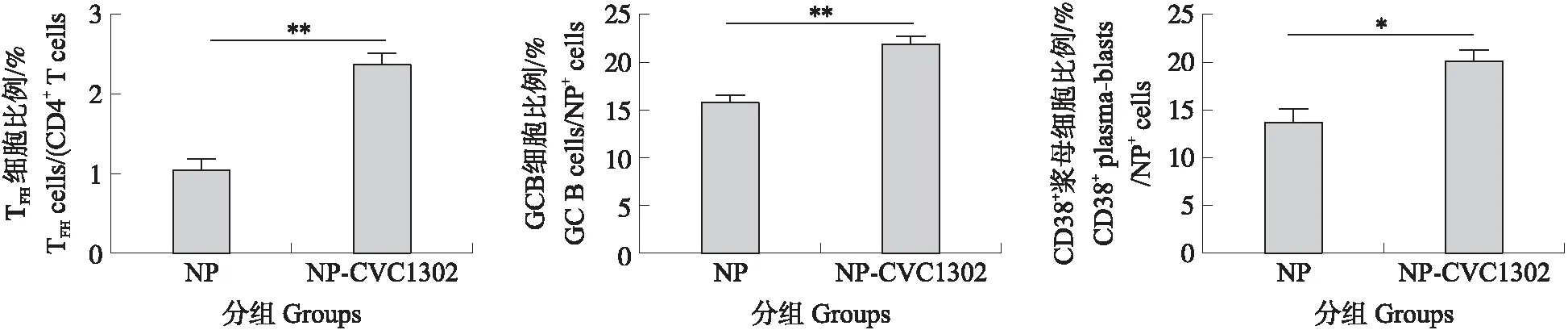
图3 免疫后14 d小鼠腹股沟淋巴结TFH细胞、NP+GC B细胞、NP+ 浆母细胞分化水平的检测结果Fig.3 The differentiation levels of TFH,NP+ GC B cells and NP+ plasma blasts in draining lymph nodes of mice at 14 dpi following vaccinated with NP-CVC1302
2.3 CVC1302对小鼠骨髓LLPC分化水平的影响
小鼠免疫后42 d收集骨髓冲洗液,制备单个淋巴细胞,荧光抗体染色后流式细胞仪检测LLPC分化水平情况。免疫后42 d,小鼠总NP抗体水平最高,因此检测该时间点的NP+LLPC分化水平,以分析CVC1302对诱导小鼠产生长效体液免疫应答的影响。结果(图4)显示,免疫后42 d,NP-CVC1302组小鼠骨髓NP+LLPC比例显著高于NP组小鼠(P<0.01)。此结果表明CVC1302可以促进NP+LLPC分化,为机体提供长效体液免疫应答。

图4 免疫后42 d小鼠骨髓NP+长寿浆细胞(LLPC) 分化水平的检测结果Fig.4 The differentiation levels of NP+ long-lived plasma cells(LLPC)in bone marrow of mice at 42 dpi following vaccinated with NP-CVC1302

图5 免疫后42 d小鼠骨髓淋巴细胞抗凋亡 转录因子的转录水平Fig.5 The levels of anti-apoptotic transcription factors of lymphocyte in bone marrow of mice at 42 dpi following vaccinated with KV-CVC1302
2.4 CVC1302对抗凋亡转录因子转录水平的影响
小鼠免疫后42 d收集骨髓冲洗液,制备单个淋巴细胞,取相同数目的淋巴细胞利用TRIzol试剂提取RNA,并利用qPCR检测各组小鼠骨髓淋巴细胞Mcl-1、Bcl-2、BCMA和BAFFmRNA转录水平。从图5可见:NP-CVC1302组小鼠骨髓淋巴细胞Mcl-1、Bcl-2、BCMA和BAFFmRNA相对转录水平分别为2.93、4.69、6.54和6.16,NP组小鼠4种基因的转录水平分别为0.97、1.17、1.04和1.13,2组之间差异均显著(P<0.05,P<0.001)。上述结果表明,CVC1302可以促进骨髓处LLPC的抗凋亡转录因子Mcl-1、Bcl-2、BCMA和BAFFmRNA 的高水平转录,进而延长LLPC的寿命。
3 讨论
机体接种FMD疫苗后,其产生的抗体水平与机体抵抗病毒能力具有直接相关性[12-13]。免疫增强剂CVC1302是由Toll样受体和NOD样受体激动剂组成,其可以显著提高免疫小鼠和猪的体液免疫应答,抗体持续期可长达6个月[2,11]。因此,探究CVC1302提高机体抗体水平的免疫机制对免疫增强剂及FMD疫苗的研制,具有一定的指导意义。
机体启动免疫应答后,活化的抗原特异性B细胞有两种命运,一种是分化为短寿浆细胞,分泌低亲和力抗体;一种是启动GC应答[14],分化为高亲和力的记忆性B细胞[15]和LLPC,分泌高亲和力抗体[16-18],LLPC迁移至骨髓,持续分泌抗体[19-20]。因此,明确LLPC产生的免疫机制是研制可以诱导持续保护性体液免疫力疫苗的关键要素。
前期对小鼠免疫试验发现,CVC1302可通过促进TFH细胞分化,进而对GC B细胞进行正向选择,促进其分化为浆母细胞,进而随血液进入骨髓,转化为LLPC,持续分泌抗体为机体提供免疫保护力,但研究仅局限于分析FMDV-CVC1302与FMDV两组小鼠之间数据的差异,无法对抗原特异性GC B细胞、浆母细胞乃至LLPC进行测定[4]。本研究以NP为模式抗原,借助NP-PE抗体检测NP+GC B细胞、NP+浆母细胞和NP+LLPC,定量分析免疫增强剂CVC1302辅助抗原诱导机体产生长效体液免疫应答的机制,为新型免疫增强剂的研制提供理论基础及研究方向。
本试验结果显示,免疫增强剂CVC1302可于小鼠腹股沟淋巴结处增强模式抗原NP诱导的TFH细胞分化及GC应答(GC数及NP+GC B细胞比例显著增多),进而TFH细胞对NP+GC B细胞进行正向选择,高亲和力的NP+GC B细胞转化为NP+浆母细胞,随着血流进入骨髓,转变为NP+LLPC,通过抗凋亡转录因子Mcl-1、Bcl-2、BCMA和BAFFmRNA的高水平转录,使其半衰期延长[21-23],持续分泌高亲和力NP+抗体,为机体提供体液免疫保护。
本研究利用NP作为模式抗原,研究免疫增强剂CVC1302诱导LLPC产生的免疫机制,为后续新型免疫增强剂的研制提供研究思路及方向。
