枇杷EjNAC82的克隆及其对类胡萝卜素合成基因EjPSY、EjBCH的转录激活分析
2022-05-20柴吉钏杨民杰董婉琪曹士锋杨震峰施丽愉
柴吉钏 王 康 杨民杰 董婉琪 曹士锋 陈 伟 杨震峰 施丽愉
(浙江万里学院生物与环境学院,浙江 宁波 315100)
类胡萝卜素是一类重要的植物色素,由8个类异戊二烯单位组成,具有多烯链[1-2]。类胡萝卜素广泛存在于自然界,目前已发现的类胡萝卜素多达800余种[3-4],该类物质广泛存在于植物器官并参与多个生物过程,同时其在维持人类健康方面也发挥着重要作用[5]。其中β-胡萝卜素、α-胡萝卜素、β-隐黄质是人体日常所需维生素A的前体[6-7],能在人体或动物体内合成维生素A,其抗氧化活性在预防眼疾等方面具有一定作用[8]。类胡萝卜素可降低许多慢性病的患病风险,而人体不能自主合成类胡萝卜素,依赖饮食摄入,因此类胡萝卜素含量较高的果蔬备受消费者喜爱,如何提高果蔬中类胡萝卜素的含量也成为研究热点[9-11]。
长期以来,通过各种研究方法已经分析构建了植物类胡萝卜素代谢途径。类胡萝卜素的合成开始于MEP途径生成的双(牻牛儿基)二磷酸盐(geranylgeranyl diphosphate,GGPP),通过八氢番茄红素合成酶(phytoene synthase,PSY)、八氢番茄红素脱氢酶(phytoene dehydrogenase,PDS)、ζ-胡萝卜素脱氢酶(ζ-carotene desaturase,ZDS)、ζ-胡萝卜素异构酶(ζ-carotene isomerase,ZISO)催化的一系列去饱和反应和异构化反应形成番茄红素[10-11]。再经番茄红素β-环化酶(lycopene β-cyclase,LCYB)和番茄红素ε-环化酶(lycopene ε-cyclase,LCYE)催化合成α-胡萝卜素,或经LCYB或有色体特异番茄红素β-环化酶(chromoplast-specific lycopene β-cyclase,CYCB)合成 β-胡萝卜素。番茄红素环化产生的α-胡萝卜素和β-胡萝卜素分别形成α-和β-两个分支[6]。随后,在β-胡萝卜素羟化酶(β-carotene hydroxylase,BCH)的催化作用下,将α-胡萝卜素和β-胡萝卜素羟化,在α分支中生成叶黄素,在β分支中生成玉米黄质。玉米黄质通过玉米黄质环氧酶(zeaxanthin epoxidase,ZEP)和堇菜黄素脱环氧酶(violaxanthin deepoxidase,VDE)的环氧化和脱环氧化作用形成叶黄素循环[6]。而枇杷果实中类胡萝卜素的降解主要是β-胡萝卜素在裂解双加氧酶(carotenoid cleavage dioxygenases,CCD)的作用下降解生成β-环柠檬醛和β-紫罗酮[2]。前人研究已克隆得到了胡萝卜[12]、蜜柚[13]、桃[14]、草莓[15]等果实的类胡萝卜素代谢关键酶基因,并进行了表达分析。
转录因子通过结合特定的DNA序列,调控目的基因表达,从而调控各种生物过程[16]。NAC是高等植物中最大且研究最广泛的转录因子家族之一[17]。NAC的命名由最初在牵牛花中发现的NAM(no apical meristem)、拟南芥的ATAF(Arabidopsis transcription activation factor)和CUC(cup-shaped cotyledon)三个名称的缩写各取首字母构成。NAC转录因子由N端一个保守性极强的NAC结构域和C端极不稳定的转录激活域组成[18]。其中,NAC结构域由150个氨基酸残基组成[19],包含5个亚结构域,而C端可变结构域可以通过调节NAC转录因子与各种靶蛋白的相互作用,赋予NAC蛋白不同的功能[17]。在高等植物中,转录因子在细胞质内合成后,通过核孔运输至细胞核内,再与目的基因的启动子结合以调控基因的表达。Gong等[20]通过亚细胞定位分析发现梭梭(Haloxylonammodendron)HaNAC1蛋白定位于细胞核;另有研究从番木瓜(CaricapapayaLinn)果实中鉴定出CpNAC1在细胞核中起转录调控作用[21]。目前越来越多的研究发现NAC转录因子在植物的不同组织中均有表达,在植物的生长发育中发挥着重要作用。番茄(Solanumlycopersicum)中SlNAC1在根、茎、叶、花、幼果和种子中有表达,且在花、幼果和种子中显示较高的表达水平[22];梭梭中HaNAC1在根、茎、叶、种子等组织器官中广泛表达,且在茎中表达量最高[20]。高等植物中不同的转录因子可以通过结合类胡萝卜素代谢相关基因启动子上的不同元件,在转录水平上对基因的表达进行调控,从而调控植物中总类胡萝卜素的积累[23]。已有研究表明,NACBS是NAC转录因子调控类胡萝卜素的典型的识别序列。番木瓜(CaricapapayaL.)CpNAC1可以作用于PDS2/4启动子的NACBS(CGTG/A)位点,上调PDS2/4 基因的表达,从而增加类胡萝素的积累[21]。Fu等[23]也发现,CpNAC2识别并作用于PDS2/4、ZDS、LCYB、BCH启动子上的CGTG/A位点,正调控类胡萝卜素的合成。
枇杷(EriobotryajaponicaLindl.)隶属于蔷薇科,是一种非呼吸跃变型果实。成熟的枇杷是多酚、维生素C、 类胡萝卜素、类黄酮等天然抗氧化物的优良来源[7]。类胡萝卜素是枇杷的主要呈色色素,根据类胡萝卜素组成成分、含量的差异,枇杷可分为红肉枇杷和白肉枇杷两大类[9]。类胡萝卜素在高等植物中的累积是多种因素(包括环境因素、类胡萝卜素代谢途径相关基因的调控、转录因子的调控等)共同调控的结果。郑婷婷等[24]研究早钟6号和白玉两个枇杷品种果实在成熟期间类胡萝卜素的积累变化,发现类胡萝卜素的积累可能受到PSY、LCYE、LCYB、BCH、CYCB等基因的共同调控;Fu等[6,25]也发现类胡萝卜素在不同品种枇杷中的积累受到PSY、CYCB和BCH基因的调控。由上述及其他大量研究表明,枇杷果实中类胡萝卜素的积累受代谢途径关键酶基因的调控,但转录因子对枇杷果实中类胡萝卜素的调控作用相关研究鲜有报道。
迄今为止,多数关于NAC转录因子功能的研究集中于植物生长发育、抗病、抗衰老和响应非生物胁迫等方面的作用,有关NAC转录因子对植物中类胡萝卜素合成调控方面的研究较少。因此本研究以大红袍(红肉枇杷)和白沙(白肉枇杷)为试验材料,利用转录组测序(RNA Sequencing,RNA-Seq)技术对大红袍和白沙进行转录组测序,初步筛选并克隆出1个枇杷NAC转录因子,命名为EjNAC82,对其进行生物信息学和亚细胞定位分析。利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术分析EjNAC82在枇杷不同组织中的表达情况及其在两个品种枇杷果实成熟过程中的表达差异。通过启动子克隆技术克隆得到枇杷果实类胡萝卜素代谢关键酶基因启动子,并进行启动子元件分析,再进一步利用LUC/REN双荧光素酶试验探究NAC转录因子对类胡萝卜素代谢关键基因的转录调控作用,旨在为揭示NAC转录因子对枇杷果实中类胡萝卜素积累的转录调控功能奠定理论基础。
1 材料与方法
1.1 试验材料
本试验采用大红袍(红肉枇杷)和白沙(白肉枇杷)两个枇杷品种,均采自浙江省宁波市象山县新桥镇枇杷园。采集枇杷根、芽、嫩叶、老叶、嫩枝、老枝、幼果、熟果不同的组织样。按照果实的成熟度,将果实发育期分为5个时期:S1期,未转色期,花开后92~98 d;S2期,转色期,112~114 d;S3期,褪绿期,115~120 d;S4期,黄熟期,118~122 d;S5期,成熟期,124~128 d[26]。按以上果实成熟的不同时期,分批摘取,选用大小形状均匀的果实。将采收的样品果实的顶部和底部快速除去,准确地分离其果皮、果肉,并将不同样本立刻分别放入不同用液氮预冷并装满液氮研钵中进行冷冻,随后置于-80℃超低温冰箱中储存备用。
1.2 试验方法
1.2.1 枇杷果实与不同枇杷组织RNA的提取及cDNA的合成 本试验采用植物RNA提取试剂盒(Omega Bio-Tek公司,美国)提取两品种枇杷果实(果皮、果肉)和1.1步骤中采集的其他枇杷组织的总RNA,具体过程参照试剂盒说明书进行。试验过程中加入DNaseI(Omega Bio-Tek公司,美国)以去除总RNA中微量DNA污染,以备后续cDNA合成。本试验中RNA样品浓度和纯度的测定使用NanoDrop 2000核酸蛋白分析仪(Thermo Fisher Scientific,美国)。通过凝胶成像仪(Bio-Rad,美国)观察提取RNA条带的完整性、大小和清晰度。按照SuperRT cDNA第一链合成试剂盒(康为世纪生物科技有限公司,江苏)说明书进行cDNA合成。
1.2.2 枇杷果实NAC转录因子的克隆 将转录组测序所得的NAC转录因子序列在NCBI上进行BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,发现与其他物种(4个物种以上)中的NAC长度相同,表明这个NAC转录因子为全长序列,命名为EjNAC82,再采用ORF Finder程序分析基因的开放阅读框(open reading frame, ORF),验证所获得ORF的正确性。将上述NAC转录因子利用逆转录PCR(reverse transcription-PCR, RT-PCR)技术,以提取的cDNA作为模板,克隆得到EjNAC82基因的ORF序列。
PCR反应体系共10 μL: ddH2O 5.8 μL,dNTP Mix 0.2 μL,SF Buffer 2 μL,250 ng·μL-1cDNA模板1 μL,上下游引物各0.4 μL,Phanta Super-Fidelity DNA pdynerase 0.2 μL。PCR反应程序为:94℃预变性3 min;95℃变性8 s,51℃退火30 s,72℃延伸(延伸时间为30 s·kb-1),33次循环;72℃终延伸10 min。待PCR反应结束后,通过电泳检测其纯度并回收纯化,所得产物通过TA克隆反应与pMD18-T连接成重组载体,经过转化、培养、筛菌、摇菌、提质粒得到阳性克隆子,送上海华大基因进行测序。
1.2.3 生物信息学分析 利用在线工具Protparam(http://web.expasy.org/protparam/)对转录因子编码蛋白的理化性质(包括分子量、等电点、酸碱氨基酸组成、脂溶性指数、亲水系数等)进行预测;通过在线工具Protcomp 9.0进行亚细胞定位预测;利用NCBI网站的BLAST工具进行同源性比对分析,用clustalx 1.83、GeneDoc和MEGA 5.1软件进行同源序列比对、氨基酸序列分析和系统进化树构建。
1.2.4 亚细胞定位 重组载体构建:以cDNA为模板,使用CE Design(Vazyme生物公司专用引物设计软件)进行目的基因特异性引物设计,利用高保真酶Phanta® Super-Fidelity DNA Polymerase(Vazyme,南京)进行PCR扩增。亚细胞定位所使用的载体为pCAMBIA1301-GFP。构建载体所需引物见表1。将目的基因PCR产物和载体酶切产物通过琼脂糖凝胶DNA回收试剂盒(生工生物,上海)进行割胶回收,具体步骤参照说明书。最后,按照ClonExpress®Ⅱ(Vazyme,南京)重组载体试剂盒说明书进行同源重组反应。重组载体转化至大肠杆菌中培养,利用菌液PCR检测得到阳性克隆子并送上海华大基因进行测序。参考秦娟等[27]的方法,将重组质粒转化至农杆菌EHA105感受态。
亚细胞定位观察:参考Shi等[28]的方法,取平板上确定含有阳性克隆子的农杆菌接种于5 mL LB培养基(Luria-Bertani,含50 mg·L-1Rif,50 mg·L-1Kan),28℃、200 r·min-1条件下培养10~12 h。取1 mL上述菌液接种于20 mL LB,28℃、200 r·min-1过夜培养,至OD600大于或等于1.0。吸取1 mL菌液于EP管,5 000 r·min-1离心4 min,弃上清。用1 mL灭菌水重悬菌体,再用1 mL侵染液[含10 mmol·L-12-(N-吗啉代)乙烷磺酸一水[2-(N-morpholino)ethanesulfonic acid,MES],pH值5.6;10 mmol·L-1MgCl2;150 mmol·L-1乙酰丁香酮(acetosyringone,Ace)]重悬菌体,稀释至菌液OD600约为0.3,颠倒混匀后室温避光静置3 h,用于注射。亚细胞定位试验以本氏烟草(Nicotianabenthamiana)为试验材料。选取4片大小相同的烟草真叶叶片,用2 mL注射器将菌液注射至烟草叶背。注射后第2天浇水一次,培养3 d后将烟草背面下表皮细胞撕下制成临时切片,激光共聚焦显微镜下观察荧光信号。
1.2.5 qRT-PCR检测 本试验相关引物通过Primer 6软件设计,引物如表1所示。利用荧光定量引物进行3步法进行qRT-PCR扩增。qRT-PCR程序:95℃预变性7 min;95℃变性15 s,45℃退火30 s,75℃延伸15 s,39个循环。本试验内参引物为EjACT基因(引物见表1,退火温度为41℃),设置阴性对照。采用2-ΔΔCT法对最终的数据进行分析,本试验进行3次生物学重复。
1.2.6 启动子克隆与元件分析 枇杷基因组DNA提取:总RNA提取所用材料为枇杷嫩叶组织,用试剂盒为Magen植物DNA提取试剂盒(广州美基生物科技有限公司),具体过程参照说明书进行。
启动子序列巢式扩增:具体步骤参照Universal GenomeWalkerTM2.0试剂盒(Clontech,美国)进行。待PCR反应结束后,通过电泳检测其纯度并回收纯化,所得产物通过TA克隆反应与pMD18-T连接成重组载体,经过转化、培养、筛菌、摇菌、提取质粒得到阳性克隆子,送上海华大基因进行测序。
启动子元件分析:利用在线工具PLACE数据库(http://www.dna.affrc.go.jp/PLACE/)对枇杷果实类胡萝卜素代谢关键基因的启动子元件进行预测并分析。
1.2.7 LUC/REN双荧光素酶试验 重组载体构建方法同1.2.4。本研究中双荧光素酶试验所使用的载体为pGreenII 62-SK和pGreenII 0800-LUC,阴性对照为空载体pGreenII 62-SK。构建载体所需引物见表1。
烟草注射具体步骤参照1.2.4,其中,LUC/REN双荧光素酶试验中,菌液最后稀释至OD600约为0.25,且待避光完成后将效应基因和报告基因培养液按8∶1 比例混合进行注射。注射完第2天浇水一次,培养3 d 后,用直径为1 cm打孔器将注射部位打出小圆叶片,利用Dual-Luciferase® Reporter Assay System试剂盒(Promega,美国)和Luminoskan Ascent化学发光分析仪(Thermo,美国)测定叶片侵染区中萤火虫光素酶(firefly luciferase,LUC)与海肾光素酶(renilla luciferase,REN)催化产生的荧光信号。计算 LUC/REN 比值,归一化为阴性对照,每个组合重复试验4次。
1.2.8 引物设计 引物由上海生工生物工程技术有限公司合成,具体引物信息如表1所示。

表1 试验所需引物Table 1 Primers required for the experiment
2 结果与分析
2.1 枇杷果实EjNAC82转录因子的克隆及序列分析
以枇杷果实cDNA为模板克隆得到长度为1 668 bp的EjNAC82开放阅读框序列。该基因编码的氨基酸一级结构预测结果表明,EjNAC82蛋白分子量为61.73 kDa,等电点为4.63,将酸、碱性氨基酸组成比例结合理论等电点分析,发现EjNAC82蛋白呈酸性。不稳定指数为46.40,表明EjNAC82蛋白较稳定。其脂溶指数和亲水指数分别为68.13和-0.475,说明该蛋白有较好的脂溶性和亲水性。通过亚细胞定位预测发现,EjNAC82定位于细胞核内。
2.2 枇杷果实EjNAC82结构预测、氨基酸序列分析和系统进化树分析
EjNAC82蛋白的二级结构预测结果表明,α螺旋、β转角、延伸链、无规则卷曲分别约占20.00%、7.39%、15.14%、57.48%,即EjNAC82蛋白二级结构以无规则卷曲为主(图1-A),此结果与该蛋白三级结构预测结果相一致(图1-B)。
将EjNAC82基因编码的氨基酸序列利用NCBI数据库BLAST下载该基因的同源序列,包括秋子梨、白梨、欧洲甜樱桃、梅花、毛桃、扁桃、东京樱花等物种。同源性分析发现,EjNAC82与秋子梨(Pyrusussuriensis×Pyruscommunis,KAB2622897.1)、白梨(Pyrus×bretschneideri,XP_018499492.1)的NAC转录因子氨基酸序列相似度高达90%以上;与其他物种,欧洲甜樱桃(Prunusavium,XP_021830704.1)、梅花(Prunusmume,XP_008237527.1)、毛桃(Prunuspersica,XP_007201045.1)、扁桃(Prunusdulcis,XP_034229875.1)、东京樱花(Prunusyedoensisvar.Nudiflora,PQQ06771.1)有少量氨基酸存在差异,相似度达60%以上。将EjNAC82氨基酸序列与以上7个物种的NAC蛋白氨基酸序列进行比对,结果发现,EjNAC82蛋白的N端包含NAC转录因子家族特有的保守极高的NAC结构域,包含5个亚结构域(A~E),C端差异较大,是极不稳定的转录激活域(图2)。

图1 EjNAC82蛋白的二级(A)、三级(B)结构预测Fig.1 The deduced secondary (A) and tertiary (B) structure of EjNAC82 proteins

图3 EjNAC82转录因子系统发育树Fig.3 Phylogenetic tree of EjNAC82 transcription factor
为进一步研究枇杷EjNAC82蛋白的系统进化关系,用MEGA5.1软件分析了与其同源性较高的白梨、苹果、湖北海棠、毛桃、梅花、秋子梨、扁桃7个物种中NAC家族基因的亲缘关系。结果表明,枇杷EjNAC82与秋子梨PuNAC、白梨PbNAC的聚类于同一分支,亲缘关系最近(图3)。
2.3 EjNAC82蛋白的亚细胞定位
通过在线预测软件进行亚细胞定位预测,结果表明,EjNAC82蛋白定位于细胞核。为进一步验证EjNAC82蛋白亚细胞定位,本试验构建了重组蛋白EjNAC82-GFP(图4),空载pCAMBIA1301-GFP作为对照。
激光共聚焦显微镜下观察发现,对照35S::GFP的整个烟草叶片细胞内都检测出绿色荧光荧光信号,而35S::EjNAC82-GFP烟草叶片细胞中只在细胞核内检测观察到绿色荧光信号(图4)。上述结果表明EjNAC82蛋白定位于细胞核并行使其功能。
2.4 枇杷果实EjNAC82基因表达分析
通过qRT-PCR测定大红袍和白沙两品种枇杷根、芽、嫩叶、老叶、嫩枝、老枝、幼果、熟果8种不同的组织中EjNAC82的表达量,结果表明,EjNAC82基因在根、芽、嫩叶、老叶、嫩枝、老枝、幼果、熟果组织中均有表达。其中,EjNAC82在老叶中的表达最高,且大红袍老叶中的表达显著高于白沙老叶(P<0.05)(图5)。
通过qRT-PCR测定分析大红袍和白沙两品种枇杷果实成熟过程中EjNAC82基因的表达。结果发现,EjNAC82在果皮和果肉成熟过程中的表达模式相同,呈先上升后下降再上升的趋势。随着果实的成熟,EjNAC82在S1、S3、S4、S5时期大红袍果肉中的表达量显著高于同时期白沙(P<0.05)。EjNAC82在大红袍枇杷果皮S2时期的表达量显著高于白沙,而在S3和S5时期白沙中EjNAC82的表达量显著高于大红袍(P<0.05)(图6)。
2.5 枇杷果实类胡萝卜素代谢关键基因启动子克隆及顺式作用元件分析
利用Genome Walking技术从枇杷中扩增出EjPSY1、EjPSY2和EjBCH3个基因的启动子片段,长度分别为1 043、1 607、726 bp。通过在线软件PLACE分析启动子序列上的顺式作用元件。
EjPSY1启动子上含有7个NAC蛋白结合位点NACRS,其中含3个[CACG]、7个[CGTA]识别序列。由此推测,NAC转录因子可能识别并结合EjPSY1启动子。此外,EjPSY1启动子上含有17个CAAT-box真核生物核心启动子元件、多个光响应元件(2个AE-box、1个TCT-motif、1个GATA-motif、1个GT1-motif)和激素响应元件(1个P-box和1个TGACG-motif)(表2)。
EjPSY2启动子上含有9个NAC蛋白结合位点NACRS,其中含4个[CACG]、6个[CGTG]和4个[CGTA]识别序列。由此推测,NAC转录因子识别并结合EjPSY2启动子。此外,EjPSY2启动子上含有19个CAAT-box真核生物核心启动子元件、多个光响应元件(1个AAAC-motif、7个Box 4、1个G-Box、2个GT1-motif、1个LAMP-element)和激素响应元件(2个ABRE、2个GARE-motif、1个TCA-element)(表3)。
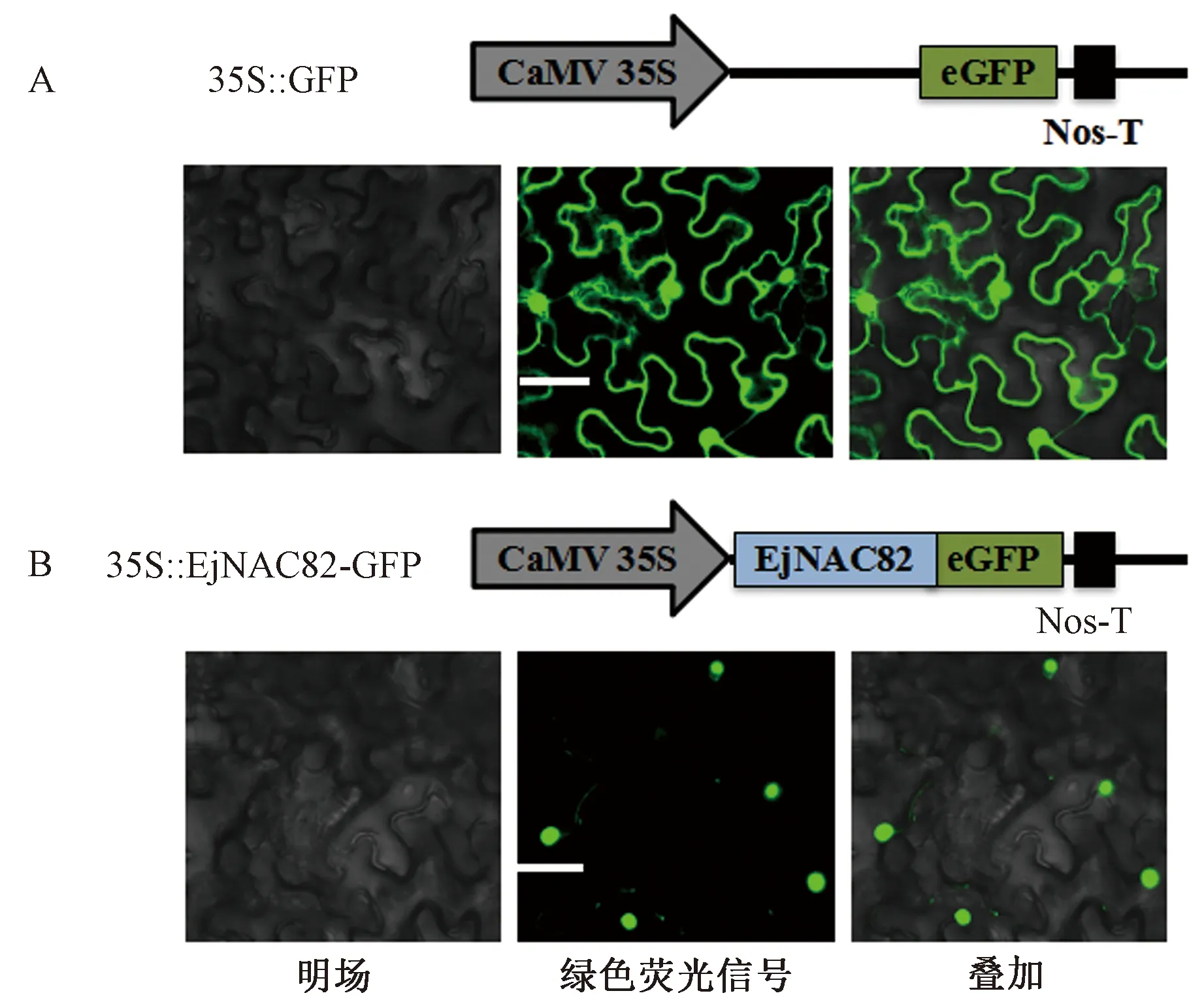
注:标尺50 μm。Note: Scale bars=50 μm.图4 EjNAC82蛋白在烟草表皮细胞中的亚细胞定位Fig.4 Subcellular localization of EjNAC82 protein in tobacco epidemic cells
EjBCH启动子上含有6个NAC蛋白结合位点NACRS,其中含1个[CGTG]和3个[CGTA]识别序列。由此推测,NAC转录因子均可能识别并结合EjBCH启动子。此外,EjBCH启动子上含有14个CAAT-box真核生物核心启动子元件、1个Box 4光响应元件和多个激素响应元件(2个CGTCA-motif和2个TGACG-motif)(表4)。
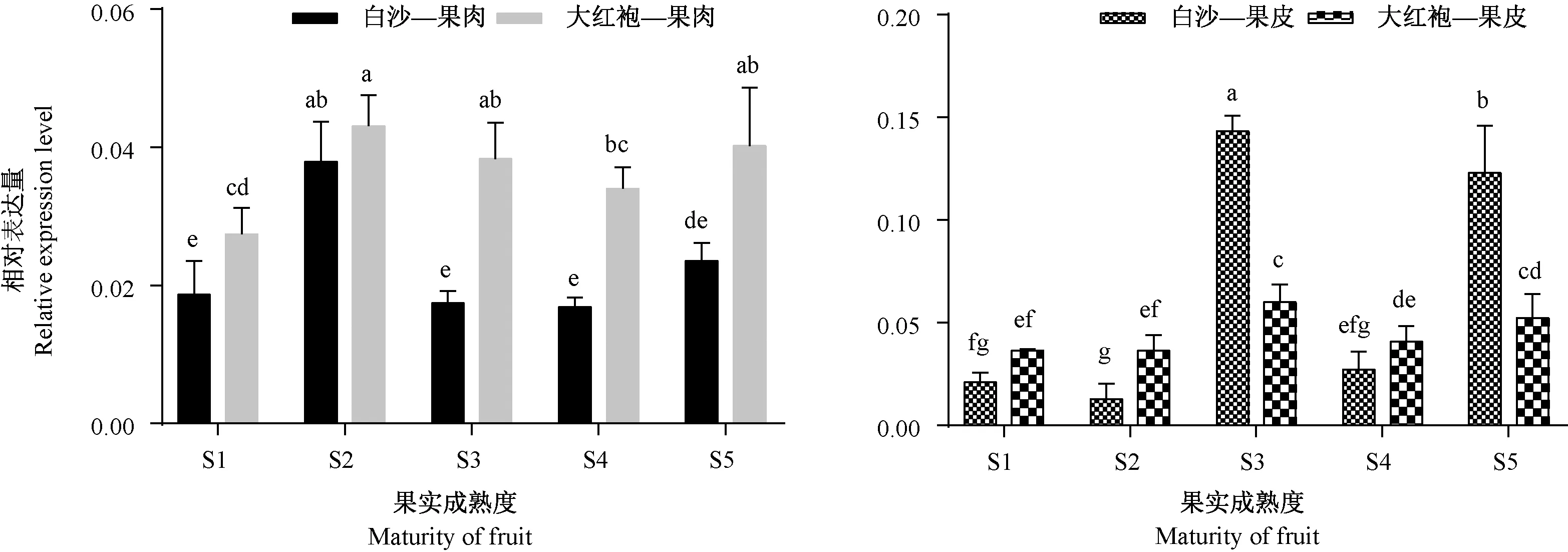
图6 枇杷成熟过程中EjNAC82基因表达变化Fig.6 Changes of EjNAC82 expression in loquat fruit during ripening
2.6 NAC转录因子对枇杷类胡萝卜素代谢关键酶基因启动子的激活作用
为进一步研究NAC转录因子对EjPSY1、EjPSY2和EjBCH启动子的转录激活作用,通过同源重组的方法,将EjNAC82基因的ORF序列插入pGreenⅡ62-sk构建效应基因重组载体,将EjPSY1、EjPSY2和EjBCH启动子序列插入pGreenⅡ0800-LUC构建报告基因重组载体(图7)。
LUC/REN双荧光素酶试验结果显示,与空载体相比,EjNAC82转录因子与EjPSY1、EjPSY2、EjBCH启动子的共转化使萤火虫荧光素酶产生的荧光信号(LUC)与海肾荧光素酶产生的荧光信号(REN)的比值(LUC/REN)极显著升高(P<0.001),说明EjNAC82转录因子对EjPSY1、EjPSY2、EjBCH启动子具有转录激活作用(图8)。
3 讨论
NAC转录因子是植物中被广泛研究的转录因子家族,该转录因子参与调控高等植物的生长发育,对果实的成熟起着关键作用[20]。本试验从枇杷果实中克隆得到1个NAC转录因子,命名为EjNAC82。生物信息学分析表明,EjNAC82蛋白pH值呈酸性,较稳定,且有良好的脂溶性和亲水性;EjNAC82蛋白二级结构以无规则卷曲为主,且与蛋白三级结构预测结果相一致。同源性分析发现,EjNAC82蛋白与秋子梨PuNAC、白梨PbNAC蛋白相似度高达90%以上。氨基酸序列比对发现,EjNAC82转录因子含有高度保守的NAC结构域(包含A~E共5个子结构域)和多变的C端转录激活域。以上结果与其他植物已有研究中的NAC转录因子结构特点相同[29-31],表明本试验中克隆的EjNAC82基因属于NAC转录因子。

表2 EjPSY1启动子序列顺式作用元件分析Table 2 Analysis of EjPSY1 promoter sequence cis-acting element

表3 EjPSY2启动子序列顺式作用元件分析Table 3 Analysis of EjPSY2 promoter sequence cis-acting element
已有大量研究表明,转录因子在植物细胞核发挥转录调控作用,且在木瓜[21]、梭梭[20]中发现的NAC转录因子均定位于细胞核内。本试验对EjNAC82蛋白进行亚细胞定位预测发现,该蛋白定位于细胞核内,并通过亚细胞定位试验对其进行验证,试验结果与预测结果一致,说明EjNAC82在细胞核发挥转录调控作用。
本研究通过qRT-PCR分析发现,该基因在大红袍和白沙两品种枇杷不同组织中均有表达,且在老叶中的表达最高,在大红袍老叶中的表达显著高于白沙老叶(P<0.05),说明该基因可能对枇杷叶片的生长发育有着关键作用。Fan等[32]研究发现包心菜(Brassicarapassp. parachinensis)BrNAC041转录因子可调控叶片衰老。此外,越来越多的研究证明,NAC转录因子在果实类胡萝卜素合成中有转录调控的作用。其中番茄果实SlNAC1的表达量随着果实成熟而增加,直至裂果后7 d达到最高水平,且SlNAC1通过上调SlPSY1基因的表达,正调控类胡萝卜素的合成[22]。本试验发现,随着枇杷果实的成熟,EjNAC82在S1、S3、S4、S5时期大红袍果肉中的表达量显著高于白沙(P<0.05),结合前人研究结果推测,EjNAC82基因可能正调控枇杷果实类胡萝卜素的合成与积累。

表4 EjBCH启动子序列顺式作用元件分析Table 4 Analysis of EjBCH promoter sequence cis-acting element

图7 载体构建原理图Fig.7 Schematic diagrams of vectors construction
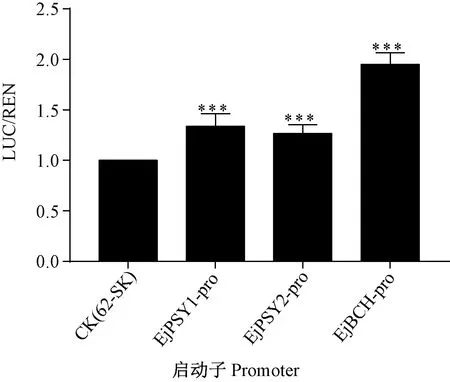
注:***表示P<0.001水平上差异极显著。Note: *** indicates significant difference at 0.001 level.图8 EjNAC82对EjPSY1/2和EjBCH启动子的调控作用Fig.8 Regulation of EjNAC82 on EjPSY1/2 pro and EjBCH pro
利用启动子克隆技术,克隆得到枇杷果实类胡萝卜素代谢关键基因(EjPSY1、EjPSY2和EjBCH)的启动子片段,对其启动子进行元件分析发现,这些启动子序列上含有多个真核生物核心启动子元件和激素响应元件,且含有数个NAC蛋白结合位点NACRS,说明NAC转录因子可能通过结合这些关键酶基因启动子上的NACRS位点对酶基因发挥转录调控作用。已有研究发现,木瓜CpNAC1可以作用于PDS2/4启动子的NACBS(CGTG/A)元件,上调PDS2/4基因的表达,从而上调类胡萝素的积累[21]。Fu等[6]同样发现,CpNAC2识别并作用于PDS2/4、ZDS、LCYB、BCH启动子上的CGTG/A位点,正调控类胡萝卜素的合成。本试验利用LUC/REN双荧光素酶试验明确了EjNAC82转录因子能激活EjPSY1、EjPSY2和EjBCH启动子,即EjNAC82可能通过激活EjPSY1、EjPSY2和EjBCH启动子,上调EjPSY1、EjPSY2和EjBCH基因的表达,从而正调控枇杷果实类胡萝卜素的合成与积累。
4 结论
本研究克隆得到1个枇杷NAC转录因子EjNAC82。生物信息学分析结果发现,EjNAC82蛋白具有NAC转录因子特有的理化性质、蛋白质结构,与秋子梨PuNAC、白梨PbNAC蛋白相似度高达90%以上,且含有高度保守的NAC结构域和多变的C端转录激活域。亚细胞定位试验结果表明,EjNAC82在细胞核中起转录调控作用。qRT-PCR结果表明该基因可能正调控枇杷果实类胡萝卜素的合成与积累。LUC/REN双荧光素酶试验进一步明确了EjNAC82转录因子能激活EjPSY1、EjPSY2和EjBCH启动子。
