乳腺癌脑转移放疗的临床疗效和预后分析
2022-05-19陆春花
黄 艳 张 莹 宋 瑶 陆春花 胡 杰 陈 曦 林 清
乳腺癌是女性最常见的恶性肿瘤,占女性发病率第一,癌症相关死亡第二,仅在美国每年就有超过41000人死亡[1]。随着医学影像技术的迅速发展,乳腺癌的早期诊断率逐渐提高,但仍有约2.7%的患者初诊即发生远处转移。且随着乳腺癌治疗方式的多样性,患者生存时间延长,乳腺癌脑转移发病率逐年升高[2]。约20%恶性肿瘤患者在整个治疗过程中会出现脑转移,其中约30%~50%的乳腺癌患者最终发展为脑转移[3]。乳腺癌脑转移发生率及治疗疗效与原发乳腺癌的分子分型相关,其中Her-2阳性及三阴性型乳腺癌更容易发生脑转移[4]。乳腺癌脑转移的治疗是姑息性治疗,包括手术治疗、放疗、化疗、靶向、内分泌等系统治疗。因为血脑屏障的存在,单纯化疗对乳腺癌通常是无效的。全颅照射是治疗脑转移癌常用姑息手段,特别对于多发颅内病灶,一般情况差,合并症多的患者,全脑放疗可有效延长脑转移的生存[5-7]。本文回顾性分析上海市第十人民医院接受全脑放疗的乳腺癌脑转移患者,对其临床特点及预后生存进行分析。
1 资料与方法
1.1 一般临床资料
回顾性分析同济大学附属上海第十人民医院自2016年01月至2019年12月收治并诊断为乳腺癌脑转移患者56例的临床资料。纳入分析的临床资料包括年龄、乳腺癌初诊时间,乳腺癌初诊时肿瘤TNM分期、病理类型、组织学类别、激素受体、Her-2表达、分子分型、治疗方式,脑转移的发生时间、脑转移数量、颅外转移情况、原发灶控制情况、肿瘤标志物、KPS评分、GPA评分、治疗方式等。纳入患者均无其他恶性肿瘤病史,经活检或者术后病理学证实为乳腺癌,经颅脑CT、MRI诊断为脑转移。采用Breast-GPA评分系统对所有乳腺癌脑转移患者进行评估。剔除合并其他严重器质性疾病、KPS<60分患者。
1.2 预后分级及分子分型
按照诊断专用评估预后分级(Diagnosis Specific Graded Prognostic Assessment,DS-GPA)标准进行评分,其中GPA对乳腺癌脑转移患者评估主要根据年龄(≥60岁为0分,<60岁为0.5分),卡氏评分(Karnofsky,KPS,≤60为0分,70~80为0.5分,90~100为1分)、分子分型(三阴型为0分、Luminal A型为0.5分、Luminal B型为1.5分,Her-2过表达型为1.5分)、脑转移数量(1个为0.5分,>1个为0分)、颅外转移情况(是为0分、否为0.5分)进行预后分级。乳腺癌分子分型:Luminal A型ER(+),PR(+)高表达,HER-2(-),KI-67<20%;三阳性型是 ER(+),PR(+),HER-2(+),KI-67任何;Luminal B Her-2阴性型是 ER(+),PR(-)或低表达,HER-2(+/-),KI-67≥20%;三阴型是ER(-),PR(-),HER-2(-),KI-67任何;Her-2过表达型是ER(-),PR(-),HER-2(+++),KI-67任何。HER-2免疫组化结果判读,HER-2(+++),结果为阳性;HER-2(++),结果不确定,应进一步通过原位杂交等方法进行基因状态的检测,就是FISH的结果;HER-2(+),HER-2(-),结果均为阴性。
1.3 统计学分析
采用Fisher精确检验或χ2检验对计量数据进行分析。采用方差分析(ANOVA)对连续性数据进行统计分析。OS统计采用Kaplan-Meier法,对单因素生存分析有意义的变量,采用Cox回归分析评估影响生存的预后因素。脑转移后生存率与距原发乳腺癌初诊时间、距乳腺癌首次远处转移时间间隔等相关性检验行Pearson法分析。本研究中所有P值均为双侧的。P<0.05则认为具有统计学差异。本研究采用SPSS 19.0(SPSS Inc,Chicago,IL)软件进行统计学分析。总生存期(overall survival,OS)定义为从脑转移接受放疗开始至任何原因引起的死亡日期或最后随访日期计算的时间。生存时间以月表示。
2 结果
2.1 脑转移前患者及原发灶特征
56例乳腺癌平均年龄为54.9岁(30~79岁),主要组织学类型为浸润性导管癌(96.4%)。FISH检测Her-2阳性患者15例(26.8%),被诊断为Luminal A、三阳性型、Luminal B Her-2阴性型、Her-2过表达型和三阴型的患者分别为:2例(3.6%)、2例(3.6%)、13例(23.2%)、13例(23.2%)和26例(46.4%)。肿瘤T2-T3占83.9%,淋巴结受累占69.6%,6例(10.7%)初诊即为乳腺癌颅外转移。56例患者中,6例患者乳腺癌原发灶未接受治疗,11例(19.6%)行保乳治疗,39例(69.7%)行根治性手术治疗。6例患者接受了新辅助化疗(10.7%),50例接受辅助化疗(89.2%),接受内分泌治疗占53.6%,曲妥珠单抗治疗15例(表1)。
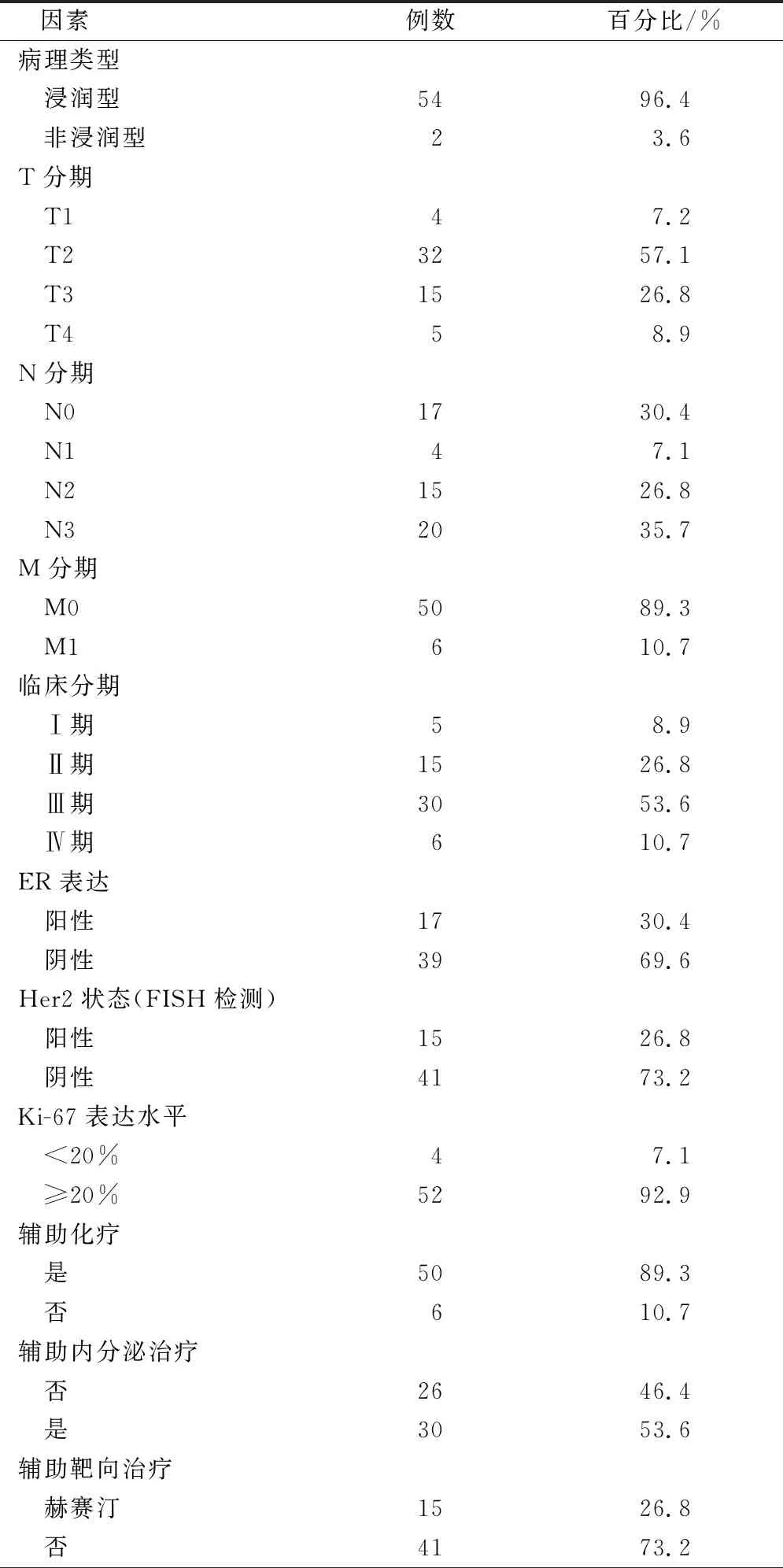
表1 患者初诊乳腺癌时的一般临床资料
2.2 脑转移首次放疗时患者及转移灶特征
乳腺癌脑转移首次放疗时的平均年龄为57.9岁(32~82岁)。根据GPA 评分系统分析所有患者:0~1.0分24例(42.8%),1.5~2.0分13例(23.2%),2.5~3.0分17例(30.4%),3.5~4.0分2例(3.6%)。3例患者在确诊乳腺癌1年内即发生脑转移。以脑为首发转移灶占39.3%,17例(30.4%)患者仅出现脑转移,无其他远处转移。所有患者均接受全颅放射治疗:以全脑勾画临床靶区,再将临床靶区外扩 2 cm 获得计划靶区,照射剂量为3 Gy/次,5 次/周,总照射剂量为30 Gy。21例(37.5%)根据转移灶数量和部位进行了局部加量9Gy/3Fx/3d,2例(3.6%)放疗前行脑外科手术。所有患者中,6例(10.7%)患者因KPS评分差未接受全身治疗,50例患者接受1~3种全身治疗:化疗29例(58.0%),内分泌10例(20.0%),靶向治疗19例(38.0%),见表2。

表2 患者脑转移首次放疗时的一般临床资料
2.3 预后因素分析
单因素分析显示:GPA评分2.5~3.0分、GPA评分3.0~4.0分、有肺转移、脑转移放疗时KPS评分、是否幕下转移、Her-2表达状态、分子分型三阳性型、Her-2过表达型、脑转移放疗后化疗(P=0.041)是OS的独立影响因素(表3)。多因素分析显示:高KPS评分、高GPA评分、分子分型(三阳性型和Her-2过表达型)、无颅外转移、无肺转移、脑转移放疗后接受化疗是乳腺癌脑转移放疗患者预后的保护因素,具有显著统计学差异(表4)。

表3 脑转移首次放疗时不同因素的单因素K-M生存分析

表4 脑转移首次放疗因素的多因素Cox回归分析结果
2.4 生存分析
随访时间截止至2020年12月31日,随访率为100%,随访方式包括门诊复查、病案及电话随访。从患者确诊乳腺癌至诊断脑转移的中位时间25.4个月,均值32.4个月(1.1,102);乳腺癌至首次远处转移的中位时间12.8个月,均值16.3个月(0,49.7);首次远处转移至诊断脑转移的中位时间6.0个月,均值16.2个月(0,86.0)。患者脑转移首次放疗后的中位OS为12.1个月(95%CI:8.7~15.5),1、2年OS分别为52.6%、26.1%(图1)。伴及不伴有颅外转移的中位OS分别为11.7个月(95%CI:7.3~16.1)和22.6个月(95%CI:1.1~44.1),颅外转移脏器≥3个的中位OS分别为6.5个月(95%CI:3.1~9.7)。颅内转移灶1个、≥2个中位OS分别为27.6个月(95%CI:0.3~44.9)和9.5个月(95%CI:5.4~13.5)。GPA评分0.0~1.0、1.5~2.0、2.5~3.0、3.5~4.0中位OS分别是6.2、9.3、14.1、23.9个月(P=0.036)。19例脑转移患者放疗后使用靶向治疗,2例Her-2过表达型使用贝发珠单抗(存活),2例LuminalB Her-2阴性型使用爱博新治疗(存活),6例Her-2过表达型、2例LuminalB Her-2阳性型使用赫赛汀治疗。5例三阴型患者使用阿帕替尼,其中4例死亡(OS:6.0,7.0,8.5个月),1例存活(OS:3个月)。
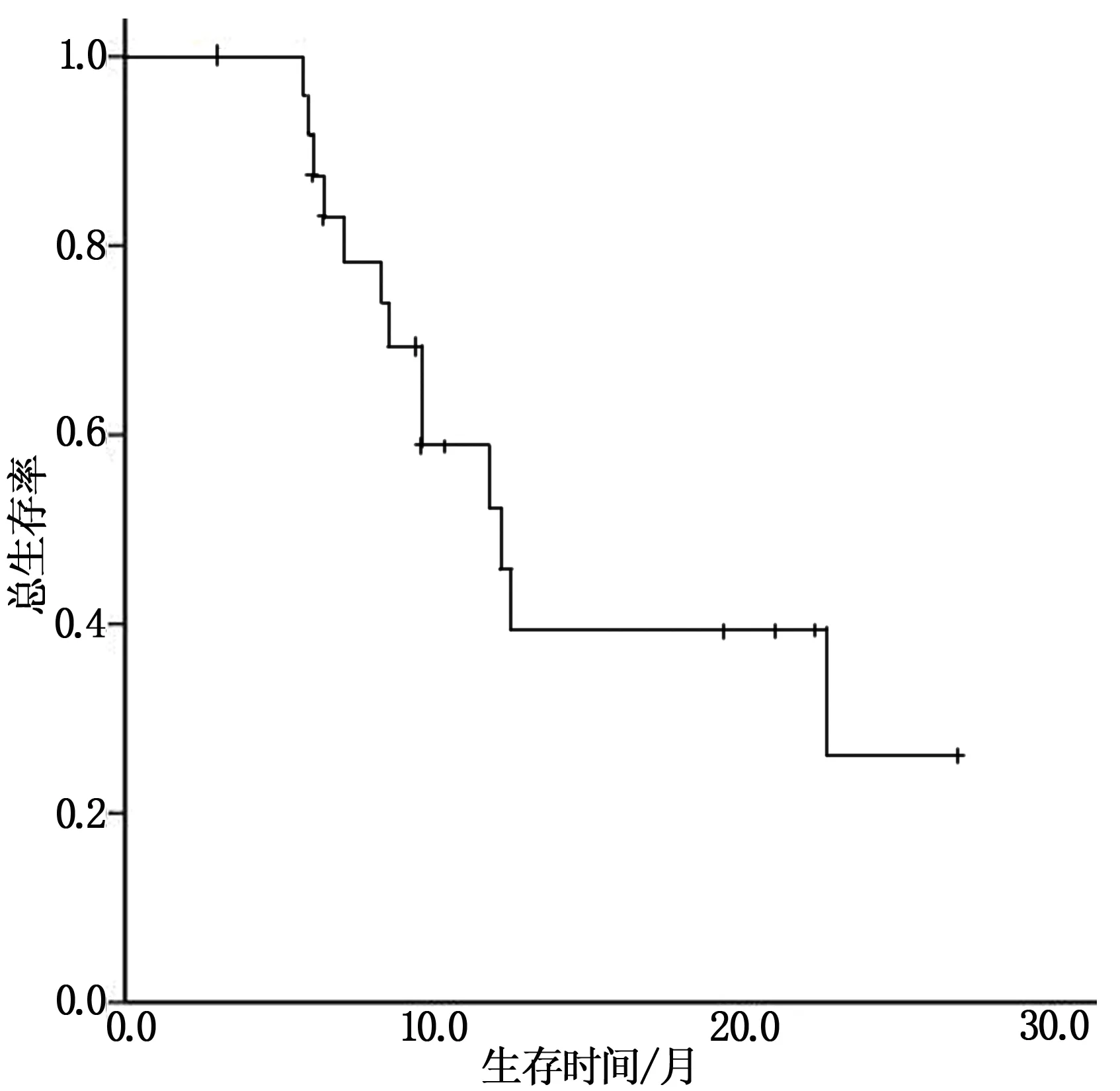
图1 患者1、2年总生存图
3 讨论
乳腺癌远处转移是乳腺癌患者肿瘤相关性死亡的主要原因之一,即使原发灶很小,也易发生血行转移,部分乳腺癌在首次确诊时即有远处转移,淋巴结、肺、骨、肝、肾上腺、脑和脑膜是最适宜的传播部位[8]。尽管在过去的几十年中不断涌现了很多新的治疗手段,乳腺癌仍然是欧洲妇女的主要死亡原因,也是全世界癌症死亡的主要原因。血脑屏障的存在使能到达中枢神经系统的有效辅助治疗很少,这反过来又可能导致更多的脑转移患者[9],因此乳腺癌脑转移越来越常见。发生脑转移后患者不仅生存期缩短,而且绝大多数都有明显的中枢症状,严重损害了日常活动和生活质量,如认知功能障碍、严重头痛、头晕、恶心、眩晕,和癫痫发作[10]。目前此类患者的治疗方式和治疗疗效都是有限的。乳腺癌脑转移患者约70%出现颅内多发转移,全脑放疗的平均剂量为30Gy/10Fx,约86.5%的患者在全颅放疗4周后KPS评分明显提高[11]。本研究中,放疗前有明显中枢症状患者占62.5%,13例(23.2%)KPS评分70~80分,12例(21.4%)60~70分。对伴有严重中枢症状的脑转移患者,全颅放疗联合脱水治疗后症状显著缓解及KPS明显提高,很大程度上改善了患者的生活质量。
Thulin等研究提出乳腺癌术后的辅助治疗,化疗、内分泌、靶向治疗等辅助治疗均不能抑制或者延迟脑转移的发生[9]。但也有研究提出根据乳腺癌的分子分型,积极针对性进行辅助治疗,可以更早发现脑转移及提高治疗疗效[12]。不同分子分型的乳腺癌脑转移的发生率及预后有所不同,对比Luminal型乳腺癌,三阴型患者更容易出现脑转移及复发[13]。在我们的研究中,单因素分析也显示乳腺癌原发灶术后辅助化疗、靶向治疗、内分泌对脑转移的发生发展均无统计学差异。采用相关性检验Pearson法分析提示脑转移的发生与距原发乳腺癌初诊时间、距乳腺癌首次远处转移时间间隔均无线性相关性。但是本研究的病例数少,存在统计学分析偏差,需要进一步扩大样本量探讨。
来自新加坡的学者Zhuang等分析了282例乳腺癌脑转移患者,单因素、多因素分析均显示更高的GPA评分患者的生存获益显著,同时他们多因素分析提示患者脑转移的年龄,KPS评分、脑转移数量,肿瘤的分子分型、无颅外转移均是生存独立预后因子[14]。与研究者的结果相仿,本研究的单多因素分析也显示脑转移高KPS评分、高GPA评分、分子分型、无颅外转移均有显著的统计学差异。生存分析中伴及不伴有颅外转移的中位OS分别为11.7个月(95%CI:7.3~16.1)和22.6个月(95%CI:1.1~44.1),颅外转移脏器≥3个的中位OS分别为6.5个月(95%CI:3.1~9.7)。颅内转移灶1个、≥2个的中位OS分别为27.6个月(95%CI:0.3~44.9)和9.5个月(95%CI:5.4~13.5)。本研究多因素分析提示脑转移放疗后接受化疗(P=0.034)也是独立预后因子。全脑放疗后可能一定程度破坏了血脑屏障,进而进入颅内的化疗药物浓度增加,增加了化疗疗效。有研究验证了脑转移放疗后联合化疗,总缓解率增加了4%~38%[15,16]。
三阴型及激素受体阳性/Her-2阴性的脑转移患者预后更差[4]。一项来自日本24个研究机构的大数据研究,共纳入了1256例BCBM患者进行分析,提出Luminal、Luminal Her-2阳性、Her-2过表达、三阴型患者中位生存时间分别为9.3、16.5、11.5、4.9个月,Luminal Her-2阳性型BCBM患者生存时间显著高于Luminal型(HR=1.5,P<0.0001)及三阴型患者(HR=1.97,P<0.0001)[12]。我们的研究患者中位的OS为12.1个月(95%CI:8.7~15.5),1、2年OS分别为52.6%、26.1%,多因素分析提示预后和分子分型相关。本研究中有4例三阴型患者因一般情况差,在脑转移放疗后只接受阿帕替尼治疗,截止至随访结束,其中3例死亡(OS:6.0,7.0,8.5个月),1例存活(OS:3个月)。阿帕替尼是一种抗VEGFR-2的小分子靶向药物,有可能直接作用于血脑屏障发挥作用,有个案报道KPS评分差的三阴型乳腺癌脑转移患者使用阿帕替尼单药治疗后生活质量明显改善[17],但具体作用机制、是否能延长总生存目前仍然不清楚。
综上,本研究结果显示分子分型、脑转移放疗后化疗、无颅外转移、高GPA评分、高KPS评分是乳腺癌脑转移患者重要的预后影响因素。对于三阴型乳腺癌脑转移患者,阿帕替尼是否可延长生存期,期待更大样本量的临床研究进一步验证。
