中药前胡在不同生产环节中的5种香豆素类成分含量变化的高效液相色谱法测定
2022-05-18宋向文李肖莉陈存武韩邦兴
贾 彬,王 芳,宋向文,李肖莉,陈存武,3,,韩邦兴,3
(1.安徽中医药大学 药学院,安徽 合肥 230031;2.皖西学院 生物与制药工程学院,安徽 六安 237012;3.安徽省中药资源保护与持续利用工程实验室,安徽 六安 237012)
前胡首载于陶弘景的《名医别录》,作为中药使用已有1800多年历史。《别录》曰∶前胡,二月、八月采根,曝干[1](P122)。前胡具有祛除痰热、镇定咳嗽和平喘降气的作用[2-5]。伞形科植物白花前胡PeucedanumpraeruptorumDunn的干燥根为2020版《中华人民共和国国药典》收录前胡的唯一来源[6](P277)。白花前胡目前多生长于长江流域以南,在安徽、江西、四川以及浙江等地都有分布[7-10]。
前胡野生资源由于过度采挖,数量越来越少,已难以满足市场需求,因此开展了野生改家种的工作[11],现在市场上流通的前胡药材多为家种。但是大量的调研结果表明:市场上的前胡药材质量存在严重不合格的现象,国家市场监督管理总局在《2020年中药材质量不合格年度报告》中公示:“2020年度中药材不合格前10名中,位于榜首的前胡已三年连续上榜,其检测不合格项主要集中于含量测定项,如白花前胡甲素等”。究其原因很可能是由于各生产环节对前胡中药材质量问题关注不够、把关不严,如在前胡干燥过程中操作不规范的问题[12],《中国药典》规定前胡应晒干或低温干燥,邱晓霞研究发现[13],50 ℃干燥时白花前胡甲素和乙素的比例发生了明显的改变,建议前胡的干燥温度应控制在50 ℃以下;再如由于前胡药材与同科或同属如滨海前胡、碎叶山芹、紫花前胡、蕨叶藁本、异叶茴芹、石防风、短片藁本等植物的根部的形态特征比较相近,外形鉴别比较困难,因此市场上存在掺混伪品现象[14-16],进而加剧了前胡的质量不合格问题。
为了系统研究中药前胡不同生产环节中的质量变化规律,本研究选取鲜药材、产地加工、和市场这三个重要的生产环节,运用高效液相色谱法对前胡中5种香豆素类成分进行含量检测。探究了前胡在不同的生产环节中5种香豆素类成分含量及各成分相对比例的变化,为前胡药材的生产和质量控制提供了依据。
1 材料
1.1 实验材料
鲜药材5批:采自安徽省宁国市;产地加工5批:购自安徽省宁国市;市场销售5批:样品从安徽、河南、江西和湖北四个省份的药材市场购买。经韩邦兴教授鉴定为伞形科植物白花前胡的根。
1.2 实验仪器与试剂
高相液相色谱仪:日本岛津(LC-2030C 3D PLUS CN),色谱柱:ZORBAX Eclipse Plus C18( 150 mm×4.6 mm,5 μm),十万分之一电子天平,德国赛多利斯公司。前胡香豆精I(上海源叶生物科技有限公司,生产批号:B50414,质量分数:95.0%,以下统一简称为PI)、白花前胡甲素(中国食品药品检定研究院,质量分数:99.4%,以下统一简称为PA)、前胡香豆精II(上海源叶生物科技有限公司,生产批号:B5041,质量分数:97.8%,以下统一简称为PII)、白花前胡乙素(中国食品药品检定研究院,质量分数:98.9%,以下统一简称为PB)和白花前胡E素(上海源叶生物科技有限公司,生产批号:B20036,质量分数:99.9%,以下统一简称为PE)。甲醇(色谱纯,上海麦克林生化科技公司);水为纯化水,其他试剂均为分析纯。
2 实验方法
实验方法参照《中国药典》中的含量测定项中规定的方法,并略作改动,具体实验方法如下[17]。
2.1 预处理
将前胡样品干燥,粉碎,过三号筛,储存待用。
2.2 对照品溶液的制备
将对照品配制成PI浓度为30.592 μg/mL、PA为79.94 μg/mL、PII为29.824 μg/mL、PB为86.88 μg/mL和PE为58.688 μg/mL的甲醇混合溶液。
2.3 供试品溶液的制备
用电子天平称取前胡粉末约0.5 g,将其置于100 mL的锥形瓶中,加入25 mL 100%氯仿溶液,密毕瓶塞,称量,超声波(功率为250 W,频率为33 kHz)提取10分钟,放置冷却至室温,再称重,用100%氯仿补足失重,将混合液摇匀,过滤;用移液枪精密抽取续滤液10 mL置于蒸发皿中,于55 ℃下水浴蒸干,蒸去续滤液中的氯仿,将剩余残留物用无水甲醇溶解并定容至25 mL容量瓶中,即得。
2.4 数据处理
数据采用SPSS 22.0软件进行单因素方差分析,数据以¯x±s表示,并对不同生产环节进行多成分配对检验等处理,P<0.05表示差异具有统计学意义。
3 结果与分析
3.1 方法学考察
3.1.1 色谱条件
色谱柱:ZORBAX Eclipse Plus C18(150 mm×4.6 mm,5 μm);流动相∶甲醇-水(75∶25);流速为1.0 mL/min-1;柱温为30 ℃;检测波长 235 nm;进样量10 μL。5种香豆素类成分对照品和前胡样品的色谱图,见图1。
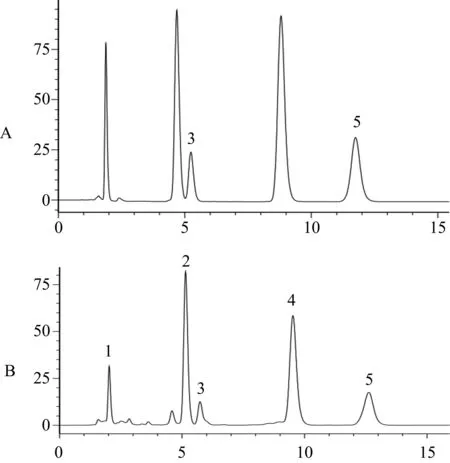
A. 对照品;B. 供试品;1.PI;2.PA;3PII;4.PB;5.PE。图1 5种对照品和前胡样品的HPLC图
3.1.2 线性关系考察
将2.2中配制的对照品溶液用甲醇溶液等比例混匀稀释8份。按照3.1.1中色谱条件进样检测,运用软件分析得到标准曲线(其中横坐标为进样浓度,纵坐标为峰面积)和回归方程,结果表明PI、PA、PII、PB和PE在相应的浓度范围内,呈良好的线性关系(R2=0.9999)。
3.1.3 精密度考察
将2.2中配制的对照品溶液按照3.1.1中的色谱条件连续进样6次,测定峰面积,分别得到PI、PA、PII、PB和PE峰面积的RSD值分别为0.3%、0.26%、0.27%、0.26%和0.25%,结果表明仪器的精密度良好。
3.1.4 重复性考察
取6份同一批次的前胡粉末约0.5 g,按上述“2.3”项制备供试品溶液,并按照3.1.1中的色谱条件测定并计算每份样品的含量,计算含量的RSD。PI、PA、PII、PB和PE含量的RSD分别为3.62%、0.92%、2.68%、2.49%和1.43%,表明重复性良好。
3.1.5 稳定性考察
取同一份前胡供试品溶液,分别于室温下0 h,2 h,4 h,8 h,16 h,24 h按照3.1.1中的色谱条件进行测量,记录峰面积,计算5种香豆素成分PI、PA、PII、PB和PE峰面积的RSD分别为0.97%、0.18%、0.18%、0.06%和0.26%,结果表明供试品提取液在室温条件下24 h内稳定。
3.1.6 加样回收率考察
取已知含量的前胡粉末约0.50 g(其中PI含量为0.49 mg/g、PA含量为6.04 mg/g、PII含量为0.46 mg/g、PB含量为3.43 mg/g和PE含量为2.09 mg/g),共6份,分别加入一定量以上5种香豆素成分的混合液,按照上述“2.3”项制备供试品溶液,并按照3.1.1中的色谱条件测定每份样品的峰面积,分别计算各组分的回收率为97.56%、98.19%、101.17%、98.80%和96.41%。这表明该试验方法准确度良好。
3.2 样品测定结果
鲜药材、产地加工和市场销售的5种香豆素类成分含量检测结果见表1。《中国药典》规定中药前胡中的PA含量不得低于0.90%,PB含量不得低于0.24%。根据表2中的结果得出,三个生产环节的15组样品中仅鲜药材环节中的样品1和2符合药典要求。鲜药材环节的前胡样品PA和PB合格率分别为40%、60%;产地加工环节的前胡样品两种成分合格率分别为60%、40%;市场销售环节的两种成分合格率分别为0%、40%,结果表明市场上前胡药材检测不合格项主要集中于含量测定项的PA,该结论与《2020年中药材质量不合格年度报告》中公示的结果一致。

表1 样品含量测定结果
利用SPSS软件对其进行配对样本t检验,结果见表2。从鲜药材到产地加工环节,前胡药材中的PI的平均含量由0.046±0.003%下降至0.019±0.009%(p<0.01);市场上的前胡药材中PA含量由0.538±0.147%到0.804±0.178%,显著低于鲜药材环节(p<0.05),由0.538±0.147%到0.948±0.142%,极显著低于产地加工环节(p<0.01)。将每个前胡样品中的5种香豆素类成分含量之和定义为总含量,则通过表3可以得出,从鲜药材环节(总含量为1.544±0.381%)到产地加工环节(总含量为1.501±0.128%),再到市场销售环节(总含量为1.019±0.201%),前胡中的5种香豆素类成分总含量呈降低趋势,且产地加工和市场这两环节的5种香豆素类成分总含量呈差异显著(p<0.05)。

表2 不同生产环节的前胡中香豆素类成分平均含量(x±s)
各前胡样品分别以不同生产环节含量相近的PII的平均含量为 1,则上述5种成分之间的含量比例关系如图2所示。可以得出,在不同的生产环节中,各成分之间的相对比例关系发生了较为明显的变化。市场销售环节的前胡中的PA相对比例(9.3∶1)低于田间栽培(16.1∶1)和产地加工环节(16.9∶1);从田间种植到产地加工,再到市场,PB和PE的相对比例在逐渐降低。

图2 不同生产环节的前胡中香豆素类成分相对比例图
4 讨论与结论
4.1 不同生产环节中前胡药材质量的影响因素讨论
新鲜药材的产地加工是中药饮片生产的重要环节。本研究表明,前胡药材在产地加工过程中产生了香豆素类成分的损耗,如PI含量由0.046±0.003%降至0.019±0.009%。因此,探究更加规范化和精细化的产地加工技术可以提高中药饮片的质量。
本研究结果与《2020年中药材质量不合格年度报告》中公示的结果一致表明:市场上前胡药材的白花前胡甲素含量较低。前胡药材从产地加工环节至市场销售环节要经历运输、储存等过程,目前有研究表明,光照会对前胡中香豆素类成分的含量产生影响,因为其在强光条件下不稳定[18],因此前胡药材储存环境应选在避光、阴凉的地方。另外前胡药材的储存时间和包装材料等因素都会对药材质量产生影响[19]。
因此本课题组拟进一步更为系统地探究中药前胡在不同生产环节中质量变化的影响因素,如在鲜药材环节考察种植模式对前胡质量的影响;在产地加工环节探究不同干燥工艺对前胡质量的影响[20];在市场环节检测前胡的常见混伪品,并运用近红外光谱技术建立一个鉴定前胡真伪优劣的方法[21-23],实现对前胡药材的快速无损的鉴别。
4.2 创新点与结论
本研究从前胡药材的生产环节入手,研究角度较为新颖,实验中以高效液相色谱法分析了中药前胡在不同生产环节中的5种香豆素类成分的变化。研究结果表明:所有前胡样品均含PI、PA、PII、PB和PE这5种成分,但前胡在不同生产环节中这5种成分的含量和相对比例产生了变化。本研究可为前胡药材的质量控制提供依据并对其他药材的研究具有指导意义。
