紫草素通过p38 MAPK 信号通路改善咪喹莫特诱导的小鼠银屑病样皮肤炎症反应①
2022-05-18郭译濛周明明郭晋荣慕珍珍徐媛媛中国医科大学附属第一医院沈阳110001
郭译濛 周明明 郭晋荣 慕珍珍 徐媛媛 耿 龙 (中国医科大学附属第一医院,沈阳 110001)
银屑病是一种免疫介导的以红斑、鳞屑为主要临床表现的慢性复发性炎症性皮肤病,其主要病理表现为角质形成细胞异常增殖和炎症细胞浸润,全球患病率为2%~5%,严重影响患者生活质量和心理状态[1-2]。研究表明丝裂原活化蛋白激酶(MAPK)信号通路参与角质形成细胞增殖、分化及凋亡,其中p38 MAPK 信号通路与炎症关系最为密切,在银屑病发生发展中起关键作用,且活化的MAPK 信号通路可促进炎症因子IL-6、IL-1β、TNF-α 等释放,提高银屑病患者皮损严重程度[3-5]。
紫草素是从中国传统中药“紫草”根茎中提取的一种萘醌类化合物,具有抗炎、抗氧化、抗肿瘤及促进伤口愈合等作用[6-7]。越来越多证据表明,中药对银屑病均有较为显著的治疗效果[8]。研究发现紫草素可通过作用于MAPK 信号通路调节炎症反应,减轻D-半乳糖诱导的神经炎症[9]。课题组前期研究表明,紫草素可通过抑制角质形成细胞增殖和诱导其凋亡治疗银屑病[10]。基于以上研究背景,本研究建立咪喹莫特诱导的银屑病样小鼠模型,旨在从p38 MAPK 信号通路角度探索紫草素对银屑病的治疗作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级6~8 周龄雄性BALB/c小鼠,体质量16~20 g,均购自辽宁长生生物科技有限公司,许可证号:SCXK(辽)2020-0001。
1.1.2 主要试剂 紫草素购自南京广润生物制品有限公司;5%咪喹莫特乳膏(Imiquimod,IMQ)购自四川明欣药业有限责任公司;Anti-p38 抗体购自美国 Abcam 公司;p-p38 抗体购自美国 CST 公司;BCA试剂盒购自碧云天生物技术有限公司。
1.1.3 仪器 低温超速离心机、Fast Real-time PCR仪购自美国Thermo 公司;酶标仪购自美国Bio-Tek公司;自动切片机购自德国Leica 公司;光学显微镜购自日本Olympus公司。
1.2 方法
1.2.1 动物造模、分组与处理 6~8周龄BALB/c雄性小鼠剔除背部正中毛发,面积约2 cm×3 cm,备皮后随机分为5组:空白对照组(CON)、咪喹莫特模型组(IMQ)、紫草素低[5 mg/(kg·d)]、中[7.5 mg/(kg·d)]和高剂量组[10 mg/(kg·d)]。处理组小鼠给予5%IMQ乳膏(62.5 mg/只),1 次/d,连续7 d 建立银屑病样小鼠模型,对照组给予等剂量凡士林。将紫草素溶于食用油后灌胃给予相应处理组小鼠,同时对照组和模型组给予食用油[1 mg(/kg·d),含5%DMSO 的食用油]。小鼠每日给药前拍照、称重,观察并记录小鼠背部皮损动态变化。
1.2.2 小鼠银屑病皮损面积和严重程度指数(PASI)评分 按照PASI 评分从鳞屑、红斑、增厚程度三个方面对小鼠背部皮损严重程度进行评分(0 分:无皮损;1 分:轻度皮损;2 分:中度皮损;3 分:重度皮损;4 分:极重度皮损),三者分数相加即为累积分数,记录并绘制评分趋势图。
1.2.3 小鼠皮损HE染色 第8天以颈脱位法处死小鼠,留取相应皮损组织固定于10%中性甲醇中,脱水、石蜡包埋,制备5µm 切片并进行HE 染色,光学显微镜下观察皮损组织病理学改变。
1.2.4 Western blot 检测皮损中p-p38 蛋白表达研磨组织后加入适量含蛋白磷酸酶抑制剂的RIPA 裂解液冰上裂解20 min,4 ℃、15 000 r/min 离心15 min,收集上清,分装,BCA 蛋白定量试剂盒进行蛋白定量。10%SDS-PAGE电泳(浓缩胶电压80 V,分离胶电压120 V),200 mA 恒流转膜40 min,加入快速封闭液室温封闭15 min,分别加入适量抗p38 MAPK(1∶1 000)、p-p38 MAPK(1∶1 000)、GAPDH(1∶1 000)一抗稀释液4 ℃轻摇过夜,洗膜后二抗室温孵育2 h,洗膜,加入ECL 化学发光液曝光显影,Image J图像分析软件分析条带灰度值。
1.2.5 免疫组化法检测皮损组织中p-p38 蛋白表达 制备石蜡切片,常规脱蜡、脱水、抗原修复,加入 3%H2O2室温孵育 15 min,PBS 清洗,室温封闭30 min,加入50µl 1∶100稀释的p-p38一抗4 ℃避光孵育过夜,复温45 min 后PBS 清洗,二抗室温孵育45 min,DAB 显色,苏木素复染15 s。光学显微镜下随机选取3个中心视野拍照,Image-Pro6.0软件进行评估。
1.2.6 qRT-PCR 检测皮损中 IL-6、IL-1β 和 TNF-α表达 采用TRIzol 法提取皮损组织总RNA,紫外分光光度计检测mRNA 浓度,逆转录为cDNA,以此为模板采用SYBR Green 法进行PCR 扩增反应。引物序列GAPDH F:5'-GGGCTCTCTGCTCCTCCCTGT-3',R:5'-CGGCCAAATCCGTTCACACCG-3';IL-6 F:5'-CTGCAAGAGACTTCCATCCAG-3',R:5'-AGTGGTATAGACAGGTCTGTTGG-3';IL-1β F:5'-GAAATGCCACCTTTTGACAGTG-3',R:5'-TGGATGCTCTCATCAGGACAG-3';TNF-α F:5'-CAGGCGGTGCCTAT-GTCTC-3',R:5'-CGATCACCCCGAAGTTCAGTAG-3',退火温度为60 ℃,重复3次,2-ΔΔCt计算。
1.3 统计学处理 采用GraphPad Prism7.0 软件进行统计学分析。计量数据以表示,多组间比较采用单因素方差分析(One Way ANOVA),P<0.05表示差异有统计学意义。
2 结果
2.1 紫草素可改善IMQ 诱导的小鼠银屑病样皮损 与对照组相比,模型组小鼠背部皮肤第8 天明显增厚,并出现典型红斑、鳞屑。紫草素连续治疗7 d后,紫草素治疗组小鼠银屑病样皮损较模型组显著改善,紫草素高剂量组改善最为显著(图1)。对照组小鼠体质量无明显变化,模型组和紫草素治疗组小鼠体质量较对照组明显减轻(P<0.01),且紫草素治疗组小鼠体质量变化幅度低于模型组(P<0.05,图2A)。PASI 评分趋势图可见模型组小鼠于第2 天出现明显皮损,而后逐渐加重并于第6~7 天达到高峰。第7天时紫草素各治疗组红斑、鳞屑、浸润程度及总评分与模型组相比显著降低(P<0.01),但紫草素中、高剂量组差异无统计学意义(P>0.05,图2B~E)。
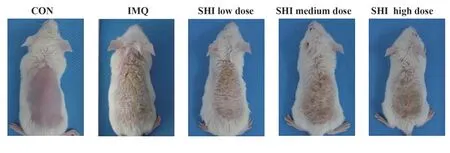
图1 各组小鼠第8天背部皮损表现Fig.1 Back skin lesions of mice in each group at 8 d

图2 各组小鼠体质量及皮损PASI评分Fig.2 Body weight and PASI scores of mice skin lesions in each group
2.2 HE 染色观察各组小鼠组织病理学变化 HE染色显示对照组小鼠表皮薄,皮下炎症细胞浸润少,而模型组小鼠呈现明显银屑病样改变,包括表皮增厚、炎症细胞浸润、角化不全伴角化过度,且可见大量Munro 微脓肿,测量结果显示模型组小鼠背部皮损的垂直表皮厚度约为对照组6.7 倍(P<0.001)。与模型组相比,紫草素治疗组小鼠表皮增厚程度明显减少,炎症细胞浸润及Munro 微脓肿减轻(P<0.01),但紫草素中、高剂量组小鼠表皮厚度及炎症细胞浸润程度无显著差异(图3)。表明紫草素可有效抑制IMQ诱导的小鼠银屑病样皮炎。

图3 各组小鼠背部皮肤的组织病理表现(HE,×200)Fig.3 Histomorphology manifestations of back skin of mice in each group(HE,×200)
2.3 紫草素抑制IMQ 诱导的小鼠银屑病样皮损中p-p38 蛋白表达 Western blot 结果表明,模型组p38 MAPK 蛋白磷酸化水平较空白对照组显著升高(P<0.001)。IMQ诱导的小鼠经紫草素治疗后,p-p38蛋白表达随给药浓度升高逐渐降低,紫草素低、中、高剂量组p-p38 蛋白表达分别降低89.9%、76.7%和50.3%(P<0.01,P<0.001,图 4)。免疫组化结果显示,与空白对照组相比,IMQ 诱导的小鼠皮损p-p38 在表皮广泛表达,呈现明显亲核倾向,呈深棕色(P<0.001)。与模型组相比,紫草素治疗组小鼠皮损组织中p-p38 表达明显下降,颜色变浅(P<0.01,P<0.001,图5)。

图4 Western blot 检测紫草素对p-p38表达的影响Fig.4 Effect of shikonin on expression of p-p38 detected by Western blot
2.4 紫草素降低小鼠背部皮损中IL-6、IL-1β 和TNF-α mRNA 表达 qRT-PCR 检测小鼠背部皮损中IL-6、IL-1β 和TNF-α mRNA 表达,结果显示,模型组促炎细胞因子 IL-6、IL-1β 和 TNF-α mRNA 水平较对照组显著升高,分别提高5.5、9.4 和9.4 倍。紫草素处理后,IL-6、IL-1β 和 TNF-α mRNA 表达显著降低(P<0.01,P<0.001,图6)。表明紫草素可能通过抑制p38 MAPK 信号通路调节下游蛋白及炎症因子表达,从而改善小鼠银屑病样皮肤炎症。

图6 紫草素对IL-6、IL-1β和TNF-α mRNA表达的影响Fig.6 Effects of shikonin on IL-6,IL-1β and TNF-α mRNA expressions
3 讨论
本研究旨在探讨紫草素对咪喹莫特诱导的小鼠银屑病样皮肤炎症的影响及潜在作用机制。局部采用咪喹莫特可使小鼠皮肤发生银屑病样改变,目前已被广泛用于银屑病发病机制研究[11-12]。本实验选用5%咪喹莫特乳膏诱导银屑病小鼠模型,结果表明紫草素可有效缓解小鼠皮损红斑、鳞屑及增厚程度,降低PASI评分,且呈剂量依赖性。HE 染色结果表明紫草素可抑制角质形成细胞角化、减少炎症细胞浸润。提示紫草素对小鼠银屑病样皮肤炎症有显著抑制作用。
丝裂原活化蛋白激酶(MAPK)可调节炎症级联反应,在银屑病发生发展中具有重要作用。MAPK家族包括细胞外调节蛋白激酶(ERK)、c-JunN 末端激酶(JNK)和p38[13]。研究发现 MAPK 被激活后易位至细胞核,使多种转录因子和靶蛋白磷酸化,从而调节靶基因转录发挥生物学效应,且p-p38 表达在银屑病皮损中显著升高[14-16]。本研究显示,模型组p-p38 表达显著升高,给予紫草素可有效抑制小鼠皮损中p-p38表达。同时,SOEGAARD-MADSEN等[17]证明阿达木单抗主要通过抑制p38 活性下调p38 调节的炎症因子表达治疗银屑病,与本研究结果一致,表明紫草素可能通过抑制p38 MAPK 信号通路发挥抗炎作用。
为研究紫草素对银屑病小鼠模型中促炎细胞因子的影响,采用qRT-PCR 检测皮肤组织中IL-6、IL-1β 和 TNF-α 表达。大量研究证明 IL-6、IL-1β 和TNF-α 在银屑病病变组织和血清中高表达,且与疾病严重程度密切相关[18-19]。p38 MAPK 被激活后可促进炎症反应,募集IL-6 等炎症因子在皮损处聚集形成正反馈,进一步加速疾病发展[20]。INOUE 等[21]研究发现紫草素可抑制系统性红斑狼疮患者血液中IL-6、TNF-α 等炎症因子分泌。本研究通过对咪喹莫特诱导的银屑病小鼠研究证明,紫草素同样可抑制促炎细胞因子 IL-6、IL-1β 和 TNF-α mRNA上调。
本研究表明紫草素可改善咪喹莫特诱导的小鼠银屑病样皮肤炎症,抑制p38 MAPK 磷酸化并下调 IL-6、IL-1β 和 TNF-α 表达。综上所述,紫草素可能通过干预p38 MAPK 信号通路发挥保护作用,在治疗银屑病方面具有很大潜力,但仍需在临床样本上进行进一步研究,以便更完整地探索紫草素的作用,为紫草素治疗银屑病奠定理论基础。
