内蒙古9种马铃薯主栽品种对黑胫病抗性评价
2022-05-18张竞丹孙平平吕文霞李正男
张竞丹,孙平平,张 佳,张 磊,吕文霞,马 强,李正男*
(1.内蒙古农业大学园艺与植物保护学院,内蒙古 呼和浩特 010018;2.内蒙古中加农业生物科技有限公司,内蒙古 乌兰察布 011800)
马铃薯(Solanum tuberosumL.)是世界主要的粮食作物,2020 年中国马铃薯种植面积约465.61万hm2,产量约1 798.3 万t,栽培面积约占全球的27%,总产量约占世界总产量的25%[1];内蒙古自治区是中国马铃薯重点产区,2020 年种植面积为27.74 万hm2,产量高达124.2 万t。由于马铃薯种植面积的逐年增加,倒茬等农耕措施目前已经很难实现,所以土传性病害的发生逐年加重,特别是马铃薯黑胫病呈现逐年增长的趋势。
马铃薯黑胫病是对马铃薯种植有严重危害的病害,该病害对中国各地区的马铃薯种植都有极大影响,危害较轻的地区地块发病率在2%~5%,在危害较严重的区域,地块发病率最高达到了50%,给中国马铃薯种植业造成了巨大的损失[2]。目前所知的马铃薯黑胫病的主要病原菌有黑腐果胶杆菌(Pectobacterium atroseptica)、胡萝卜软腐果胶杆菌巴西亚种[3(]P. carotovorumsubsp.brasiliensis)、胡萝卜软腐果胶杆菌胡萝卜亚种[4(]P. carotovorumsubsp.carotovorum)以及菊果胶杆菌[5(]P.chrysanthemi)。对内蒙古自治区马铃薯黑胫病病原菌的研究较少。李克莱[6]与王旭等[7]在内蒙古自治区呼和浩特市区和多伦地区发现了由P. atroseptica引起的马铃薯黑胫病;田艳丽等[8]在内蒙古自治区锡林郭勒盟发现由P. carotovorumsubsp.brasiliensis单一侵染引起的马铃薯黑胫病。带菌种薯是马铃薯黑胫病传播的主要途径,病原菌可以通过伤口直接侵染[9],还可以通过灌溉水、昆虫、土壤等其他田间物质传播[10,11]。感病植株的带病种薯最先发病,由匍匐茎传至茎基部使其变黑,严重时呈水渍状腐烂,逐渐扩展到茎上部;使得养分和水分无法传导至叶片,引起叶片出现卷曲皱缩、褪绿黄化等现象;最终茎秆腐烂,植株全部枯死[12-14]。
马铃薯黑胫病防控治疗的最佳方法是培育马铃薯高抗品种。中国目前很少有针对于马铃薯黑胫病的抗性品种筛选方面的研究,宋扬等[15]参照Lapwood等[16]的方法并改进后成功测试了美国缅因州的24份马铃薯品种对黑胫病菌Dickeya dianthicolaME30和P.wasabiaeWPP163的抗性,认为‘Ranger Russet’和‘Sangre’2 个品种对2 种病原菌均具有良好的抗性能力。王立春等[17]采用将腐烂区域进行分级抗性评定的方法对来自不同国家及地区的40个马铃薯品种进行评价和筛选,结果表明欧美地区马铃薯品种呈高抗,国内品种抗性水平主要集中在中感及中抗上。但是,对内蒙古自治区马铃薯品种的抗性筛选尚未见报道。因此,本试验对在内蒙古自治区各地区采集的马铃薯品种的抗性进行评价,期望筛选出对马铃薯黑胫病具有抗性的品种,为马铃薯高质量生产做出贡献。
1 材料与方法
1.1 供试病原菌
马铃薯黑胫病病原菌P. atrosepticumTDHJ7,由内蒙古农业大学园艺作物病害病原生物学及综合防控实验室分离自内蒙古自治区武川县表现显著黑胫病症状的‘费乌瑞它’马铃薯茎基部,纯化菌株置于20%甘油中,-80℃冰箱保存备用。
1.2 供试马铃薯品种
马铃薯品种为‘V7’‘英尼维特’‘费乌瑞它’‘大西洋’‘冀张薯 12 号’‘夏坡蒂’‘布尔斑克’‘中加7 号’和‘中加2 号’,由内蒙古中加农业生物科技有限公司提供。
1.3 供试试剂
LBA 固体培养基:10 g 胰蛋白胨,10 g NaCl,5 g酵母提取物,20 g琼脂粉,1 000 mL去离子水。
LB液体培养基:不含琼脂粉,其余与LBA相同。
1.4 马铃薯块茎抗性评价
1.4.1 菌悬液的制备
取 100 μL 在-80℃环境下保存的 TDHJ7 涂在LBA 固体培养基上,28℃复壮48 h。挑取单菌落接种于100 mL 高温灭菌过的LB 液体培养基中,28℃、180 r/min 培养48 h,将菌悬液浓度调至106cfu/mL。
1.4.2 块茎接种
选取无病无伤的9 个供试马铃薯品种,于1%次氯酸钠溶液中浸泡5 min,达到消毒的目的,无菌水清洗3次后晾干备用。将马铃薯切成宽2 cm的厚片,并依次在马铃薯切片中央用无菌打孔器打一个直径 4 mm × 深 2 mm 的圆孔,加入 10 μL 菌悬液,每个品种重复3次,以接种等量无菌水的薯块作为对照组。将浸满去离子水的灭菌滤纸铺入灭菌培养皿中,盖上皿盖确保湿度。置于恒温25℃的黑暗培养箱培养36 h后,调查其发病情况。
1.4.3 发病情况调查
参照Lapwood 等[16]的方法测量腐烂区域的病斑直径,沿接种点纵切,测量薯块纵切面接种点以下腐烂区域的深度和宽度(mm),以其乘积的值的平均数代表腐烂区域的切面面积,切片面积/100 得到腐烂程度(cm2)。对品种间进行抗性分级,分级标准为:腐烂区域切面面积数值为0~1 时马铃薯品种抗病类型为高抗(HR);1~2 时为抗病(R);2~3 时为中抗(MR);3~4 时为中感(MS);≥4时为高感(HS)。
1.5 温室盆栽条件下马铃薯品种的抗性测定
1.5.1 马铃薯种植与接种
盆栽测定试验于2021 年7 月在内蒙古农业大学园艺作物病害病原生物学及综合防控实验室进行。每个品种选择形态完好,无明显伤病的马铃薯,从芽眼附近把马铃薯切开,每个马铃薯切为3块,切开的薯块伤口愈合48 h 后种植在容积4 L、装有无菌的细沙与腐殖土等量混匀的盆中,16 h光照/8 h 黑暗条件下培养,湿度在70%左右,温度控制在25℃。待马铃薯植株长出高约7~8 cm(种植后10 d),将10 μL 106cfu/mL 的菌悬液注射到马铃薯植株的茎基部。每个品种设定6 盆重复,以注射等量无菌水的马铃薯植株作为对照组,并采用随机区组方式排列盆栽。
1.5.2 病害调查及评价
接种病原菌后观察2、4、6、8、10、12、14和21 d 的发病情况,测量发病马铃薯茎基部的病斑直径,并记录发病植株数,发病株数与总株数的比值得到发病率;随着病斑直径的扩展,有植株枯死的现象,计算枯死率,枯死后的植株病斑直径按照10 cm计算。
另外参照宋扬等[15]的方法,以接种点为中心测定上下各5 cm 范围内的发病面积占调查面积的比率,并对马铃薯进行抗性评价。调查范围内无病害发生时,其抗病等级为0;0<发病面积≤25%时抗病等级为1;25%<发病面积≤50%时抗病等级为2;50%<发病面积≤75%时抗病等级为3;75%<发病面积≤100%时抗病等级为4。
计算21 d 的抗病等级平均值,以抗病等级平均值评价抗病性:当0≤抗病等级平均值<1时抗病类型为高抗(HR);当1≤抗病等级平均值<2 时为抗病(R);当2≤抗病等级平均值<3 时为中抗(MR);当3≤抗病等级平均值<4 时为中感(MS);当抗病等级平均值=4时为高感(HS)。
2 结果与分析
2.1 离体条件下马铃薯块茎对P. atrosepticum TDHJ7的抗性评价
对9 个品种的马铃薯块茎接种病原菌P. atrosepticumTDHJ7 后36 h 的发病情况进行调查评价(图1)。‘V7’与‘英尼维特’2个品种的病斑宽度分别为10.06 和19.71 mm,深度分别为10.77和9.37 mm,腐烂程度分别为1.08 和1.85 cm2,评定为抗性品种;表现为中抗(MR)的品种有‘大西洋’‘夏坡蒂’和‘中加7 号’,抗性品种占所测试马铃薯品种的55.56%。表现为中感(MS)的马铃薯品种有‘冀张薯12 号’与‘布尔斑克’,‘费乌瑞它’和‘中加2 号’2 个品种接种后薯块的病斑宽度为38.61 和37.45 mm,病斑深度为13.23 和13.15 mm,腐烂程度均大于4 cm2,为高感品种(HS)(表1)。
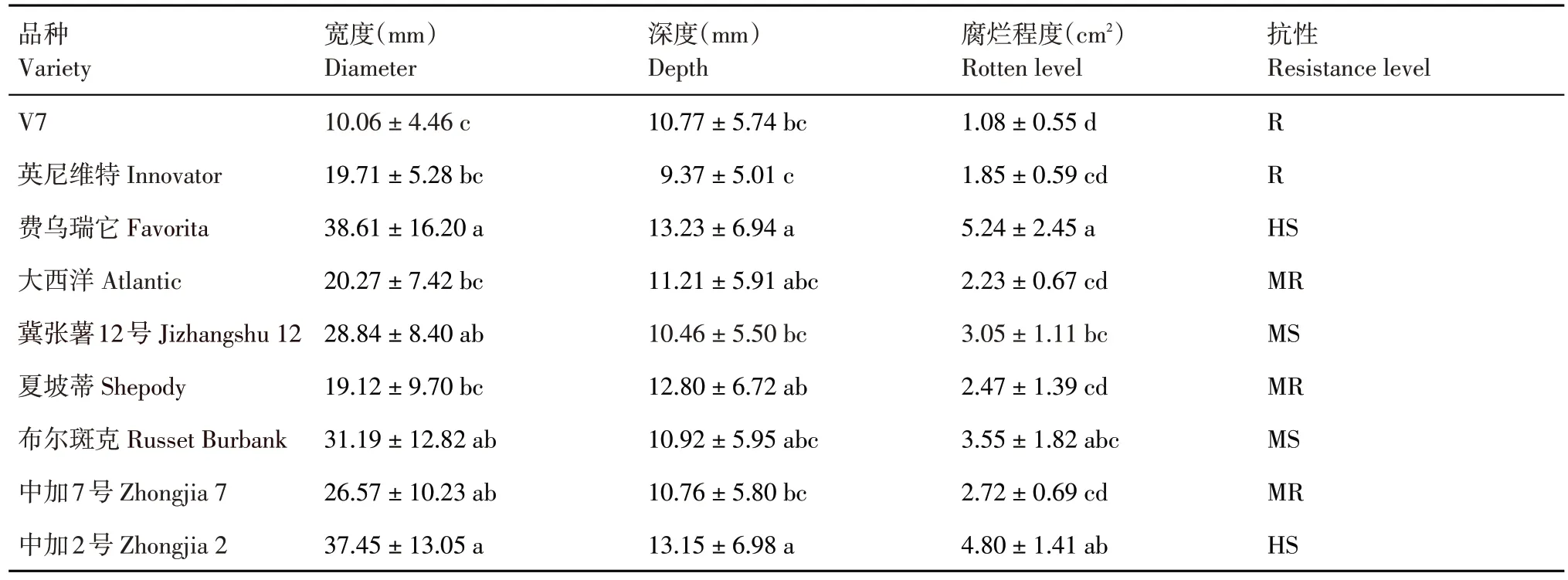
表1 离体块茎接种法测定9个马铃薯品种对P.atrosepticum TDHJ7的抗性评价Table 1 Resistance evaluation of nine potato varieties to P.atrosepticum TDHJ7 using tuber inoculation
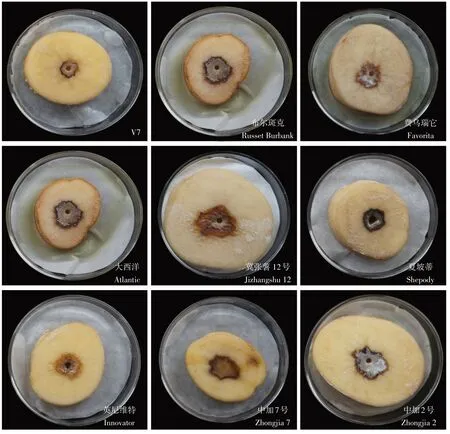
图1 离体块茎法测定9个马铃薯品种接种P.atrosepticum TDHJ7后的病斑Figure 1 Disease symptoms of nine potato varieties inoculated with P.atrosepticum TDHJ7 using in vitro tuber inoculation method
2.2 温室盆栽条件下9个马铃薯品种对P.atrosepticum TDHJ7的抗性评价
温室盆栽条件测定9 个马铃薯品种接种病原菌P. atrosepticumTDHJ7 后21 d 内的发病情况(图2~4)。随着接种天数的增加,9 个马铃薯品种的病斑直径与枯死率逐渐升高,并表现出相似的趋势。在注射接种6 d 时‘费乌瑞它’的病斑直径和枯死率显著增加,病斑直径达65.8 mm,枯死率为45.5%,明显高于其他品种,并在测定期间均明显高于其他品种,在21 d 时的病斑直径达到87.82 mm,枯死率为81.82%。‘中加2 号’马铃薯在接种后6 d内的病斑直径和枯死率明显增加,随后病斑直径与枯死率增长缓慢,在21 d 时病斑直径与枯死率均低于‘夏坡蒂’‘中加7 号’与‘布尔斑克’。‘大西洋’在12 d 内的枯死率一直为0,接种后14 d开始有枯死,21 d的枯死率为5%。

图2 盆栽注射法测定9个马铃薯品种对P.atrosepticum TDHJ7的发病情况Figure 2 Disease symptoms of nine potted potato varieties inoculated with P.atrosepticum TDHJ7 using injection inoculation method
根据盆栽注射接种21 d 后的发病情况对9 个马铃薯品种的抗病性进行评价(表2)。在测试的9个品种中,‘英尼维特’‘冀张薯12号’与‘V7’的抗病等级均小于2,为抗性品种;‘费乌瑞它’的抗病等级为3.64,为中感品种,其他5 个品种均为中抗品种。
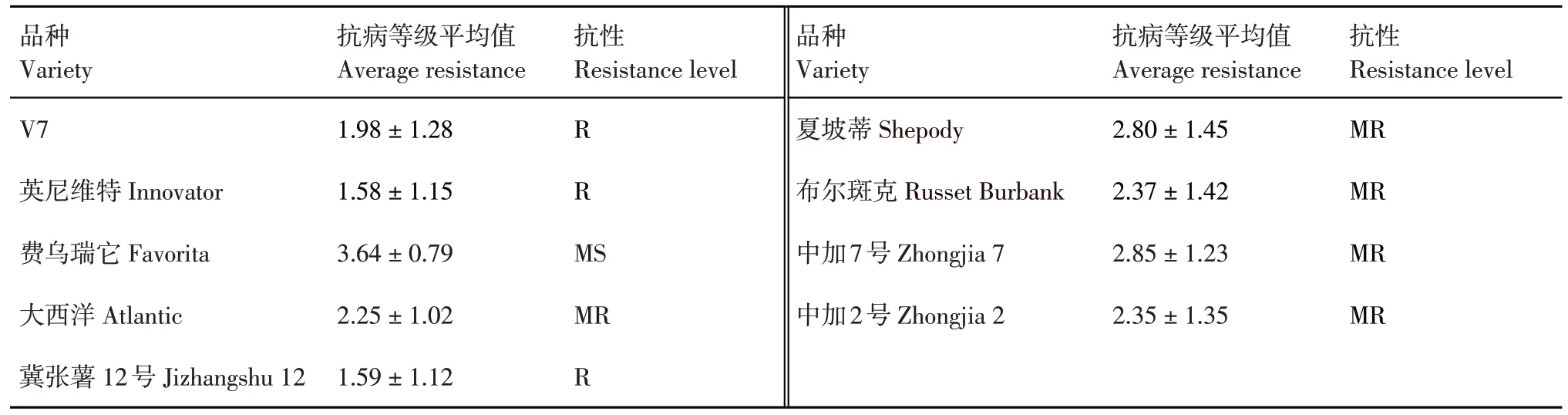
表2 温室盆栽注射法测定9个马铃薯品种对P.atrosepticum TDHJ7的抗性评价Table 2 Resistance evaluation of nine potted potato varieties to P.atrosepticum TDHJ7 by injection inoculation method in greenhouse
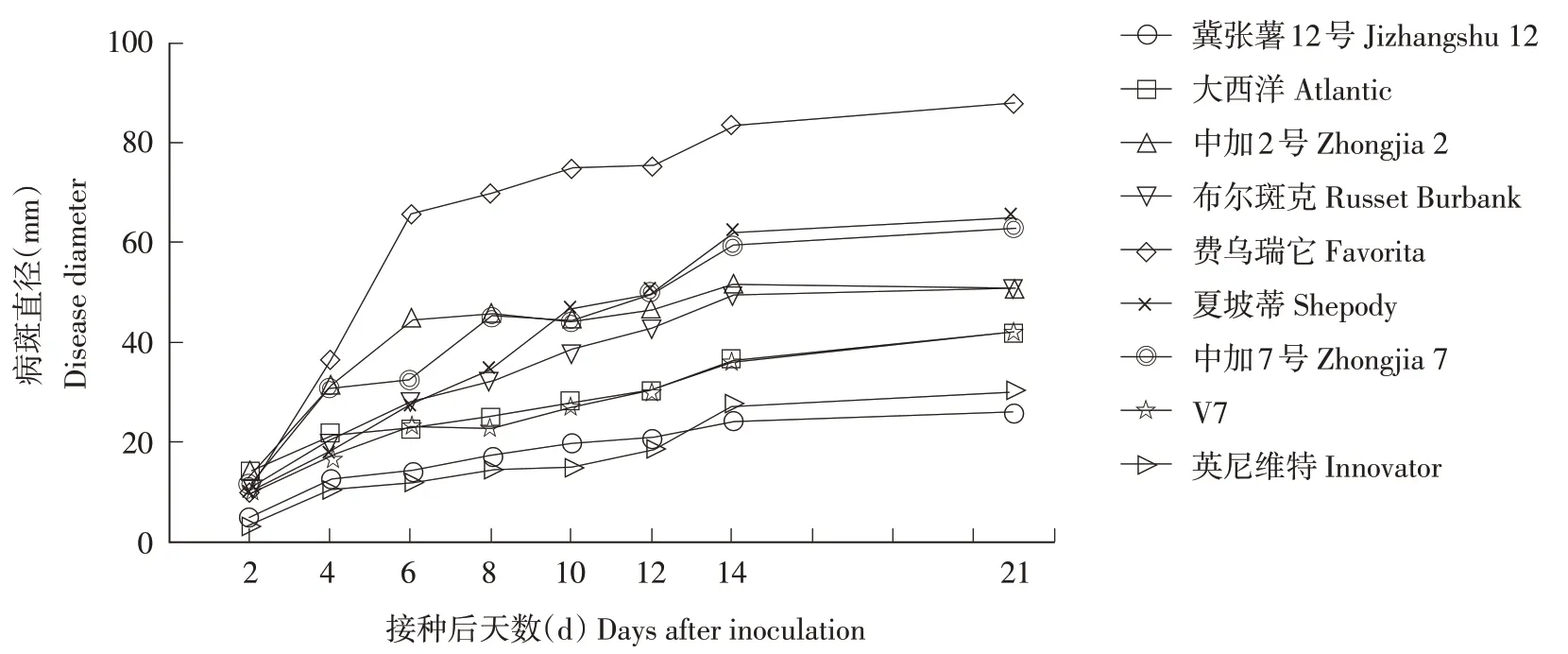
图3 温室盆栽条件下9个马铃薯品种病斑直径变化Figure 3 Disease diameter of nine potted potato varieties in greenhouse
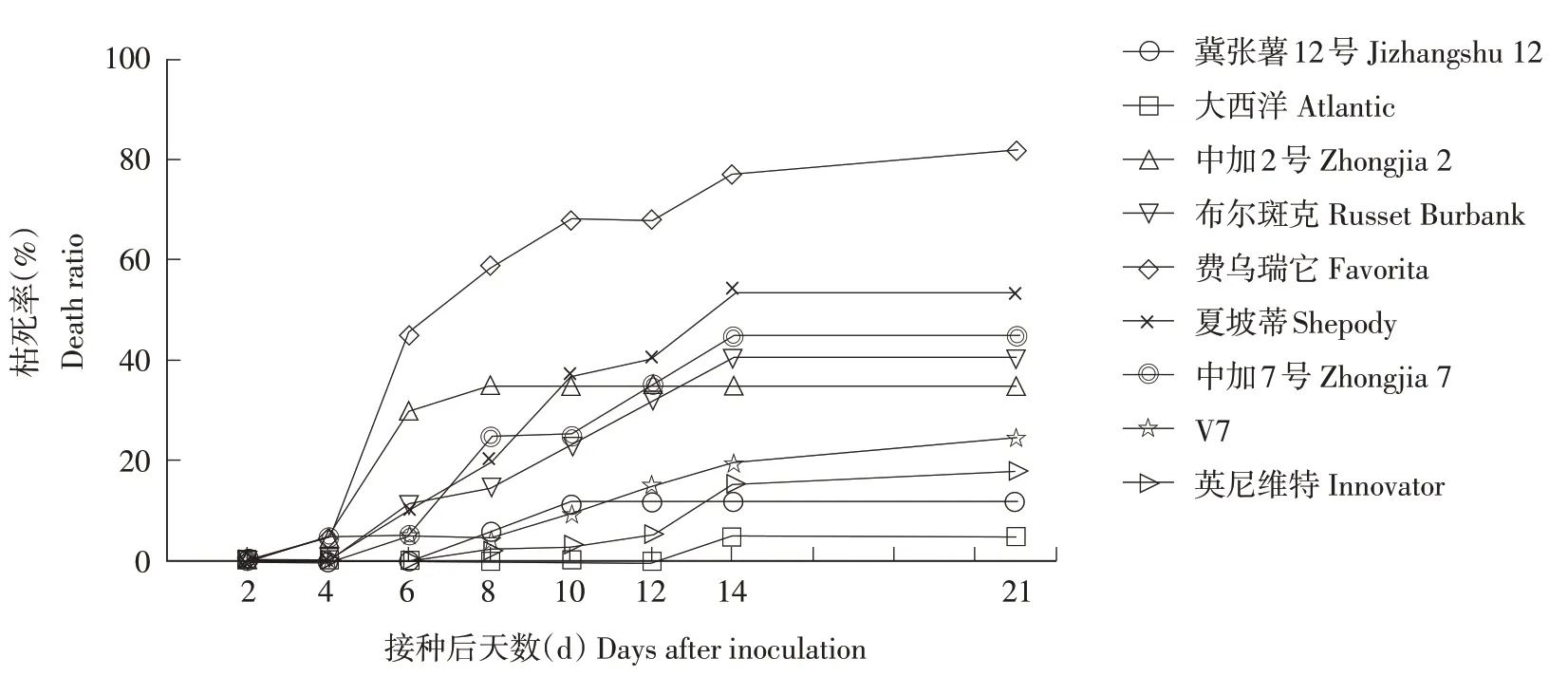
图4 温室盆栽条件下9个马铃薯品种枯死率变化Figure 4 Death ratio of nine potted potato varieties in greenhouse
3 讨 论
种植抗病品种可以极大的解决农药等高残留化学物质的使用,是病害防控中最有效的植保措施之一。通过抗病资源的筛查,可为抗病育种提供基础的抗性数据,为抗性新品种的培育提供优良种质。病害在发生过程中受到病原、环境、寄主之间的相互影响,因此,对于一个病害的防控应是因地制宜的依据种植地的情况开展。中国对马铃薯黑胫病抗性品种的筛选研究较少,仅见宋扬等[15]比较了美国缅因州的24 份马铃薯品种的抗黑胫病能力,王立春等[17]对不同国家和地区的40个品种进行筛选,而内蒙古自治区作为中国马铃薯的重要产区之一,黑胫病发生逐年加重,但是内蒙古自治区主要马铃薯栽培品种对抗黑胫病能力未见报道。本研究评价的9 个马铃薯品种是目前内蒙古自治区种植较为广泛的品种,所用病原菌分离自内蒙古自治区马铃薯的主栽区,因此本研究开展的抗性评价,对内蒙古自治区马铃薯生产以及黑胫病防控具有指导意义。
马铃薯黑胫病菌在马铃薯生长的不同时期侵染会引起不同的症状和不同程度的危害[13],如苗期侵染,可以造成植株死亡,甚至导致绝收;生长中期侵染主要造成减产;生长后期侵染就会危害块茎,导致商品性下降。因此为了全面评价9个马铃薯品种对黑胫病的抗性,采用了离体马铃薯块茎接种、活体马铃薯盆栽植株接种两种方式对其抗性进行了评价,这样更能全面地评价9 个马铃薯品种对黑胫病的抗性[15],以确保无论在生产阶段的任何时期侵染均可以将产量损失降低到最低。
本试验通过对在内蒙古自治区广泛种植的9个马铃薯品种的黑胫病抗性进行了评价,筛选出了在离体条件下对马铃薯黑胫病具有良好抗性的品种有‘英尼维特’‘V7’;在温室盆栽条件下对马铃薯黑胫病具有良好抗性的品种有‘英尼维特’‘冀张薯 12 号’‘V7’。综合评价,‘V7’‘英尼维特’这2 个品种是极有发展潜力的抗性品种。随着内蒙古自治区马铃薯种植面积的增加,通过倒茬等农艺措施实现土传病害的防控已经难以实现,合理的水分管控、抗性品种种植及栽培过程中土壤益生微生物群落的恢复是下一步研究的重点,以期为马铃薯的安全生产提供指导。
