miR-221-3p靶向BCL2L11调控小尾寒羊卵泡颗粒细胞凋亡
2022-05-17刘玉芳陈玉林周祖阳储明星
刘玉芳,陈玉林,周祖阳,储明星
miR-221-3p靶向调控小尾寒羊卵泡颗粒细胞凋亡

1中国农业科学院北京畜牧兽医研究所/农业农村部动物遗传育种与繁殖重点实验室,北京 100193;2河北工程大学生命科学与食品工程学院,河北邯郸 056001
【】在哺乳动物中能够促进多种细胞凋亡,同时参与繁殖性状相关组织器官的发育及疾病治疗,文章利用分子生物学方法探究miR-221-3p靶向调控对小尾寒羊卵泡颗粒细胞凋亡的影响,为进一步研究在卵泡颗粒细胞凋亡和卵泡闭锁过程中的调控作用提供依据。在前期课题组卵巢组织全转录组测序分析的基础上,获得了候选基因及其调控元件miR-221-3p,利用半定量和组织荧光定量(RT-qPCR)分析在小尾寒羊不同组织中的表达情况;通过RT-qPCR定量试验在小尾寒羊卵泡期和黄体期卵巢组织中鉴定了及miRNA-221-3p的表达情况;构建3’UTR野生型和突变型载体,在HEK293T细胞中共转染miR-221-3p mimic和野生型和突变型及阴性对照,采用双荧光素酶报告基因检测系统确定miR-221-3p与靶向性关系;在绵羊卵巢原代颗粒细胞中转染miR-221-3p mimic及阴性对照实现miR-221-3p过表达,使用RT-qPCR技术在mRNA水平上检测miR-221-3p对以及卵巢颗粒细胞凋亡标志基因和表达水平的影响;同时利用EdU试验分析miR-221-3p过表达和阴性对照组中颗粒细胞的增殖变化。半定量和组织RT-qPCR分析均表明在卵巢组织中表达量高于其他组织;RT-qPCR定量结果显示miR-221-3p和在小尾寒羊卵泡期和黄体期卵巢组织中差异表达,miR-221-3p在卵泡期卵巢中的表达量高于黄体期,而在卵泡期卵巢中的表达量低于黄体期,表现出负调控的现象;双荧光素酶报告基因验证分析显示,过表达miR-221-3p mimic显著抑制了3’UTR荧光素酶的活性(<0.05),阴性对照组则没有显著影响;过表达miR-221-3p,靶基因mRNA表达水平显著降低,同时,卵泡颗粒细胞凋亡标志基因和的表达量也显著降低(<0.05);EdU试验分析显示,过表达miR-221-3p的颗粒细胞增殖率为18.9%,极显著高于阴性对照组的10.43%(<0.01)。和miR-221-3p是调控绵羊卵巢发育的重要基因及调控元件,是miR-221-3p的靶基因之一,miR-221-3p过表达可抑制颗粒细胞凋亡,该作用结果可能通过抑制靶基因的表达进而影响了绵羊卵巢颗粒细胞的凋亡。
miR-221-3p;小尾寒羊;卵巢颗粒细胞凋亡;
0 引言
【研究意义】产羔数一直是制约绵羊产业发展的核心问题,影响产羔数的决定因素是排卵率和卵泡发育。卵泡颗粒细胞为卵泡发育提供营养物质,颗粒细胞的增殖或凋亡是影响卵泡发育和排卵数增减的重要因素[1]。多种影响因素调控颗粒细胞凋亡,包括遗传、营养、激素等[2]。随着分子生物学技术的不断发展,揭示其增殖或凋亡的分子机制成为新的研究热点。microRNA作为近年来研究成熟的表观遗传学调控元件,在细胞发育过程中起到重要的转录后调控作用[3]。颗粒细胞直接影响卵泡发育,了解其增殖的内在分子调控机制可为提高绵羊产羔数和排卵率提供研究基础[4]。本研究将miRNA-mRNA调控作用作为探究卵巢颗粒细胞发育的重要调控通路,通过RT-qPCR试验在组织中检测了miRNA及mRNA的表达情况,确定了其作为影响小尾寒羊卵巢发育的重要候选基因及调控元件参与卵巢颗粒细胞发育,为进一步验证miRNA-mRNA的靶向性关系及在细胞水平上该调控通路的功能提供了理论基础。【前人研究进展】自从1985年,Piper等在Booroola美利奴羊中发现多羔主效基因以来,在遗传上对绵羊多羔性状的研究从没有停止过[5]。此外,和基因也被发现与绵羊多羔性状相关[6-7]。近年来,随着分子生物学技术的不断发展,越来越多的技术应用于绵羊多羔性状的研究,例如,利用GWAS、转录组学、蛋白质组学等多种高通量测序技术筛选与绵羊多羔性状相关的重要候选基因,并对筛选后的基因进行功能验证[8-10]。编码BCL2L11蛋白,属于BCL-2蛋白家族的一员,位于线粒体的外膜,该蛋白在介导兴奋性细胞凋亡、诱导基因序列易位和线粒体去极化的过程中起着重要的调控作用[11-12]。有研究发现,BCL2L11与BCL2、BCL2L1和BCL2L3相互作用,是细胞凋亡的激活剂[13],当细胞被有毒物质刺激时,BCL2L11从DYNLL1中释放出来,通过BCL2失活和BCL-2相关蛋白(BAX)-BCL2拮抗剂的激活诱导细胞凋亡[14]。参与治疗子宫内膜异位症,研究表明,LINC00261通过直接与miR-132-3p结合来充当调节表达的分子海绵,该通路可能是子宫内膜异位症的新型治疗靶标[15]。在妊娠前期癫痫患者的胎盘中发现miR-222通过上调靶基因来促进子痫前期患者对缺氧的应答,进而促进间充质干细胞的凋亡[16]。研究发现能够促进多种细胞凋亡,且该基因参与繁殖性状相关组织器官的发育及疾病治疗,但目前在绵羊卵泡颗粒细胞中的作用仍不清楚。miRNAs 是有机体内基因转录后表达调控的主要表观遗传学修饰方法之一,在绵羊多羔性状的研究中发现多个miRNAs参与调控该性状。let-7和oar-miRNA-200家族成员,不仅在绵羊中具有物种特异性,而且还具有阶段特异性或繁殖力特异性[17]。miR-221-3p 在子宫颈鳞状细胞癌临床标本的miRNA芯片中高表达,且miR-221-3p可通过抑制转移到人淋巴管内皮细胞中可促进淋巴管生产和淋巴转移,并可作为子宫颈鳞状细胞癌患者早期治疗的新型诊断生物标记物和治疗靶标[18],miR-221-3p与子宫颈癌的复发和转移有关,其受转录因子TWIST2的上调,从而抑制了的表达,该通路可能促进子宫颈癌淋巴结转移,从而影响雌性动物的繁殖[19]。综上可知,miR-221-3p可能通过抑制其靶基因的表达调控雌性繁殖相关性能。【本研究切入点】本课题组前期通过对小尾寒羊卵泡期和黄体期的卵巢组织进行全转录组测序,筛选到与绵羊多羔性状相关候选基因及其调控元件miR-221-3p。基于前期试验结果与已有报道,可以调控细胞凋亡,并且与雌性动物繁殖有关,miR-221-3p也可作为重要的调控元件调控与生殖有关的疾病变化,推测miR-221-3p可通过抑制的表达影响卵泡颗粒细胞的增殖或凋亡,这有助于进一步阐述卵泡颗粒细胞发育的分子生物学机制。【拟解决的关键问题】以小尾寒羊卵巢组织和卵泡颗粒细胞为试验材料,在组织和细胞的转录水平鉴定miR-221-3p和靶基因的表达情况,验证过表达miR-221-3p调控靶基因表达,并通过鉴定卵泡颗粒细胞凋亡标志因子和的表达、EdU分析等进一步验证试验结果。
1 材料与方法
1.1 试验样品
试验所用小尾寒羊均饲养于天津市畜牧兽医研究所试验羊场,选取3周岁经产、健康状况良好的母羊6只(卵泡期和黄体期各3只),所有试验羊饲养环境均相同。屠宰后,取其心脏、肝脏、脾脏、肺、胃、下丘脑、垂体、子宫、卵巢、输卵管等组织,取样后迅速装入2 mL RNase-Free冻存管中,所有组织样品采集均在屠宰后半小时内完成,采完后迅速放入液氮,最后于-80 ℃冰箱冷冻保存备用。绵羊卵巢颗粒细胞由农业农村部动物遗传育种与繁殖重点实验室前期分离保存获得,HEK293T细胞从北京绿源博德公司购买所得,细胞储存于液氮中,备用。
1.2 主要试剂
组织/细胞RNA提取试剂盒(天根,北京)、cDNA反转录试剂盒(天根,北京)、SYBR Green qPCR Mix试剂盒(天根,北京);miRNA定量引物、mimic及inhibitor由广州锐博生物科技有限公司(中国)合成;DMEM培养基、Opti-MEM培养基、PBS缓冲液、胎牛血清、青霉素和链霉素、胰蛋白酶购自Gbico(美国);Lipofectamine®2000转染试剂盒购自Invitrogen(美国);双荧光素酶活性测定试剂盒购自Promega(美国),其他均为常规化学试剂。
1.3 小尾寒羊卵巢组织RNA提取及cDNA合成
将采集的卵泡期和黄体期小尾寒羊各组织在液氮中进行研磨,然后用Trizol(Invitrogen,美国)进行裂解,并根据动物组织总RNA提取试剂盒(天根,北京)的说明进行总RNA的提取,用1.0%琼脂糖凝胶电泳和NanoDrop 2000检测提取RNA的质量和浓度。经检验合格的组织总RNA置于-80 ℃保存备用。用TaKaRa反转录试剂盒反转录合成cDNA,反转录体系总体积为20 μL:PrimeScript RT Enzyme Mix Ⅰ 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5×PrimeScript Buffer(for Real Time)4.0 μL,RNA 1.0 μg,RNase-Free ddH2O补足至20 μL,全程在冰上操作。反转录反应条件:37℃ 15 min,85℃ 5 s。反转录得到cDNA后,用持家基因进行PCR检测,经检测合格的cDNA置于-20℃保存,备用。
1.4 miR-221-3p和BCL2L11小尾寒羊卵巢组织表达量检测
根据GenBank提供的绵羊和基因序列(登录号分别为XM_012173883.3和XM_ 004012836.3),利用Primer Premier 5.0软件进行引物设计,其中作为内参基因。引物由北京天一辉远生物科技有限公司合成,miR-221-3p及U6引物由广州锐博生物科技有限公司(中国)合成。各引物浓度均为10 μmol·L-1,其他详细信息见表1。
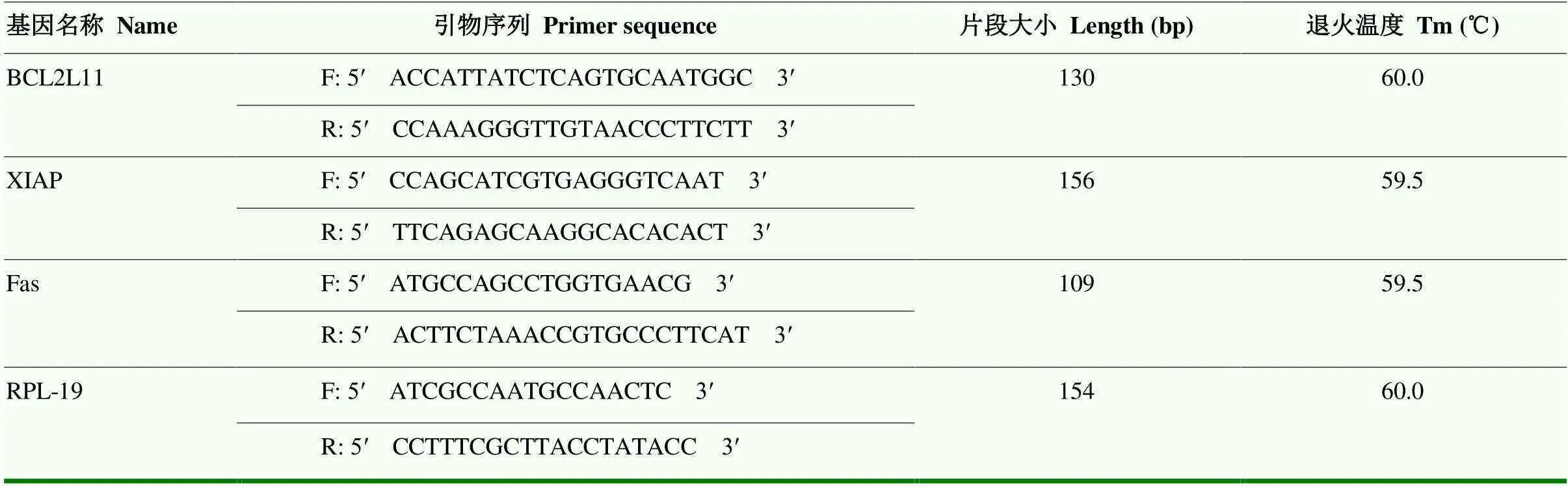
表1 引物的序列、扩增片段大小及退火温度
1.5 双荧光素酶报告基因检测系统验证
根据NCBI数据库中提供的绵羊的3′UTR序列,设计相关引物以扩增与miR-221-3p种子序列完全匹配的基因片段。使用载体为pmiR-RB- Report,在PCR上下游引物的5′端分别添加I和I两个酶切位点,同时合成了野生型及突变位点,序列见图1,红色字体为miR-221-3p种子序列核心结合区(载体由广州锐博生物公司构建)。PCR扩增体系:模板1 μL,2×Taq PCR Mastermix 10 μL,上、下游引物各0.5 μL,加ddH2O补足至20 μL。PCR反应程序:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,34个循环;72℃ 10 min。
将HEK293T细胞复苏后,传至2代以上,以1×104个/孔的密度接种到24孔板中,每孔放500 μL DMEM完全培养基。待细胞生长到80%—90%汇合,更换无血清的Opti-MEM优化培养基。分别将2 μL Lipo 2000 和pmiR-RB--WT(野生型)/ pmiR- RB--MT(突变型)载体和1 μL 50 nmol·L-1的oar-miR-221-3p mimic或mimic NC进行混合,混匀后转染到铺好的293T细胞中,转染4 h后换成含有10%血清的完全培养基,48 h后收细胞进行双荧光素酶检测试剂盒检测荧光素酶活性。

图1 miR-221-3p与靶基因BCL2L11结合位点预测及载体构建
1.6 卵泡颗粒细胞转染
将卵巢颗粒细胞以1×106个/孔的密度接种到6孔板中(每组3个重复),每孔中放2 mL DMEM完全培养基。待细胞生长到80%—90%密度时,更换培养基为Opti-MEM优化培养基(不含血清)。将10 μL 的Lipo 2000和4 μL 100 ng·μL-1的oar-miR-221-3p mimic/inhibitor及NC(由广州锐博生物科技有限公司(中国)合成)分别添加到250 μL Opti-MEM培养基中,混合后,室温下孵育20min,进行细胞转染。4 h后更换为完全培养基,48 h后收集细胞。
1.7 卵泡颗粒细胞RNA提取及RT-qPCR检测
使用细胞总RNA提取试剂盒提取卵泡颗粒细胞总RNA,用PrimeScript RT试剂盒将RNA反转录为cDNA。RT-qPCR实验步骤同1.4中组织定量步骤。用于RT-qPCR的引物序列见表1。
1.8 EdU检测
按照1.6中颗粒细胞转染步骤进行转染,根据试剂盒说明书(碧云天,北京)配置EdU工作液,向每孔加500 µL 10 µmol·L-1EdU工作液,将细胞再培养3 h。然后用PBS清洗细胞,用4%的多聚甲醛固定30 min。为了中和多余的醛基,每孔加入50 µL 2 mg·mL-1的甘氨酸孵育15 min。每孔中加入100 µL 0.5% Triton X-100孵化15 min。冲洗后,加入100 µL Apollo试剂,室温下避光孵化30 min。用PBS清洗细胞,然后用Hoechst 33342反应液在暗房中对细胞核进行染色30 min。使用荧光显微镜对EdU染色的细胞进行观察和量化。随机选择3个区域进行量化和用ImageJ软件进行统计分析。
1.9 数据分析
所有结果以“平均值±标准差”表示。荧光定量PCR测定数据采用独立样本检验分析,双荧光素酶报告基因试验所得的数据通过单因素ANOVA方差分析进行评估,*<0.05,**<0.01代表组间差异具有统计学意义。所有统计分析均使用SPSS 20.0软件进行。
2 结果
2.1 BCL2L11组织表达谱分析
利用半定量和实时定量PCR检测在小尾寒羊各个组织中的表达情况,结果表明,在小尾寒羊心脏、肝脏、脾脏、肺、胃、下丘脑、垂体、卵巢、子宫和输卵管10个组织中均有表达,RT-qPCR和半定量表达谱均显示在卵巢组织中表达量最高(图2)。
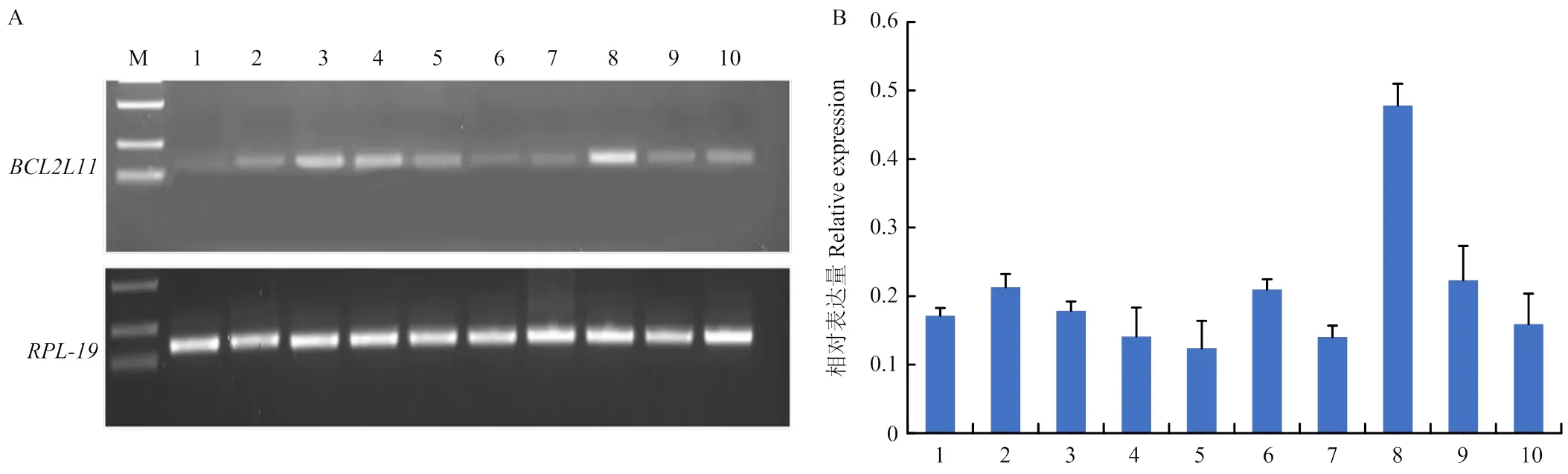
A: BCL2L11半定量分析;B: BCL2L11相对表达量分析。M: Marker; 1—10分别为心脏、肝脏、脾脏、肺、胃、下丘脑、垂体、卵巢、子宫、输卵管
2.2 miR-221-3p和BCL2L11在小尾寒羊卵巢组织中表达量情况
通过对卵泡期和黄体期小尾寒羊卵巢组织中miR-221-3p和RT-qPCR定量试验检测,发现在黄体期卵巢组织中的表达量显著高于卵泡期,而miR-221-3p的表达量则相反(<0.05)(图3)。推测是miR-221-3p的靶基因之一,并且该基因与绵羊卵泡期到黄体期的转变有关。
2.3 miR-221-3p与BCL2L11靶向性验证
为了进一步研究miR-221-3p与靶向性关系,通过Targetscan在线软件预测了miR-221-3p在基因上结合位置,发现基因的3′UTR区存在miR-221-3p的特异性结合位点,随后以NCBI中提供的3′UTR为模板设计了包含miR-221-3p种子序列结合位点片段的引物,进行PCR扩增。构建了野生型重组质粒“pmiR-RB--WT”和突变型重组质粒“pmiR-RB--MT”。试验分为4组,分别是pmiR-RB--WT、miR-221-3p mimic;pmiR-RB--WT、mimic NC;pmiR-RB--MT、miR-221-3p mimic;pmiR-RB-- MT、mimic NC,每组设3个重复孔,共转染HEK293T细胞。结果显示,过表达miR-221-3p显著降低了野生型质粒的荧光活性(<0.05);但对突变型质粒没有显著作用(>0.05);阴性对照对各组质粒的荧光活性都没有显著影响(>0.05)(图4)。结果表明miR-221-3p可与3′UTR区的种子序列结合,是其靶基因之一。

LP:黄体期;FP:卵泡期LP: luteal phase; FP: follicular phase *P<0.05 下同The same as below
2.4 过表达miR-221-3p对BCL2L11表达的影响
为了确定miR-221-3p是否能够调控的表达,本试验利用miR-221-3p mimic和mimic NC转染绵羊卵泡颗粒细胞。转染48 h后收集细胞提取总RNA进行靶基因RT-qPCR定量检测。结果显示,与空白对照相比,过表达miR-221-3p组中mRNA表达量显著降低(<0.05);阴性对照组(mimic NC)中对表达量无显著影响(图5),表明miR-221-3p与之间存在靶向性关系,并且在转录水平是负调控的。
2.5 过表达miR-221-3p对卵泡颗粒细胞凋亡标志因子XIAP和Fas表达的影响
为了确定绵羊miR-221-3p是否通过调控表达影响卵泡颗粒细胞凋亡,本试验利用miR-221-3p mimic和mimic NC转染到绵羊卵泡颗粒细胞中,转染48 h后收集细胞提取总RNA,通过RT-qPCR检测卵泡颗粒细胞凋亡标志基因和在mRNA水平上的相对表达量。结果显示,转染miR-221-3p mimic后,和的mRNA表达量显著降低(<0.05)(图6-A)。EdU分析显示,过表达miR-221-3p的颗粒细胞增殖率为18.9%,极显著高于阴性对照组的10.43%(**<0.01,图6-B)。

图4 miR-221-3p与BCL2L11靶向关系的双荧光素酶活性检测
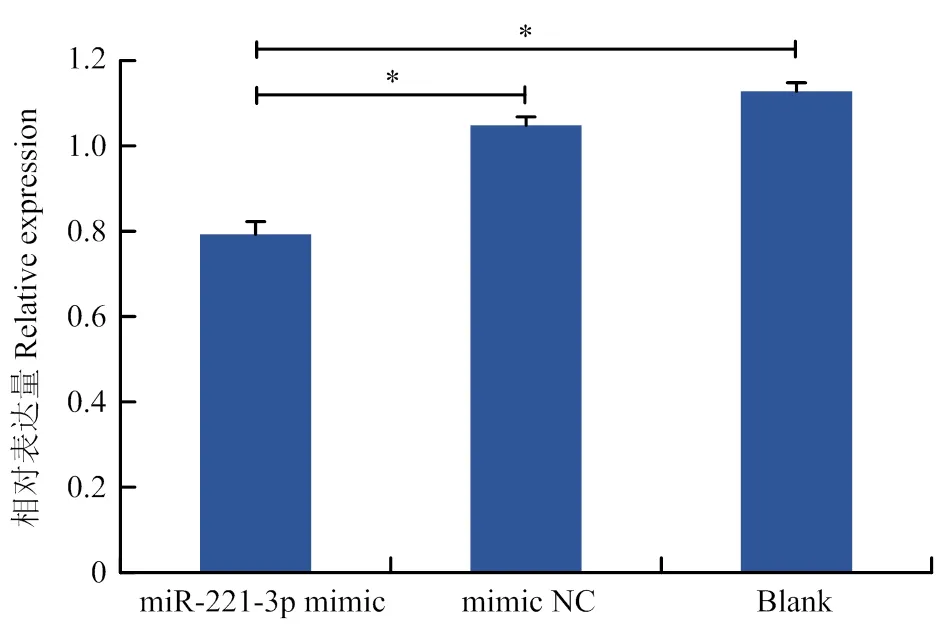
图5 过表达miR-221-3p抑制了BCL2L11的表达
3 讨论
绵羊繁殖性状十分复杂,受到卵泡发育、排卵率、发情周期转变等的影响。卵泡颗粒细胞为卵泡提供营养物质,其增殖和凋亡直接影响卵母细胞的闭锁、发育和成熟。在雌性哺乳动物中,单层的卵泡颗粒细胞包裹着卵母细胞,随着卵泡的不断发育,颗粒细胞形态也随之发生变化,由扁平生长为柱状,由单层生长为多层,在此过程中颗粒细胞不断为卵母细胞提供能量,包括氨基酸、核苷酸、谷胱甘肽和糖代谢物等[20]。在单胎哺乳动物中,每个发情周期卵巢组织中只有1个卵泡可以发展为优势卵泡发育成熟并排卵,其余卵泡均闭锁凋亡,有研究发现卵泡闭锁是由于卵泡颗粒细胞的凋亡造成的[21-22]。在小尾寒羊群体中存在单羔和多羔个体现象,在排卵过程中很好地体现了多个优势卵泡同时发育成熟并排卵形成多羔,该群体可为研究多羔性状产生的分子机制提供研究基础和试验材料。前人研究结果显示,可通过的反式激活参与人颗粒细胞凋亡,是参与颗粒细胞凋亡的重要调控基因[23]。在本研究中发现在绵羊各组织中广泛存在(图2),但是在卵巢组织中高表达,因此,该结论与前人的研究结果一致,参与卵巢组织发育。

A:过表达miR-221-3p抑制XIAP和Fas表达;B: EdU检测颗粒细胞凋亡
miRNA作为目前研究比较成熟的转录后调控元件,参与有机体生长、发育、繁殖及衰亡的各个环节。在细胞凋亡的研究中发现多个miRNAs参与细胞凋亡过程。研究表明,miR-1275、let-7家族、miR-23a等,均参与了卵泡颗粒细胞凋亡和卵泡闭锁过程,其中let-7家族在猪卵泡闭锁过程中高水平表达,可以显著提高猪卵泡颗粒细胞的凋亡率[24-26]。作为影响卵泡颗粒细胞发育的重要候选基因,miRNA如何调控该基因表达的报道较少。本研究通过前期全转录组测序数据进行生物学分析发现miR-221-3p是调控表达的miRNA之一,通过双荧光素酶报告基因活性检测发现存在miR-221-3p的靶向性结合位点,在模式化细胞293T细胞系中其mimic能够结合到的3′UTR区域。此外,研究发现,miR-221-3p主要参与治疗癌症及炎症反应,抑制miR-221-3p的表达则可能促进胶质瘤细胞的凋亡,表明低表达的miR-221-3p更有可能造成细胞凋亡[27]。该文献佐证了miR-221-3p低表达对靶基因的抑制作用不足,会影响卵泡颗粒细胞的凋亡,与目前所发现的功能一致。
和是细胞凋亡的关键细胞因子,可作为检测卵泡颗粒细胞凋亡重要标志[28-29]。在本研究中,过表达miR-221-3p后表达量显著降低,而标志因子和的mRNA表达量也显著降低,这与前人在猪卵泡颗粒细胞中所得到的结果相似[30],说明miR-221-3p能够通过抑制的表达显著影响颗粒细胞的凋亡。
4 结论
研究发现miR-221-3p靶向调控表达对绵羊卵泡颗粒细胞凋亡有显著影响。过表达miR-221-3p可以抑制的表达从而调控绵羊颗粒细胞凋亡,表明具有调控绵羊颗粒细胞凋亡的作用,为进一步研究在绵羊卵泡颗粒细胞中的调控机制奠定了理论基础。
[1] 付靖波, 张红霞, 朱海英. 颗粒细胞凋亡调控机制及其在卵泡发育中的作用. 中国临床医学, 2020(5):857-860. doi:10.12025/j.issn. 1008-6358.2020.20191161.
FU J B, ZHANG H X, ZHU H Y. Regulation mechanisms of granulosa cells apoptosis and its role in follicular development. Chinese Journal of Clinical Medicine, 2020(5):857-860.(in Chinese) doi:10.12025/j.issn.1008-6358.2020.20191161.
[2] ASSELIN E, XIAO C W, WANG Y F, TSANG B K. Mammalian follicular development and atresia: role of apoptosis. Biological Signals & Receptors, 2000, 9(2): 87-95.
[3] 徐子雯, 杨珖, 姚桂东. 微小RNA在卵巢卵泡发育中的调控作用. 中华生殖与避孕杂志, 2020(10):847-852. doi:10.3760/cma.j. cn101441-20191008-00440.
XU Z W, YANG G, YAO G D. Regulation of microRNA in ovarian follicular development. Chinese Journal of Reproduction and Contraception, 2020(10):847-852. doi:10.3760/cma.j.cn101441-20191008- 00440. (in Chinese)
[4] 范冰峰, 赵向远, 韩玉萍, 李文, 李晓霞, 许保增. 颗粒细胞对卵母细胞成熟和排卵影响研究进展. 特产研究, 2020(5): 78-83.
FAN B F, ZHAO X Y, HAN Y P, LI W, LI X X, XU B Z. Research progress on effects of granulosa cells on oocyte maturation and ovulation. Special Wild Economic Animal and Plant Research, 2020(5): 78-83. (in Chinese)
[5] PIPER L R, BINDON B M, DAVIS G H. The single gene inheritance of the high litter size of the Booroola Merino//LAND R B, ROBINSON D W. eds. Genetics of Reproduction in Sheep. London, UK: Butterworths, 1985:115-125.
[6] SILVA J R, VAN DEN HURK R, VAN TOL H T, ROELEN B A, FIGUEIREDO J R. Expression of growth differentiation factor 9 (GDF9), bone morphogenetic protein 15 (BMP15), and BMP receptors in the ovaries of goats. Molecular Reproduction and Development, 2005, 70(1): 11-19. doi:10.1002/mrd.20127.
[7] PRAMOD R K, SHARMA S K, SINGHI A, PAN S, MITRA A. Differential ovarian morphometry and follicular expression of BMP15, GDF9 and BMPR1B influence the prolificacy in goat. Reproduction in Domestic Animals, 2013, 48: 803-809.
[8] WANG W, ZHANG X, ZHOU X, ZHANG Y, LA Y, ZHANG Y, LI C, ZHAO Y, LI F, LIU B, JIANG Z. Deep genome resequencing reveals artificial and natural selection for visual deterioration, plateau adaptability and high prolificacy in Chinese domestic sheep. Frontiers in Genetics, 2019, 10: 300. doi:10.3389/fgene.2019.00300.
[9] POKHAREL K, PEIPPO J, HONKATUKIA M, SEPPÄLÄ A, RAUTIAINEN J, GHANEM N, HAMAMA T M, CROWE M A, ANDERSSON M, LI M H, KANTANEN J. Integrated ovarian mRNA and miRNA transcriptome profiling characterizes the genetic basis of prolificacy traits in sheep (). BMC Genomics, 2018, 19(1): 104. doi:10.1186/s12864-017-4400-4.
[10] MIAO X, LUO Q, ZHAO H, QIN X. Ovarian proteomic study reveals the possible molecular mechanism for hyperprolificacy of Small Tail Han sheep. Scientific Reports, 2016, 6: 27606. doi:10.1038/srep27606.
[11] CONCANNON C G, TUFFY L P, WEISOVÁ P, BONNER H P, DÁVILA D, BONNER C, DEVOCELLE M C, STRASSER A, WARD M W, PREHN J H. AMP kinase-mediated activation of the BH3-only protein Bim couples energy depletion to stress-induced apoptosis. Journal of Cell Biology, 2010, 189(1):83-94.
[12] KILBRIDE S M, FARRELLY A M, BONNER C, WARD M W, NYHAN K C, CONCANNON C G, WOLLHEIM C B, BYRNE M M, PREHN J H. AMP-activated protein kinase mediates apoptosis in response to bioenergetic stress through activation of the pro-apoptotic Bcl-2 homology domain-3-only protein BMF. The Journal of Biological Chemistry, 2010, 285(46): 36199-36206. doi:10.1074/jbc. m110.138107.
[13] O’CONNOR L, STRASSER A, O’REILLY L A, HAUSMANN G, ADAMS J M, CORY S, HUANG D C. Bim: a novel member of the Bcl-2 family that promotes apoptosis. EMBO Journal, 1998, 17(2): 384-395.
[14] PERIER C, BOVÉ J, WU D C, DEHAY B, CHOI D K, JACKSON- LEWIS V, RATHKE-HARTLIEB S, BOUILLET P, STRASSER A, SCHULZ J B, PRZEDBORSKI S, VILA M. Two molecular pathways initiate mitochondria-dependent dopaminergic neurodegeneration in experimental Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(19): 8161-8166.
[15] WANG H, SHA L, HUANG L, YANG S, ZHOU Q, LUO X, SHI B. LINC00261 functions as a competing endogenous RNA to regulate BCL2L11 expression by sponging miR-132-3p in endometriosis. American Journal of Translational Research, 2019, 11(4): 2269-2279.
[16] QU H M, QU L P, PAN X Z, MU L S. Upregulated miR-222 targets BCL2L11 and promotes apoptosis of mesenchymal stem cells in preeclampsia patients in response to severe hypoxia. International Journal of Clinical and Experimental Pathology, 2018, 11(1): 110-119.
[17] ZHAI M, XIE Y, LIANG H, LEI X, ZHAO Z. Comparative profiling of differentially expressed microRNAs in estrous ovaries of Kazakh sheep in different seasons. Gene, 2018, 664: 181-191. doi:10.1016/j. gene.2018.04.025.
[18] ZHOU C F, MA J, HUANG L, YI H Y, ZHANG Y M, WU X G, YAN R M, LIANG L, ZHONG M, YU Y H, WU S, WANG W. Cervical squamous cell carcinoma-secreted exosomal miR-221-3p promotes lymphangiogenesis and lymphatic metastasis by targeting VASH1. Oncogene, 2019, 38(8): 1256-1268. doi:10.1038/s41388-018-0511-x
[19] WEI W F, ZHOU C F, WU X G, HE L N, WU L F, CHEN X J, YAN R M, ZHONG M, YU Y H, LIANG L, WANG W. microRNA-221-3p, a TWIST2 target, promotes cervical cancer metastasis by directly targeting THBS2. Cell Death & Disease, 2017, 8(12): 3220. doi:10. 1038/s41419-017-0077-5.
[20] LUBUSKY M, PROCHAZKA M, DHAIFALAH I, HORAK D, GEIEROVA M, SANTAVY J. Fetal enterolithiasis: Prenatal sonographic and MRI diagnosis in two cases of urorectal septum malformation (URSM) sequence. Prenatal Diagnosis, 2006, 26(4): 345-349. doi:10.1002/pd.1415.
[21] HUGHES F M, GOROSPE W C. Biochemical identification of apoptosis (programmed cell death) in granulosa cells: Evidence for a potential mechanism underlying follicular atresia. Endocrinology, 1991, 129(5): 2415-2422.
[22] FU X, HE Y, WANG X, PENG D, CHEN X, LI X, WAN Q. microRNA-16 promotes ovarian granulosa cell proliferation and suppresses apoptosis through targeting PDCD4 in polycystic ovarian syndrome. Cellular Physiology and Biochemistry, 2018, 48(2): 670-682. doi:10.1159/000491894.
[23] MATSUDA F, INOUE N, MAEDA A, CHENG Y, SAI T, GONDA H, GOTO Y, SAKAMAKI K, MANABE N. Expression and function of apoptosis initiator FOXO3 in granulosa cells during follicular atresia in pig ovaries. The Journal of Reproduction and Development, 2011, 57(1): 151-158. doi:10.1262/jrd.10-124h.
[24] LIU J, LI X, YAO Y, LI Q, PAN Z, LI Q. miR-1275 controls granulosa cell apoptosis and estradiol synthesis by impairing LRH-1/CYP19A1 axis. Biochimica et Biophysica Acta Gene Regulatory Mechanisms, 2018, 1861(3): 246-257. doi:10.1016/j.bbagrm.2018.01.009.
[25] ZHUANG R J, BAI X X, LIU W. MicroRNA-23a depletion promotes apoptosis of ovarian cancer stem cell and inhibits cell migration by targeting DLG2. Cancer Biology & Therapy, 2019, 20(6): 897-911.
[26] CAO R, WU W J, ZHOU X L, XIAO P, WANG Y, LIU H L. Expression and preliminary functional profiling of the let-7 family during porcine ovary follicle atresia. Molecules and Cells, 2015, 38(4): 304-311. doi:10.14348/molcells.2015.2122.
[27] MILANI R, BROGNARA E, FABBRI E, MANICARDI A, CORRADINI R, FINOTTI A, GASPARELLO J, BORGATTI M, COSENZA L C, LAMPRONTI I, DECHECCHI M C, CABRINI G, GAMBARI R. Targeting miR1555p and miR2213p by peptide nucleic acids induces caspase3 activation and apoptosis in temozolomide resistant T98G glioma cells. International Journal of Oncology, 2019, 55(1): 59-68. doi:10.3892/ijo.2019.4810.
[28] 蒋鹏飞, 覃艮艳, 彭晓芳, 张又玮, 彭俊, 彭清华. 密蒙花颗粒剂对去势雄兔泪腺细胞凋亡因子Bax、Caspase-3、Fas和FasL的影响. 时珍国医国药, 2019(12): 2820-2822.
JIANG P F, QIN G Y, PENG X F, ZHANG Y W, PENG J, PENG Q H. Effects of Mimenghua granules on apoptosis factors bax, caspase-3, FasL in lacrimal gland cells of ovariectomized male rabbits. Lishizhen Medicine and Materia Medica Research, 2019(12): 2820-2822. (in Chinese)
[29] YANG W, COOKE M, DUCKETT C S, YANG X, DORSEY J F. Distinctive effects of the cellular inhibitor of apoptosis protein c-IAP2 through stabilization by XIAP in glioblastoma multiforme cells. Cell Cycle (Georgetown, Tex), 2014, 13(6): 992-1005. doi:10.4161/cc.27880.
[30] 吴夏梦, 刘进辉, 王英, 雷磊, 周展波, 王水莲, 张虹亮. CRABP1过表达载体的构建及其对猪卵泡颗粒细胞凋亡的影响. 中国畜牧杂志, 2021(6): 172-177.
WU X M, LIU J H, WANG Y, LEI L, ZHOU Z B, WANG S L, ZHANG H L. Construction of CRABP1 overexpression vector and its effect on porcine granulosa cell apoptosis. Chinese Journal of Animal Science, 2021(6): 172-177. (in Chinese)
miR-221-3p Regulates Ovarian Granulosa Cells Apoptosis by TargetingSmall-Tail Han Sheep

1Institute of Animal Science, Chinese Academy of Agricultural Sciences/Key Laboratory of Animal Genetics, Breeding and Reproduction, Ministry of Agriculture and Rural Affairs, Beijing 100193;2College of Life Science and Food Engineering, Hebei University of Engineering, Handan056001, Hebei
【】could promote apoptosis in mammals and is involved in the development of tissues and organs related to reproductive traits and in disease treatment. The aim of this study was to explore the effect of miR-221-3p on the regulation of granulosa cell apoptosis in Small-Tail Han sheep by targeting, so as to provide evidence for further study of the regulation ofgranulosa cell apoptosis and atresia of follicles.【】Based on the whole transcriptome sequencing analysis of the ovarian tissue of the previous study in our group, the differentially expressed geneand its regulatory element miR-221-3p were obtained in this study. Analysis of the expression ofdifferent tissues of the Small-Tail Han sheep by using semi-quantitative and tissue fluorescence quantification (RT-qPCR). The expression ofand miRNA-221-3p was identified in the ovarian tissues of the Small-Tail Han sheep in the follicular and luteal phase by RT-qPCR. The miR-221-3p mimic,wild-type andmutant-type were co-transfected in HEK293T cells with negative control, the dual luciferase reporter gene detection system was used to determine the targeting relationship between miR-221-3p and. The miR-221-3p mimic and negative control were transfected into ovarian granulosa cells to achieve the overexpression of miR-221-3p. RT-qPCR was used to detect the effect of miR-221-3p on the expression levels ofand the marker genes of the apoptosis of ovarian granulosa cell geneandat the mRNA level. At the same time, the changes in proliferation of granulocytes in the miR-221-3p overexpression and negative control groups were also analyzed using the EdU assay. 【】The results showed that the expression ofovarian tissue was the highest, followed by spleen and lung tissues. RT-qPCR results showed that the expression of miR-221-3p andwas significantly different in the ovarian tissues of Small-Tail Han sheep between follicular and luteal phases. The expression of miR-221-3p was higher in follicular than that in luteal phase ovaries, whereaswas less expressed in follicular than that in luteal phase ovaries, which showed the phenomenon of a negative regulation. Dual luciferase reporter analysis showed that overexpression of miR-221-3p significantly inhibited the activity of3’UTR vector (<0.05). The overexpression of miR-221-3p significantly reduced the mRNA level expression of target gene, while follicular granulosa cell apoptosis expression of marker genesandwere also significantly reduced (<0.05). Analysis of the EdU assay showed that the proliferation rate of granulosa cells overexpressing miR-221-3p was 18.9%, which was significantly higher than that of the negative control group at 10.43% (<0.01). 【】and miR-221-3p were important genes and regulatory elements that regulate ovarian development in Small-Tail Han sheep.was one of the target genes of miR-221-3p, and overexpression of miR-221-3p could inhibit granulosa cell apoptosis by target.
miR-221-3p; Small-Tail Han Sheep; granulosa cells apoptosis;

10.3864/j.issn.0578-1752.2022.09.015
2021-03-04;
2021-10-31
国家自然科学基金(32172704)、河北省自然科学基金青年项目(C2019402261)、国家肉羊产业技术体系专项(CARS-38)、中国农业科学院科技创新工程(ASTIP-IAS13)
刘玉芳,E-mail:aigaiy@126.com。通信作者储明星,E-mail:mxchu@263.net
(责任编辑 林鉴非)
