应用杆状病毒表达系统有效表达PEDV纤突蛋白
2022-05-17郝建伟薛春宜曹永长
郝建伟,薛春宜,曹永长
(1.晋中学院 生物科学与技术系,山西 晋中 030600;2.中山大学 生命科学学院/有害生物控制与资源利用国家重点实验室,广东广州 510006)
自2010年起,猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)变异毒株的蔓延对全球养猪业造成重大影响,已有的疫苗及免疫策略已不能有效抵抗新型毒株的感染[1-3]。近年来,随着PEDV疫苗研究的不断深入,有效的疫苗结合不同免疫策略研究日益增多[4]。有研究显示,弱毒疫苗免疫母猪被动保护仔猪,其仔猪成活率为66.7%~100%[4],其中口服免疫保护率最高为100%,而肌肉注射保护率为80%[5-6]。全病毒灭活疫苗免疫母猪,仔猪存活率为80%~100%。有研究表明,肌肉注射方式保护率(91.7%~100%)[7-8]略优于滴鼻免疫(80.0%~86.7%)[9-10]。S蛋白是PEDV重要的保护性抗原,目前已鉴定的具有中和抗体诱导活性的抗原表位均分布于S蛋白的S1和S2亚基。已有研究采用S蛋白制备亚单位疫苗肌肉注射免疫仔猪,结果表明,免疫仔猪排毒量显著降低,腹泻症状明显减轻,仔猪存活率可达100%[11-13]。但PEDV粒子纤突蛋白含量较低且易受温度和p H等因素的影响[14-15]。前期试验结果表明,超速离心浓缩病毒易引发冠状病毒纤突脱落,降低病毒感染性滴度,而感染性滴度在疫苗免疫保护中起着重要作用[16]。因此,完整的具备真核生物修饰的S糖蛋白可能是PEDV防控的重要选择。
PEDV S蛋白的分子量较大,其成功表达需兼顾蛋白修饰和产量;而原核表达系统及哺乳动物表达系统因缺乏修饰或产量过低而难以有效进行表达。杆状病毒表达系统已被证明可用于多种病原抗原肽段的表达,目前,已有多个商业化产品被用于疫病防控。
由于昆虫细胞与哺乳动物细胞可识别的信号肽种类存在差异,而信号肽又会影响蛋白的表达效率[17-18]。因此,本研究利用昆虫杆状病毒表达系统分别表达了PEDV全长S蛋白,并替换了蜂素信号肽的S蛋白,对比了替换信号肽对表达S蛋白的作用,采用表达蛋白免疫小鼠分析其免疫效果,旨在为PEDV新型疫苗的研制提供理论依据。
1 材料和方法
1.1 毒株和试验动物
猪流行性腹泻病毒变异毒株GDS01[19]由中山大学生命科学学院有害生物控制与资源利用实验室分离保存(GenBank登录号:KM 089829)。小鼠免疫及测定试验采用6周龄无特定病原菌(Specific pathogens free,SPF)Balb/c小鼠6只,购自中山大学试验动物中心(在中山大学试验动物中心饲养)。
1.2 主要仪器与试剂
大容量低速冷冻离心机和超速冷冻离心机(Beckman公司),H-I微型混合器(上海青浦徐新生化仪器厂),移液器和冷冻离心机(Eppendorf公司),电子天平(Sartorius公司),高压锅(Hirayama公司),Milli-Q超纯水仪(Millipore公司),超净工作台(苏州净化设备公司),梯度PCR仪、电泳仪(Bio-Rad公司),凝胶成像系统和分光光度仪(Syngene公司),脱色摇床(江苏海门市麒麟医用仪器厂),漩涡振荡器(杭州仪表电机厂),制冰机和-20℃冷冻冰柜(日本SANYO公司),电热恒温水槽(上海精宏实验设备有限公司),4℃冷藏冰箱(海尔公司,青岛),-80℃超低温冰箱、生物安全超净工作台和细胞培养箱(Thermo公司),显微镜(Olympus公司),超声波细胞粉碎机(南京新辰生物科技有限公司),酶标仪(Bio-Tek公司),分散机(IKA公司)。
TaqDNA聚合酶、反转录试剂盒和DL 2000 Marker(Takara公司),Sf 9细胞培养基、Sf 9无血清培养基SF900II介质、DMEM低糖培养基、胎牛血清FBS、0.25%胰蛋白酶和0.25%EDTA胰蛋白酶(GIBCO公司),转染试剂Cellfectin Reagent和Trizol(Invitrogen公司),PVDF膜(Millipore公司),高纯度质粒纯化提取试剂盒(Tiangen公司),琼脂糖凝胶DNA回收试剂盒(Axygen公司),蛋白质Marker、限制性内切酶和连接酶(Fermentas公司),Western-blot无蛋白封闭液(Kem-En-Tec公司),小鼠抗PEDV多抗和HRP标记的羊抗鼠二抗(实验室自制),弗氏完全/不完全佐剂(Thermo公司)。其他各种化学试剂均为Sigma公司产品或国产化学分析纯。
1.3 猪流行性腹泻病毒S蛋白信号肽预测
GDS01毒株由中山大学有害生物控制与资源利用国家重点实验室保存,利用Trizol试剂参考说明书提取RNA,按照反转录试剂盒说明书获得cDNA模板。Vero细胞培养按照文献[9]所述方法操作。利用Signal 4.0软件预测S蛋白的信号肽。
1.4 表达替换信号肽S蛋白重组质粒的构建与鉴定
设计PCR引物分别用于扩增完整的S序列,去信号肽S基因片段和蜂素信号肽基因引物序列如 表1所示。
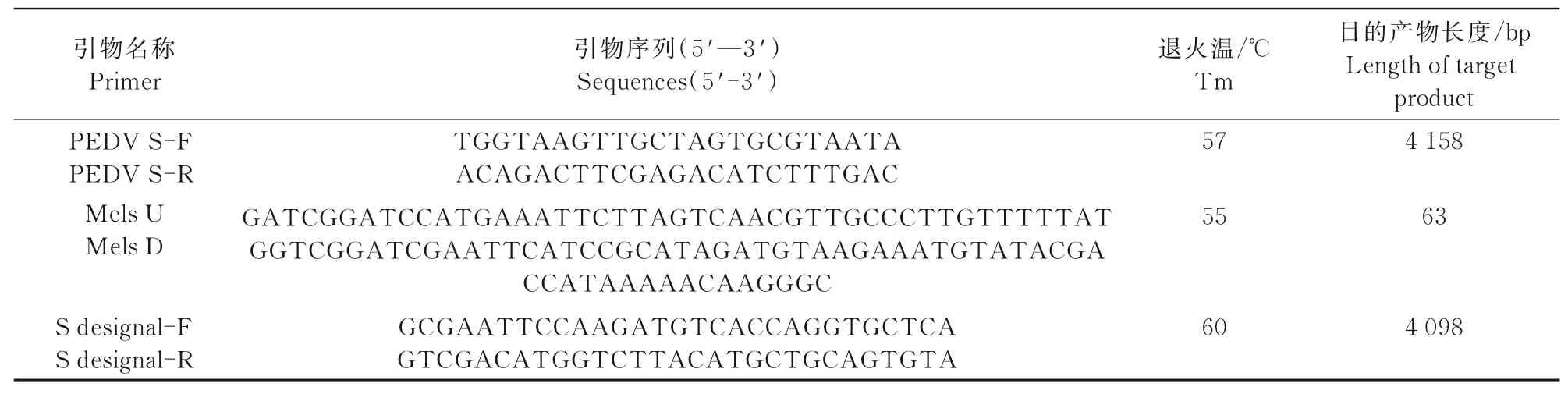
表1 引物信息Tab.1 Primer information
将1μg经测序验证的质粒加入100μL的DH 10Bac感受态细胞,冰浴30 min,42℃热击45 s,冰上冷却3 min,加入900μL SOC液体培养基,37℃220 r/min培养4 h。取出菌液进行梯度稀释,稀释倍数分别为10、100、1 000,分别取100μL稀释后的菌液涂布于含有三抗的LB平板,放入37℃培养箱内避光培养48 h。挑取平板上的白色菌落,在新的含有庆大霉素、四环素、卡那霉素3种抗生素LB平板上划线,于37℃避光培养48 h后挑取单个白色菌落至含有上述3种抗生素的LB液体培养基中,37℃220 r/min培养6 h,取1μL菌液作为模板进行PCR检测。重组Bacmid DNA的提取步骤参考Invitrogen公司Bac-to-Bac Baculovirus System说明书中推荐方法进行。
1.5 重组杆状病毒的制备及表达蛋白的鉴定
Sf9昆虫细胞生长于Sf9培养基中,在28℃条件下培养。用Cellfectin试剂转染Sf9细胞,转染72 h后从细胞上清液中收取病毒作为第1代重组病毒(P1);转染后收获的重组病毒经过2次传代后得到第3代重组病毒(P3),用蚀斑法对重组杆状病毒进行纯化。
将收集到的细胞经PBS洗涤3次,反复冻融3次,后用超声破碎仪进行超声破碎。超声破碎后4℃,12 000×g下离心10 min,收集上清液,加入5×SDS-PAGE上样缓冲液,沸水煮5 min,上样进行SDS-PAGE电泳。阴性对照为经相同处理的感染空载体杆状病毒的Sf9细胞,通过Western-blot鉴定含蜂素信号肽S重组蛋白。随后进行蛋白的胶内酶解。手工切取经考马斯亮蓝染色的凝胶目的条带,加入脱色液100μL(50%乙腈,50%mmol/L NH4HCO3)浸 泡,振 荡20 min,弃 去 脱 色液,重复脱色1~2次至脱色液透明。加入50μL(10 mmol/L)DTT还原液,56℃作用30 min,弃去还原液,加入100μL乙腈脱水5~10 min,加入50μL(55 mmol/L)碘乙酰胺溶液烷基化,避光作用30 min,弃烷基化液,加入100μL脱色液,洗5~10 min,弃脱色液,冻干胶粒。
将经胰酶消化的肽段用AB4800 Plus基质辅助激光解析离子吸附-飞行时间串联质谱(MALDITOF-TOF)进行分析,一级质谱的质量扫描范围为800~3 500 ku,高丰度的母离子通过碰撞诱导解离进一步形成离子碎片,质谱由标准肽混合物作为外标校正,根据肽质量指纹(PMF)和串联质谱的分析数据进行蛋白鉴定。
获得的一级和二级质谱数据使用GPS Explore软件进行分析,分析后的每一个样品的一级和二级质谱数据再整合成一个文件,使用MASCOT(Version 2.1,Matrix Science,U.K)搜索软件对本地数据库进行搜索,鉴定蛋白质。
1.6 免疫的样品制备与免疫剂量
采用pH值为5.89的细胞裂解缓冲液(20 mmol/L磷酸钠,1.0 mmol/L EDTA,0.01%TritonX-100,5%丙三醇)裂解细胞,超声破碎后离心去除细胞碎片,使用Milipore Ultra 100 ku超滤管对收获液进行超滤浓缩,步骤为5 000×g离心30 min。
利用倍比稀释的BSA制备标准曲线,测定S蛋白质量,免疫剂量按照小鼠常用剂量确定为100μL/只。按照1∶1的比例将抗原与弗氏佐剂混合乳化完全,样品存放于4℃保存备用,弗氏佐剂配制疫苗用于免疫小鼠。小鼠免疫分组情况如表2所示。
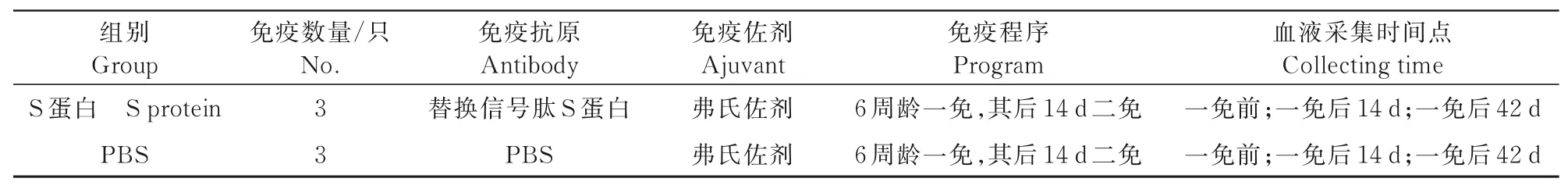
表2 小鼠免疫分组及免疫程序Tab.2 Different mouse immunization groups and the program
1.7 小鼠抗体检测及细胞因子测定
采用中和试验方法检测试验动物抗体水平[20]。小鼠细胞因子测定通过ELISPOT试验检测IL-4及IFN-γ细胞因子水平:第1天完成脾淋巴细胞分离及加入刺激物进行培养试验,按每孔3.0×105个细胞的细胞浓度将淋巴细胞加至活化的ELISPOT板中,每孔100μL。试验组加入刺激物,设置正对照孔(加入佛波酯(PMA)2.5μg/mL)、负对照孔(只加细胞及培养基)和背景对照孔(不含细胞只加培养基和检测试剂)。将ELISPOT板放入37℃、5%CO2培养箱中培养20 h。
次日检测细胞裂解及斑点。倾倒板内细胞及培养基,4℃下放置10 min裂解板内细胞,洗涤5~7次后拍干。将稀释好的生物素标记抗体加入各孔,每孔加入100μL后置于37℃孵育1 h,洗涤5次;将稀释好的酶标亲和素工作液按100μL/孔加入后37℃孵育1 h,按上述洗涤方法洗涤5次后各孔加入AEC显色工作液100μL/孔,37℃避光静置15 min后倾倒孔内液体,打开ELISPOT板底座,用去离子水反复冲洗正反面终止显色,将其放置在室温阴凉处晾干,后用ELISPOT读板仪进行斑点计数。
2 结果与分析
2.1 PEDV S蛋白信号肽预测结果
利用Signal 4.0软件对S蛋白信号肽进行分析,结果如图1所示。
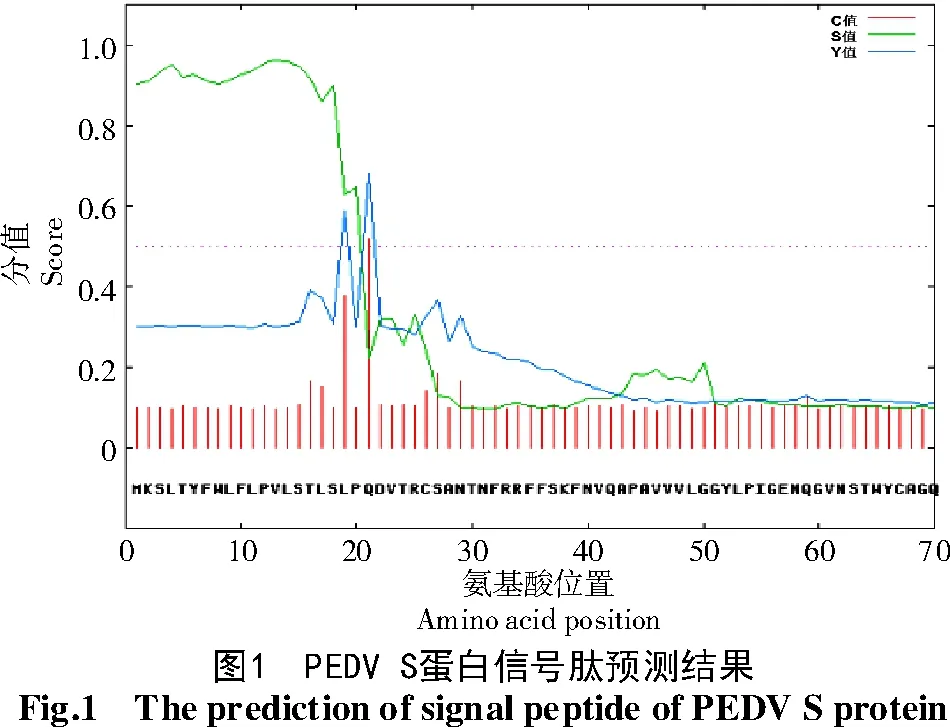
从图1可以看出,S蛋白前20个氨基酸为蛋白信号肽,信号肽氨基酸序列为MKSLTYFWLFLP VLSTLSLP。
2.2 表达替换信号肽S蛋白重组质粒的构建与鉴定结果
应用杆状病毒表达系统Bac-to-Bac表达S蛋白和替换信号肽S蛋白,将S基因和替换信号肽S基因分别插入p FastBacDual质粒p H启动子下,获得重组质粒p FastBacDual-Sph和p FastBacDual-MelSph,利用双酶切鉴定质粒,结果如图2-A所示,酶切后载体片段长约5 238 bp,S为4 158 bp,表明重组质粒构建成功。送酶切成功的质粒至公司测序。质粒p FastBacDual-MelSph测序结果正确,转化DH 10 Bac感受态细胞,通过蓝白斑筛选试验成功获得含重组质粒细胞,PCR鉴定结果为阳性质粒(图2-B)。

2.3 重组杆状病毒的制备及表达蛋白的纯化与鉴定结果
提取重组质粒并计算浓度后,转染单层Sf9细胞,48 h后显微镜观察细胞,细胞出现明显病变时收获P1病毒并命名为rB-PEDV S,P1病毒经3次噬斑克隆纯化后,感染Sf9细胞,72 h后收集细胞,用Western-blot法检测S重组蛋白的表达(图3),常规S蛋白表达步骤同上。SDS-PAGE胶内酶解蛋白分离结果显示,成功获得重组蛋白(图4),利用MALDI-TOF-TOF分析确认S蛋白及替换信号肽S蛋白表达(表3)。
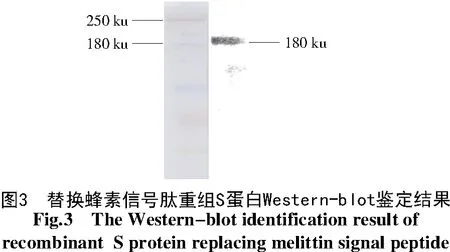
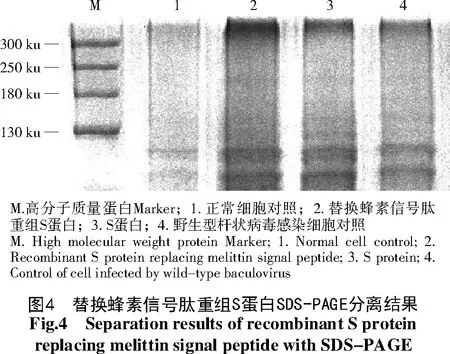
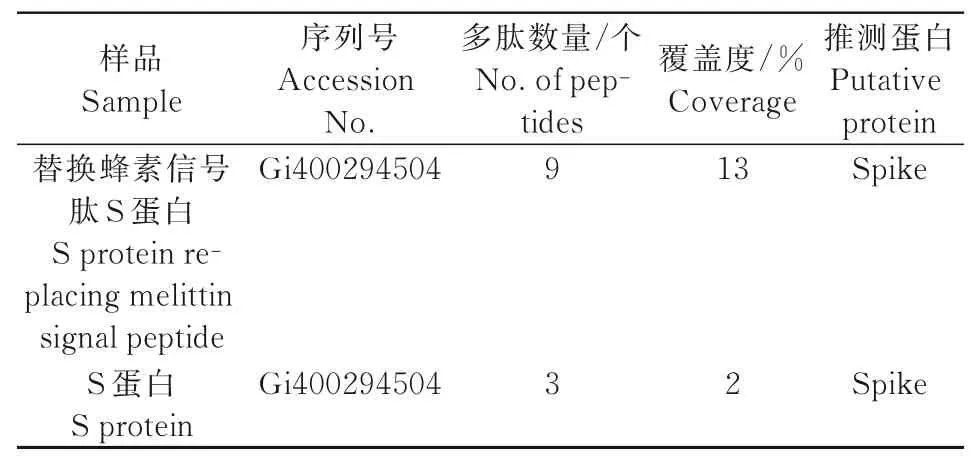
表3 分离蛋白MALDI-TOF-TOF鉴定结果Tab.3 MALDI-TOF-TOF identification results of separated protein
2.4 免疫样品的制备与免疫剂量确定
用PBS稀释BSA,得到0.01、0.02、0.04μg/μL共3个质量浓度定量溶液;利用SDS-PAGE半定量方法绘制BSA标准曲线(由于SDS-PAGE分辨率有限,因此该方法仅可用于替换信号肽S重组蛋白的定量)。将替换信号肽S蛋白PAGE数值代入BSA标准曲线中,可知S质量浓度为0.008 608μg/μL,小鼠每次免疫剂量为0.86μg/只。
2.5 小鼠抗体检测及细胞因子测定结果
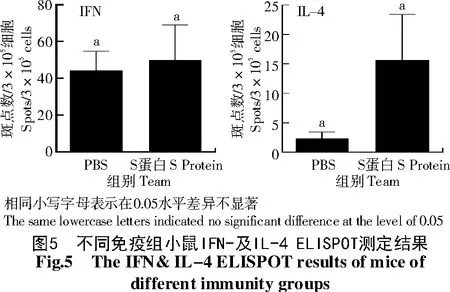
免疫后采集血清测定中和抗体效价,结果显示,替换信号肽S蛋白免疫组与PBS组并无明显差异;2种细胞因子测定结果显示,替换信号肽S蛋白免疫组小鼠IFN水平略高于PBS组,与未浓缩病毒免疫组相似,而免疫S蛋白小鼠IL-4水平则高于PBS免疫组(图5)。
3 结论与讨论
纤突蛋白是冠状病毒主要的抗原蛋白,新型疫苗往往以该蛋白作为目标抗原进行深入研究。PEDV作为冠状病毒家族成员之一,其成功预防同样依赖S蛋白的参与。S蛋白是保持病毒感染性及良好抗原性的关键因素,但由于其占病毒蛋白含量比例较低且易脱落,常导致疫苗质量难以得到很好控制;同时,PEDV培养困难,病毒滴度难以提升更加减少了有效抗原含量。PEDV S蛋白分子质量约为180 ku,巨大的分子质量常常导致其难以表达。本研究在采用昆虫杆状表达系统表达完整S蛋白的基础上,进一步分析利用易被昆虫细胞识别的蜂素信号肽替换原有信号肽,结果表明,替换信号肽后S蛋白表达量上升。
S蛋白具有跨膜区,表达后会锚定在细胞膜上。本研究通过收集感染重组病毒的病变细胞,使用细胞裂解液破碎细胞释放表达蛋白,进一步超声破碎后离心去除细胞碎片,结果显示,蛋白纯度虽有较大提升,但是由于中间步骤过多等原因未达到浓缩蛋白的目的。
利用S蛋白制备疫苗免疫小鼠,结果发现,S蛋白可激发小鼠产生IL-4,其他免疫指标未发现差异,其原因可能主要有2个方面:一方面,蛋白分子量过大导致难以高效表达,导致疫苗免疫剂量不足。杆状病毒表达系统启动子均为极晚期启动子,目的蛋白的表达时间段为细胞病变明显时,此时细胞已呈现病理状态,多种辅助蛋白翻译因子的缺失会影响目的蛋白的表达。有文献报道,真核起始因子4e(eIF4e)与目的蛋白共表达会提升蛋白产量[18]。本研究也尝试在p FastBacDual质粒的p10启动子中连入eIF4e,结果显示,目的蛋白表达量并未提升。此外,有研究提到优化起始密码子周围序列有助于蛋白表达[21],本研究利用重叠PCR将Kozak序列克隆至目的序列的5′端,结果显示,蛋白表达量无明显提升,仅当S信号肽替换为可被昆虫细胞识别的蜂素信号肽时蛋白表达有所提升。另一方面,SARS及IBV等病毒的免疫研究显示,冠状病毒的免疫保护易受多种因素影响。要成功地预防控制就需依赖成熟的病毒粒子,单独的S蛋白可能难以有效激发产生良好的保护[22]。此外,蛋白的纯化过程中残留的杂蛋白也可能会对免疫效果产生影响。
综上所述,本研究聚焦于提高PEDV S蛋白表达量,结果显示,当采用蜂素信号肽替换原有信号肽时,可提升蛋白表达量。小鼠细胞因子测定结果表明,在以0.86μg/只剂量免疫时可有效激发小鼠体内IL-4产生。后续应以杆状病毒系统表达的S蛋白免疫仔猪进行进一步的研究。
