早期肿瘤退缩和肿瘤反应深度对HER-2 阴性晚期胃癌患者疗效与预后的影响*
2022-05-16付卫争阚庆生
付卫争,马 泰,阚庆生
(1. 安徽医科大学附属宿州医院·安徽省宿州市立医院,安徽 宿州 234000; 2. 安徽医科大学第一附属医院,安徽 合肥 230000)
目前,早期胃癌的临床诊断率较高,但多数胃癌诊断时已为晚期或转移性疾病,无法切除,仅能予姑息性治疗[1-2]。临床尚无针对晚期胃癌患者的标准治疗方案,通常以氟尿嘧啶和铂类为基础的联合或不联合第三类药物为常见治疗方案[3]。多西他赛是临床常用紫杉醇类抗肿瘤药物,可促进微管蛋白的稳定聚焦,抑制肿瘤细胞的分裂和再生;阿帕替尼是临床唯一治疗晚期胃癌的靶向药物的口服制剂,临床标准化疗失败后仍能抑制肿瘤组织生成新血管,进而延长生存期,二者联用临床疗效较佳[4-5]。早期肿瘤退缩(ETS)为恶性肿瘤治疗后通过首次影像学评估而获得的肿瘤负荷降低情况,肿瘤反应深度(DpR)是与基线比较病灶退缩的最大百分比,二者能有效反映肿瘤对药物的早期和持续反映情况[6]。既往对人表皮生长因子受体2(HER-2)阳性晚期胃癌患者的研究已较多。参考文献[7],本研究中以HER-2阴性晚期胃癌患者为研究对象,对其疗效及预后相关危险因素进行分析,并探讨了ETS 和DpR 对阿帕替尼联合多西他赛治疗HER - 2 阴性晚期胃癌患者疗效与预后的影响。现报道如下。
1 资料与方法
1.1 一般资料
诊断标准[8]:经免疫组化法诊断,HER - 2 为0(无反应或不超过10%肿瘤细胞膜染色)、1+(≥10%肿瘤细胞隐约可见膜染色,且仅部分细胞膜染色)。
纳入标准:经组织学病理诊断为HER-2阴性晚期胃癌;年龄不低于18 岁;美国东部肿瘤协作组(ECOG)评分为0~1 分;各重要脏器功能正常;初治HER-2 阴性晚期胃癌;预计生存期不少于6个月。
排除标准:存在治疗药物禁忌证;合并其他肿瘤、心脑血管疾病、全身感染、消化系统相关并发症;复治或复发;合并免疫缺陷;妊娠期或哺乳期;中途转院或资料不完整;严重基础疾病。
病例选择:选取安徽省宿州市立医院肿瘤内科2018年1月至2020年1月收治的HER - 2 阴性晚期胃癌患者82 例。其中,男71 例,女11 例;年龄38~76 岁,平均(59.15±5.06)岁。本研究已通过医院医学伦理委员会批准(批件号为2019068)。
1.2 方法
采用电话、门诊等方式随访,随访时间截至2021年2月。回顾性分析的患者临床资料,按生存状况分为进展生存组(A 组,31 例)、无进展生存组(B 组,35 例)、死亡组(C 组,16 例)。收集3 组患者的人口学特征和临床资料。其中,人口学特征包括年龄、性别、种族、婚姻状况、职业、文化程度、家庭月收入、医疗负担形式、吸烟史、饮酒史、外科手术史、家族史、糖尿病、高血压;临床资料包括病理类型、TNM 分期、Yoshida 分型、原发肿瘤部位、转移脏器数、转移部位、肿瘤直径、分化程度、术前白蛋白、术前血红蛋白、阳性淋巴结比率(LNR)、术中出血量、淋巴结清扫个数、术中补液量、手术方式、联合脏器切除、肿瘤切除程度、止痛剂使用次数、术后血钾平均值、术后首次下床时间、并发症、ECOG 评分、CEA、CA199、疗效、ETS、DpR、化疗时长、中性粒细胞减少分级、KPS 评分。采用Logistic 多因素回归分析HER-2 阴性晚期胃癌患者疗效与预后的相关因素,采用Pearson相关性分析ETS 和DpR 与各危险因素的相关性,采用受试者工作特征曲线(ROC)评估ETS 和DpR 对阿帕替尼联合多西他赛治疗HER - 2 阴性晚期胃癌患者疗效与预后的预测价值。所有患者均予阿帕替尼联合多西他赛治疗,早餐后0.5 h 口服甲磺酸阿帕替尼片[江苏恒瑞医药股份有限公司,国药准字H20140103,规格为每片按阿帕替尼(C24N23N5O)计0.25 g]500 mg/d,每日1 次;静脉滴注多西他赛注射液(江苏恒瑞医药股份有限公司,国药准字H20020543,规格为每支0.5 mL∶20 mg)75 mg/m2,每日1 次,60 min 内注射完成。每3 周为1个治疗周期。
1.3 统计学处理
采用SPSS 22.0 统计学软件分析。计量资料以±s表示,行t检验,多组间比行F检验;计数资料以率(%)表示,行χ2检验;采用Logistic 多因素回归分析、Pearson相关性分析、ROC 曲线分析进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 人口学特征
C 组患者年龄不低于60 岁、饮酒史、家族史的占比均显著高于A组和B组,且A组显著高于B组(P<0.05)。详见表1。
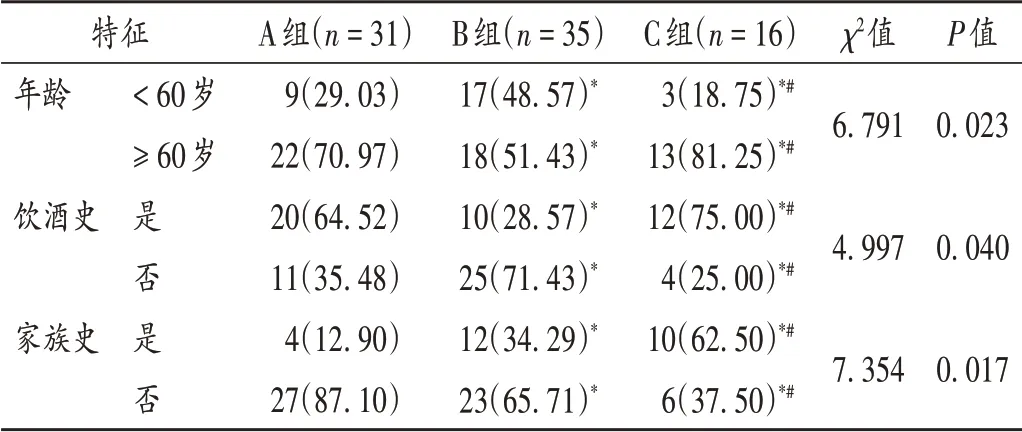
表1 3组患者人口学特征比较[例(%)]Tab.1 Comparison of patients′ demographic characteristics among the three groups[case(%)]
2.2 临床资料
C 组患者TNM Ⅳ期、胃体部和胃幽门部肿瘤、肿瘤直径>3.5 cm、LNR <0.16%、合并并发症、ECOG 评分为1 分、疗效为疾病进展、ETS <15%、DpR 缩小<15%、化疗时长≤12 周、中性粒细胞减少分级为G0(中性粒细胞<1.5×109/L)的占比均显著高于A 组和B 组,且B 组显著高于A 组。与A 组和B 组比较,C 组的术中出血量较多、术后血钾平均值较低、术后首次下床时间较长,差异有统计学意义(P<0.05);与B 组比较,A 组的术中出血量较多、术后血钾平均值较低、术后首次下床时间较长,差异有统计学意义(P<0.05)。详见表2。

表2 3组患者临床资料比较Tab.2 Comparison of patients′ clinical data among the three groups
2.3 疗效与预后相关因素的Logistic 多因素回归分析
年龄≥60 岁、TNM Ⅳ期、胃体部和胃幽门部肿瘤、肿瘤直径>3.5 cm、LNR <0.16%、ETS <15%、DpR 缩小<15%、化疗时长≤12周为HER-2阴性晚期胃癌患者疗效与预后不良的危险因素(P<0.05)。详见表3。

表3 HER-2阴性晚期胃癌患者疗效与预后相关因素的Logistic多因素回归分析Tab.3 Logistic multivariate analysis of related factors of efficacy and prognosis in patients with HER-2 negative advanced gastric cancer
2.4 ETS 与各危险因素的Pearson 相关性分析
ETS 与年龄≥60岁、TNM Ⅳ期、胃体部和胃幽门部肿瘤、肿瘤直径>3.5 cm、LNR <0.16%均呈显著负相关(P<0.05),与DpR缩小<15%和化疗时长≤12周呈显著正相关(P<0.05)。详见表4。

表4 ETS与各危险因素的Pearson相关性分析Tab.4 Pearson correlation analysis of ETS and various risk factors
2.5 DpR 缩小与各危险因素的Pearson 相关性分析
DpR缩小与年龄≥60岁、TNM Ⅳ期、胃体部和胃幽门部肿瘤、肿瘤直径>3.5 cm均呈显著负相关(P<0.05),与ETS <15% 和化疗时长≤12 周呈显著正相关(P<0.05)。详见表5。
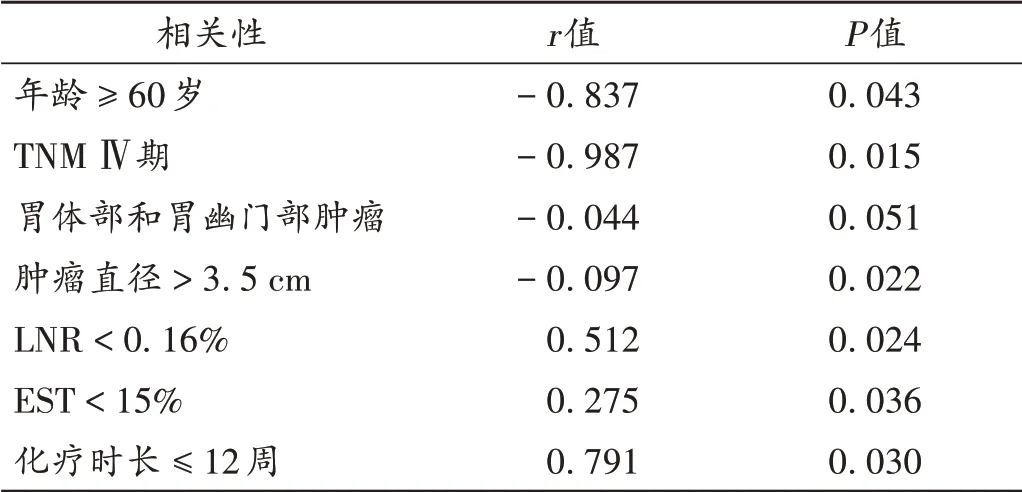
表5 DpR缩小与各危险因素的Pearson相关性分析Tab.5 Pearson correlation analysis of DpR reduction and various risk factors
2.6 ETS 和DpR 对阿帕替尼联合多西他赛治疗HER-2 阴性晚期胃癌患者疗效与预后的预测价值
ROC 曲线分析显示,预测阿帕替尼联合多西他赛治疗HER - 2 阴性晚期胃癌患者疗效与预后中,灵敏度、特异性和ROC 曲线下与坐标轴围成的面积(AUC)分别为90.74%,87.03%,0.83,DpR 的灵敏度、特异性和AUC分别为96.29%,94.44%,0.87;ETS+ DpR 的灵敏度、特异性和AUC分别为98.14%,96.29%,0.93。ETS+DpR 的灵敏度、特异性和AUC均优于单用ETS 或DpR。详见图1。
3 讨论
与最佳支持治疗相比,化疗能将晚期胃癌患者的中位生存期由2~4 个月延长至1年左右[9-10],还可明显改善其生活质量。同时,部分HER- 2 阳性患者还可通过抗HER-2治疗获益,但多数患者仍需化疗改善生存状况[11]。本研究中对HER - 2 阴性晚期胃癌患者的疗效及预后的影响因素进行了分析,并分析了其对阿帕替尼联合多西他赛治疗效果及预后的影响。
多西他赛是临床常用紫杉醇类抗肿瘤药物,可与微管蛋白亚单位相结合,促进其稳定、聚焦,达到抑制微管解聚、肿瘤细胞分裂和再生的目的。患者在使用中可能出现消化道反应、骨髓抑制、肝肾功能异常等不良反应,多数患者耐受性较佳[12]。阿帕替尼为临床常用酪氨酸激酶抑制剂,是胃癌靶向药物,能有效抑制肿瘤血管生成,使用中可能出现腹泻、血压升高、手足综合征、蛋白尿、骨髓抑制等不良反应,但患者总体耐受性较佳,可有效控制病情进展,延长生存期[13]。既往已有较多关于阿帕替尼联合多西他赛治疗恶性肿瘤的研究,且结果均显示两者联用具有较佳的临床疗效[14]。本研究结果显示,年龄≥60 岁、TNM Ⅳ期、胃体部和胃幽门部肿瘤、肿瘤直径>3.5 cm、LNR <0.16%、ETS <15%、DpR缩小<15%、化疗时长≤12周为HER-2阴性晚期胃癌患者疗效与预后不良的危险因素(P<0.05)。年龄≥60岁患者的机体各项机能相对于青年人群明显衰减,常合并多种基础疾病,同时对化疗所引起的不良反应耐受力较差,部分患者开展化疗后甚至因无法耐受而加重病情,导致生存率降低[15]。TNM Ⅳ期的患者多数存在远处转移,临床治疗后复发率和转移率仍较高,且预后较差[16]。胃体部肿瘤主要来源于胃黏膜上皮的恶性肿瘤,以腺癌为主,是胃恶性肿瘤的多发部位;胃幽门部肿瘤多为隆起溃疡型的低分化腺癌,通常直径超过2 cm,该处病变常与脾胃功能削弱相关,且临床诊断率较低,故确诊时多为晚期,且预后较差[17]。肿瘤直径>3.5 cm 者浸润程度较深,淋巴结转移阳性率升高,升高了临床治疗中的复发率,影响临床疗效和生存状况[18]。LNR 受淋巴结清扫的影响较低,无论在淋巴结转移数量相同还是被检淋巴结数量相同时均有较佳的评估效果[19]。ETS 临床常用于评估肿瘤放疗的疗效,多以分析退缩速度与预后的关系为主。SUZUKI等[20]对567例伊立替康联合5 - 氟尿嘧啶及叶酸方案用于转移性结直肠癌患者的研究发现,首次ETS 变化率超过15%患者的疗效为部分缓解,故ETS 为15%可作为预测和判断疗效与预后的最佳分界点。DpR 为肿瘤退缩的深浅程度,DpR 缩小<15%表明药物对肿瘤的作用效果较弱,影响了预后[21]。化疗时长≤12周的患者也可能因治疗时间短而无法达到最佳的药物作用浓度,无法彻底清除病灶而影响预后。
本研究结果显示,ETS与年龄、TNM分期、胃体部和胃幽门部肿瘤、肿瘤直径、LNR呈负相关,与DpR缩小、化疗时长呈正相关;DpR缩小与年龄、TNM分期、胃体部和胃幽门部肿瘤、肿瘤直径呈负相关,与LNR、ETS、化疗时长呈正相关。且ETS + DpR 的灵敏度、特异性和AUC均优于单用ETS或DpR。进一步证实了ETS和DpR对阿帕替尼联合多西他赛治疗HER - 2 阴性晚期胃癌患者疗效与预后较佳的预测效果。
综上所述,ETS和DpR均为阿帕替尼联合多西他赛治疗HER - 2 阴性晚期胃癌患者疗效与预后的危险因素,且ETS 和DpR 水平与各危险因素均呈相关性,二者单独及联合预测HER- 2 阴性晚期胃癌患者疗效与预后均有较佳的价值。
