人参皂苷Rg1对高原急性缺氧大鼠肺组织损伤的预防作用
2022-05-15查玉杰曹丽睿周金华
查玉杰,曹丽睿,罗 芩,杨 吕,周金华,何 庆
(1.西南交通大学医学院,中国四川 成都 610031;2.西南交通大学附属医院成都市第三人民医院,中国四川 成都 610031)
高原环境空气稀薄,环境中氧含量减少,在高原环境下机体氧分压和血氧饱和度降低,容易造成组织缺氧。当人从低海拔地区急进到高海拔地区(海拔大于2 500 m)时,由于氧气摄入减少,体内的血液和生化指标发生变化,全身组织器官产生一系列生理和病理改变,引起以缺氧为突出表现的急性高原病[1],包括急性高山病(acute mountain sickness,AMS)、高原肺水肿(high-altitude pulmonary edema,HAPE)、高原脑水肿(high-altitude cerebral edema,HACE)等。急进高原时,随海拔上升,呼吸系统首先受到缺氧的影响,肺泡上皮和毛细血管内皮细胞的各种直接和间接损伤引起机体肺损伤,最严重的急性肺损伤形式是呼吸窘迫综合征,这是危重患者致死的主要原因之一[2],也是引起HAPE的直接原因。近年来的研究表明,氧化应激、能量代谢障碍以及炎症反应是高原缺氧初期症状发生的原因之一[3~4],改善氧化应激和能量代谢能有效预防HAPE的发生。
人参皂苷是人参的主要药理活性成分之一,其中人参皂苷Rg1是其关键生物活性成分。人参皂苷Rg1具有多种生物活性作用,如抗炎、抗氧化、抗缺氧、抗衰老、提高免疫力和增强记忆力等[5~6]。最近的研究发现,人参皂苷Rg1能减轻脂多糖诱导的小鼠急性肺损伤,并且能通过提高自噬作用,对脂多糖诱导的肺上皮细胞凋亡发挥保护作用,其与抗生素亚胺培南联合可以治疗小鼠脓毒症急性肺损伤[7~9]。然而,目前对于人参皂苷Rg1预防高原急性缺氧肺损伤的研究尚未见报道。红景天苷是红景天的有效成分,具有抗炎、抗缺氧和抗氧化的功效,常被用作缓解高原反应的药物[10]。
本实验采用低压氧舱模拟海拔6 000 m的高原环境,构建急性缺氧大鼠模型,以红景天苷为阳性对照,通过预给药的方式探究不同剂量的人参皂苷Rg1对急性缺氧肺损伤的预防作用及其相关机制,拟为预防和治疗高原急性缺氧疾病提供新的思路和理论依据。
1 材料和方法
1.1 材料
1.1.1 动物
SD大鼠40只,SPF级,雄性,体重180~220 g,购自成都达硕生物科技有限公司,动物生产许可证号:SCXK(川)2020-030,动物使用许可证号:SYXK(川)2019-189。
1.1.2 仪器
低压低氧舱(成都达硕生物科技有限公司,DSF高原性疾病环境模拟系统),酶标检测仪(美国伯腾仪器有限公司),电子天平(上海梅特勒-托利多仪器有限公司),台式高速冷冻离心机(北京大龙兴创实验仪器股份公司),病理切片机(上海徕卡仪器有限公司),烤箱(天津莱玻瑞仪器设备有限公司)。
1.1.3 试剂
人参皂苷Rg1(纯度≥98%,成都埃法生物科技有限公司),红景天苷(纯度≥98%,成都埃法生物科技有限公司),过氧化氢酶(catalase,CAT)测定试剂盒、丙二醛(malondialdehyde,MDA)测试盒、一氧化氮合酶(nitric oxide synthase,NOS)测试盒、超微量Na+-K+-ATP酶测试盒(南京建成生物工程研究所),白介素-6(interleukin-6,IL-6)检测试剂盒、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)检测试剂盒(武汉优尔生科技股份有限公司)。
1.2 方法
1.2.1 分组
将40只雄性SD大鼠随机分为5组:正常组(Normal组)、模型组(Model组)、阳性对照组(红景天苷,Sal组)、低剂量组(人参皂苷 Rg1,Rg1-L组)、高剂量组(人参皂苷Rg1,Rg1-H组),每组8只。
1.2.2 动物处理
40只大鼠先适应性饲养3 d,然后在常压常氧条件下饲养7 d,每日称重,并灌胃给药。正常组和模型组按照10 mL/kg剂量灌胃生理盐水;根据参考文献[11]和[12],阳性对照组按25 mg/kg剂量灌胃红景天苷,低剂量组和高剂量组分别按照25 mg/kg和50 mg/kg剂量灌胃人参皂苷Rg1,每组均连续灌胃给药8 d。第8天正常组仍在常压常氧下饲养,其余4组在给药1 h后放入低压低氧舱内饲养24 h,在此期间动物正常进食水。动物进舱后以10 m/s速度减压上升,10 min达到海拔6 000 m,氧含量9.8%,之后维持氧含量在9.7%~9.9%,舱内大气压维持在46.57~49.02 kPa,湿度维持在49%~55%。饲养结束后,取出每组大鼠,解剖完一组再取下一组。取出大鼠后先称重,然后腹腔注射戊巴比妥钠麻醉,打开胸腔,取肺组织。其中,左肺上叶称重后用锡箔纸包裹烘干,用于测肺湿干比(W/D);左肺下叶投入4%多聚甲醛中固定,经石蜡包埋、切片、染色后,检测其病理变化;右侧所有肺叶放入-80℃冰箱保存备用。
1.2.3 肺湿干比测定
取出左肺上叶后用滤纸吸干组织表面水分,置于锡箔纸上称重,记为湿重,然后包裹好,放入80℃烤箱内烘烤72 h,称取每个左肺上叶组织质量,记为干重。湿干比=(湿重-干重)/干重×100%。
1.2.4 肺组织病理切片观察
左肺下叶用4%多聚甲醛固定24 h后,经脱水包埋制成蜡块,然后切片,进行常规HE染色。用切片扫描仪扫描切片,用浏览软件在不同的倍数下观察肺组织病理变化,并拍照记录。
1.2.5 肺组织氧化应激和能量代谢相关指标检测
根据各试剂盒说明书操作步骤,分别检测各组大鼠右肺上叶组织匀浆中MDA、CAT、NOS水平和Na+-K+-ATP酶活力。
1.2.6 肺组织炎症因子检测
根据ELISA试剂盒说明书操作步骤,分别检测各组大鼠右肺下叶组织匀浆中IL-6、TNF-α水平。
1.2.7 统计学分析
采用GraphPad软件进行数据处理和制图,结果以平均值±标准差(±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织湿干比
为了检测肺组织含水量的变化,我们对各组大鼠肺组织的湿干比(W/D)进行了检测。结果显示:与正常组相比,模型组肺湿干比明显增大(P<0.01),出现肺水肿;与模型组相比,阳性对照组(P<0.01)、低剂量组(P<0.01)和高剂量组(P<0.01)的肺组织湿干比均明显减小(表1,图1),说明红景天苷和人参皂苷Rg1对肺水肿具有一定的预防作用。

表1 大鼠肺组织湿干比Table 1 W/D ratio of lung tissues in rats

图1 大鼠肺组织湿干比(n=8)Normal:正常组;Model:模型组;Sal:阳性对照组 (红景天苷);Rg1-L:人参皂苷Rg1低剂量组;Rg1-H:人参皂苷Rg1高剂量组。**P<0.01 vs.正常组;##P<0.01 vs.模型组。Fig.1 W/D ratio of lung tissues in rats(n=8)Normal:Normal group;Model:Model group;Sal:Positive control group(salidroside);Rg1-L:Ginsenoside Rg1 low-dose group;Rg1-H:Ginsenoside Rg1 high-dose group.**P<0.01 vs.normal group;##P<0.01 vs.model group.
2.2 肺组织病理变化
肺组织HE染色结果显示:正常组肺组织结构清晰完整,无明显的病理改变;模型组大鼠肺组织呈现出明显的病理改变,大量的炎性细胞浸润,肺泡壁明显增厚、断裂,有红细胞渗出;对比模型组,阳性对照组和人参皂苷Rg1处理组出现的病理改变明显减轻,其中肺组织结构比较清晰,炎性细胞浸润减少,肺泡壁也无明显的增厚,接近于正常组的肺组织形态(图2)。

图2 大鼠肺组织HE染色(×400,n=3)Normal:正常组;Model:模型组;Sal:阳性对照组(红景天苷);Rg1-L:人参皂苷Rg1低剂量组;Rg1-H:人参皂苷Rg1高剂量组。Fig.2 HE staining of lung tissues in rats(×400,n=3)Normal:Normal group;Model:Model group;Sal:Positive control group (salidroside);Rg1-L:Ginsenoside Rg1 low-dose group;Rg1-H:Ginsenoside Rg1 high-dose group.
2.3 肺组织氧化应激指标水平
氧化应激生化指标检测结果显示:与正常组相比,模型组大鼠肺组织CAT活力明显下降(P<0.01),MDA含量和NOS活力明显上升(P<0.01);与模型组相比,经红景天苷和人参皂苷Rg1预处理的3组大鼠CAT活力明显升高(P<0.05),MDA含量显著降低(P<0.01),NOS活力也明显下降(P<0.05)(表2,图3)。
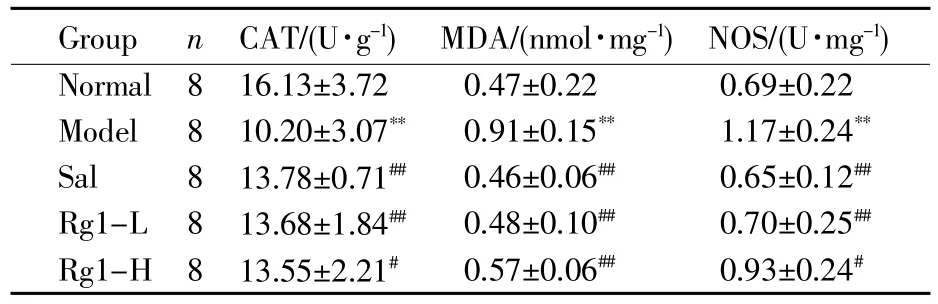
表2 大鼠肺组织氧化应激生化指标水平Table 2 Levels of oxidative stress in rat lungs

图3 大鼠肺组织氧化应激生化水平(n=8)Normal:正常组;Model:模型组;Sal:阳性对照组(红景天苷);Rg1-L:人参皂苷Rg1低剂量组;Rg1-H:人参皂苷Rg1高剂量组。**P<0.01 vs.正常组;#P<0.05,##P<0.01 vs.模型组。Fig.3 Oxidative stress levels of lung tissues in rats(n=8)Normal:Normal group;Model:Model group;Sal:Positive control group(salidroside);Rg1-L:Ginsenoside Rg1 low-dose group;Rg1-H:Ginsenoside Rg1 high-dose group.**P<0.01 vs.normal group;#P<0.05,##P<0.01 vs.model group.
2.4 肺组织能量代谢指标水平
能量代谢生化指标检测结果显示:低压低氧模型组大鼠肺组织Na+-K+-ATP酶活力明显低于正常组大鼠(P<0.01),人参皂苷Rg1低剂量组和高剂量组的Na+-K+-ATP酶活力明显高于模型组(P<0.05),阳性对照组与模型组相比差异没有统计学意义(表3,图4)。

表3 大鼠肺组织Na+-K+-ATP酶水平Table 3 Levels of Na+-K+-ATPase in lung tissues of rats

图4 大鼠肺组织Na+-K+-ATP酶水平(n=8)Normal:正常组;Model:模型组;Sal:阳性对照组(红景天苷);Rg1-L:人参皂苷Rg1低剂量组;Rg1-H:人参皂苷Rg1高剂量组。**P<0.01 vs.正常组;#P<0.05,##P<0.01 vs.模型组。Fig.4 Levels of Na+-K+-ATPase in lung tissues of rats(n=8)Normal:Normal group;Model:Model group;Sal:Positive control group(salidroside);Rg1-L:Ginsenoside Rg1 low-dose group;Rg1-H:Ginsenoside Rg1 high-dose group.**P<0.01 vs.normal group;#P<0.05,##P<0.01 vs.model group.
2.5 肺组织炎症因子水平
肺组织匀浆ELISA实验结果显示:与正常组相比,模型组大鼠肺组织的IL-6、TNF-α水平明显升高(P<0.01);与模型组相比,3组给药大鼠肺组织的IL-6、TNF-α水平均明显下降(P<0.01)(表4,图5),说明红景天苷和人参皂苷Rg1在一定程度上能抑制IL-6和TNF-α的累积。

表4 肺组织炎症因子IL-6、TNF-α水平Table 4 IL-6 and TNF-α levels in lung tissues
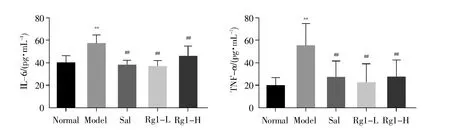
图5 肺组织炎症因子IL-6、TNF-α水平Normal:正常组;Model:模型组;Sal:阳性对照组(红景天苷);Rg1-L:人参皂苷Rg1低剂量组;Rg1-H:人参皂苷Rg1高剂量组。**P<0.01 vs.正常组;##P<0.01 vs.模型组。Fig.5 IL-6 and TNF-α levels in lung tissuesNormal:Normal group;Model:Model group;Sal:Positive control group(salidroside);Rg1-L:Ginsenoside Rg1 low-dose group;Rg1-H:Ginsenoside Rg1 high-dose group.**P<0.01 vs.normal group;##P<0.01 vs.model group.
3 讨论
高原有着极端自然环境,尤其是缺氧。在爬升到海拔2 500~3 000 m以上时,机体会受到严重急性低压缺氧的影响,导致诸如AMS、HAPE和HACE等疾病的发展。缺氧会导致肺泡上皮和毛细血管内皮细胞通透性增加,从而引起机体肺损伤,促进HAPE的发生,因此,为了阻止HAPE的发生,首先就需要防治高原缺氧肺损伤。本实验通过模拟6 000 m高原低压低氧环境,分析各组大鼠肺组织形态特征及氧化应激、能量代谢指标和炎症因子水平,研究了人参皂苷Rg1对高原缺氧肺损伤的预防作用。肺组织湿干比和HE染色结果显示,在本实验构建的高原低压低氧环境下,模型组大鼠的湿干比显著增加,肺组织正常结构被破坏并有大量的炎性细胞浸润,而用不同剂量人参皂苷Rg1连续灌胃8 d的两组大鼠则未出现明显的上述变化,说明人参皂苷Rg1对其有良好的预防作用,与红景天苷组的效果相当。
在急性缺氧条件下,机体的氧化应激会发生显著变化。已有研究表明,缺氧会诱导活性氧形成,从而导致氧化应激和脂质过氧化;MDA是脂质过氧化反应的终产物,会引起蛋白质、核酸等大分子的交联聚合,具有细胞毒性[13]。NOS可诱导NO的生成,而NO过量增多也会导致机体的脂质过氧化,并诱导DNA的损伤[14]。机体在新陈代谢的物质氧化分解过程中会产生H2O2,它是一种活性氧,对机体的破坏性极强,但是正常情况下机体内过量的H2O2可以被CAT清除。本实验的结果表明,在高原急性缺氧条件下,大鼠体内MDA含量和NOS活力明显升高,CAT活力下降,说明大鼠体内抗氧化能力显著下降,使得肺组织遭到破坏。但是,经过预给药的大鼠MDA含量、NOS活力显著下降了,CAT活力也提升了,说明人参皂苷Rg1可以维持机体在高原急性缺氧条件下的氧化还原平衡,这可能与其具有良好的抗氧化活性有关。
此外,在急性缺氧条件下,机体的能量代谢也会发生改变。ATP是机体内主要的能量物质,而Na+-K+-ATP酶是参与主动转运的离子泵的重要成分,在调节细胞内外Na+和K+的平衡、保持细胞膜电位稳定等方面具有重要意义[15]。缺氧会导致肺组织细胞膜上的Na+-K+-ATP酶活力降低,从而诱发肺水肿[16],所以保持Na+-K+-ATP酶活力有助于预防肺水肿的发生。文中结果显示,人参皂苷Rg1能显著提高Na+-K+-ATP酶活力,说明其预防肺水肿的机制可能与其提高Na+-K+-ATP酶活力有关。
引起炎症反应的原因众多,缺氧也是其中之一。研究表明,在急性缺氧的状态下,机体会产生一系列炎症因子,包括IL-6、TNF-α等,诱发全身性的炎症反应,并对肺血管系统产生间接影响[17]。炎症反应会间接导致肺组织通透性增加,使得血管内的大分子物质通过血管内皮细胞和肺上皮细胞,诱发肺水肿。本实验分别检测了5组大鼠肺组织的IL-6、TNF-α水平,结果发现,模型组大鼠肺组织的IL-6、TNF-α水平都明显高于正常组,而预给药的3组大鼠的炎症因子水平与正常组相差不大,说明人参皂苷Rg1的干预可以明显抑制炎症因子的累积,这种抑制作用可能与其抗炎作用相关。
综上所述,人参皂苷Rg1能有效预防急性缺氧肺损伤的发生,这种预防作用可能与其抗氧化应激作用、抑制炎症因子累积以及增强Na+-K+-ATP酶活力相关,但是其具体作用机制还有待进一步的研究。