木犀草素通过抑制URAT1与调节Nrf2/HO-1通路改善尿酸诱导的肾脏损伤
2022-05-15严采馨田锦鸿庞建新
严采馨,田锦鸿,李 璐 ,庞建新,吴 婷
(南方医科大学药学院,中国广东 广州 510515)
尿酸(uric acid,UA)是人体嘌呤代谢的最终产物,其70%通过肾脏排出,因而肾脏被认为是循环尿酸的重要调节器[1]。持续的尿酸水平升高容易引发肾小管损伤、间质纤维化、肾小球硬化和尿酸盐结晶沉积,最终导致高尿酸性肾病[2~3],严重影响疾病预后和患者的生活质量。
尿酸性肾病的治疗关键在于控制高尿酸血症与保护肾功能[4]。目前,临床上用于治疗尿酸性肾病的药物主要包括:尿酸合成抑制剂(如别嘌呤醇)与促进尿酸排泄的药物(如苯溴马隆)[5]。上述药物虽能明显降低血尿酸水平,但别嘌呤醇易引起过敏反应,苯溴马隆易引起肾脏病变,因此,研发既能降尿酸又具有肾脏保护作用的药物对防治尿酸性肾病显得尤为迫切[6]。
尿酸转运体1(uric acid transporter 1,URAT1)主要表达在肾脏,是维持尿酸稳态的关键蛋白质[7~8]。目前,几乎所有的促尿酸排泄药都集中在URAT1靶点,包括苯溴马隆,它们通过将多余的尿酸从血液中转运至肾小管上皮细胞内,达到降低血尿酸水平的作用。
核因子E2-相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是机体内普遍存在的一种核转录因子。研究显示,Nrf2可诱导抗氧化酶转录与表达,从而对机体的氧化应激反应起到重要的调控作用[9~10]。血红素加氧酶-1(heme oxygenase-1,HO-1)是Nrf2的下游基因,氧化应激状态下Nrf2被激活入核,启动HO-1转录表达,从而降解血红素、一氧化氮等,抑制氧化应激损伤[11~12]。
近年来,中草药在治疗尿酸性肾病过程中已取得较好疗效,且中草药具有副作用小、增效减毒的优势[13]。木犀草素(3,4,5,7-四羟基黄酮)是一种天然黄酮类物质,存在于多种植物性食物和中草药中[14]。有研究表明,其具有抗氧化应激[15]、抗炎[16]、降尿酸[5,17]等作用。针对其降尿酸的研究发现,木犀草素在体内外均可通过抑制黄嘌呤氧化酶减少尿酸合成[17],在体内可通过上调ATP结合盒转运蛋白2(ATP binding cassette subfamily G member 2,ABCG2)促进尿酸排泄[5],从而使肾脏免受高尿酸诱导的损伤。然而,木犀草素对URAT1的活性及表达的影响,以及其对高尿酸诱导的肾脏纤维化的影响,目前尚无研究报道。本文旨在探索木犀草素对URAT1的作用及其在高尿酸诱导的肾脏纤维化模型中的作用,为进一步阐明木犀草素降尿酸及其肾脏保护作用的机制提供实验基础。
1 材料与方法
1.1 药物与试剂
木犀草素(纯度≥98%)购自成都曼斯特生物科技有限公司。氧嗪酸钾(potassium oxazine,PO)、腺嘌呤(adenine,Ad)购自阿拉丁试剂(上海)有限公司。肌酐(creatinine,CR)、血尿素氮(blood urea nitrogen,BUN)、丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(superoxide dismutase,SOD)和总谷胱甘肽(glutathione,GSH)测定试剂盒购自南京建成生物工程研究所。尿酸测定试剂盒购自美国BioAssay Systems公司。四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]购自北京索莱宝有限公司。兔源URAT1一抗购自美国Abcam公司。GAPDH抗体、兔源二抗购自美国Cell Signaling Technology公司。
1.2 细胞培养
小鼠肾小管上皮细胞(mRTEC)与HEK293T细胞由本实验室保存,分别用含10%胎牛血清的DMEM-F12、DMEM 培养液培养于 5% CO2、37 ℃的恒温箱中,待细胞生长至80%~90%融合度,进行细胞传代。
1.3 细胞转染与14C尿酸摄取实验
当HEK293T细胞达到70%~80%融合度时,使用Lipofectamine 3000试剂(Invitrogen公司,美国)转染表达URAT1蛋白的质粒。转染24 h后,将其用于14C尿酸摄取实验。尿酸摄取实验开始前,弃去培养基,然后将细胞与尿酸吸收缓冲液(含有125 mmol/L葡萄糖酸钠、4.8 mmol/L葡萄糖酸钾、1.2 mmol/L磷酸二氢钾、1.2 mmol/L硫酸镁、1.3 mmol/L葡萄糖酸钙和5.6 mmol/L葡萄糖)一起预孵育15 min,细胞开始摄取尿酸。具体的实验步骤参考课题组前期发表的文章[18]。
1.4 细胞活力测定
采用MTT法测定木犀草素对尿酸诱导的细胞损伤的影响。取生长对数期的细胞,以每孔4×103个细胞接种于96孔板。评价木犀草素、尿酸单独处理对细胞活力的影响时,木犀草素有0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L 7 个组,尿酸有 0 mg/dL、5 mg/dL、10 mg/dL、15 mg/dL、20 mg/dL 5 个组,每组设6个复孔。评价木犀草素对尿酸导致的细胞损伤的保护作用时,将细胞分为5组:正常对照组(normal control,NC)、高尿酸处理组、低剂量木犀草素(2.5 μmol/L)+尿酸组、高剂量木犀草素(5 μmol/L)+尿酸组、阳性药 lesinurad(10 μmol/L)+尿酸组,每组设6个复孔。培养24 h后,每孔加入5 mg/mL的MTT,37℃孵育4 h后弃去上清液,按每孔150 μL加入二甲基亚砜,低速摇床振荡10 min,用酶标仪在570 nm处检测各孔吸光度值,计算各组细胞存活率。细胞活力=(给药组OD值-对照组OD值)/对照组OD值。
1.5 尿酸性肾病动物模型建立、分组与给药
参考课题组前期已发表文章中的方法[4]并做适当调整。选取24只雄性昆明小鼠(购自南方医科大学实验动物中心,体重20 g±2 g),适应性喂养7 d后,随机分为4组(n=6),分别为溶剂对照组(NC)、尿酸性肾病模型组(HN)、木犀草素低剂量组(10 mg/kg)、木犀草素高剂量组(20 mg/kg)。造模前,木犀草素组小鼠连续5 d腹腔注射木犀草素溶液,其余组小鼠注射等体积溶剂。第6天开始,除溶剂对照组外的小鼠每隔1 d于上午8:30腹腔注射氧嗪酸钾(PO,350 mg/kg)并灌胃腺嘌呤(Ad,70 mg/kg),持续两周,制备尿酸性肾病模型,具体实验分组见表1。每次造模后1 h,于上午9:30给木犀草素处理组小鼠腹腔注射木犀草素。NC组小鼠接受等体积溶剂,即0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)。最后一次给药后,腹腔注射5%水合氯醛麻醉小鼠,采集血清,用于测定血清尿酸、CR、BUN、MDA、SOD和GSH水平。采样结束后,脱颈处死动物并于冰上分离肾脏组织,记录体重和肾脏质量,计算肾脏指数,肾脏指数=肾脏质量(mg)/体重(g)×100。将其中一个肾置于4%多聚甲醛溶液中固定,用于进行H&E染色与Masson染色;另一个肾置于2 mL离心管中,保存于-80℃冰箱,用于测定mRNA与蛋白质表达水平。
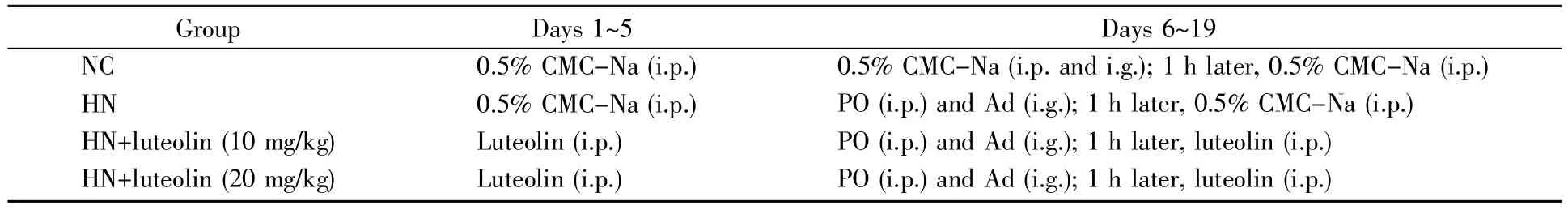
表1 木犀草素缓解尿酸性肾损伤动物实验的分组与给药信息Table 1 The grouping and drug administration for the study of luteolin on the kidney injury induced by uric acid
1.6 生化指标检测
按试剂盒说明书方法检测血清尿酸、CR、BUN、MDA、SOD和GSH水平。
1.7 肾脏H&E染色与Masson染色
将在4%多聚甲醛中固定好的小鼠肾脏组织进行脱水、浸蜡、包埋和切片(4 μm),对切片进行H&E染色与Masson染色[4],观察肾脏病理改变。使用光学显微镜以×200的放大倍数观察染色切片。通过Image-Pro Plus 6.0软件分析每个切片的胶原沉积区域(整个皮质区域的蓝色区域)并评分。
1.8 实时荧光定量PCR
根据RNA提取试剂盒(成都福际生物技术有限公司)操作说明提取肾组织RNA,测定肾脏URAT1、TGF-β、α-SMA、E-cadherin、Nrf2、HO-1 的mRNA表达水平,引物序列见表2。首先,利用PrimeScript RT试剂盒(日本Takara公司)将RNA逆转录为cDNA。然后,按照实时荧光定量PCR(qRTPCR)试剂盒(美国Thermo Fisher Scientific 公司)操作说明测定肾脏mRNA水平。利用2-ΔΔCt法计算目的基因的相对表达量,其中内参基因为β-actin。

表2 qRT-PCR引物序列Table 2 Primer sequences used in quantitative real-time PCR analysis
1.9 Western-blot
提取肾组织蛋白质,检测肾脏URAT1、Nrf2和HO-1的蛋白质表达水平。具体方法如下:用BCA法测定蛋白质浓度,每组加入5×上样缓冲液煮10 min。蛋白质上样,进行凝胶电泳。转膜,5%脱脂奶粉封闭2 h;孵育URAT1一抗(1∶1 000)和GAPDH一抗(1∶5 000)过夜,TBST洗膜3次,每次10 min;二抗(1∶5 000)孵育1 h,TBST洗膜6次,每次5 min;用ECL显色液曝光,扫描后使用Image J软件分析条带灰度值。
1.10 统计学方法
2 结果
2.1 木犀草素体外抑制URAT1转运尿酸
结果如图1所示,木犀草素剂量依赖性地抑制URAT1的尿酸转运活性,IC50值为 23.42 μmol/L,与阳性药lesinurad活性相当(IC50为19.12 μmol/L)。
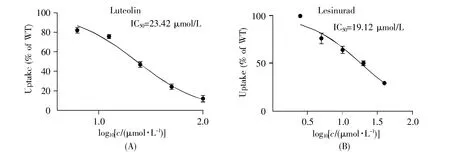
图1 木犀草素与lesinurad剂量依赖性地抑制URAT1转运14C尿酸(A)木犀草素对URAT1的剂量依赖性抑制作用;(B)Lesinurad对URAT1的剂量依赖性抑制作用。Fig.1 Effects of luteolin and lesinurad on URAT1-meidated14C-urate transport(A)Dose-dependent inhibitory effect of luteolin on URAT1;(B)Dose-dependent inhibitory effect of lesinurad on URAT1.
2.2 木犀草素改善高尿酸诱导的细胞活力减低
从图2A~B的结果可知,木犀草素在低于10 μmol/L时并不会引起mRTEC细胞活力降低,故后续选择2.5μmol/L和5 μmol/L两个浓度进行实验;随着尿酸浓度的增加,细胞活力逐渐减低,考虑到20 mg/dL尿酸引起的细胞损伤过于严重,而10 mg/dL尿酸引起的细胞损伤程度较15 mg/dL轻,故后续选择15 mg/dL尿酸进行实验。图2C的结果显示,与单独使用尿酸处理组的细胞相比,2.5 μmol/L和5 μmol/L木犀草素有效地改善了由高尿酸诱发的细胞活力降低,且其保护作用略优于阳性药物lesinurad(10 μmol/L)。

图2 木犀草素对高尿酸诱导的细胞活力减低的影响(A)木犀草素单独处理对mRTEC细胞活力的影响;(B)尿酸单独处理对mRTEC细胞活力的影响;(C)木犀草素与lesinurad对尿酸诱导细胞损伤的保护作用。###:P<0.001 vs.NC组;图A与图B中,*:P<0.05,**:P<0.01,***:P<0.001 vs.未加药处理组;图C中,***:P<0.001 vs.UA组。Fig.2 Effect of luteolin on decreased viability of mRTEC cells induced by high UA levels(A)Viability of mRTEC cells treated with luteolin;(B)Viability of mRTEC cells treated with UA;(C)Protective effects of luteolin and lesinurad on UA-induced mRTEC cell injury.###:P<0.001 vs.the NC group;*:P<0.05,**:P<0.01,***:P<0.001 vs.the group without drug treatment in Figs.2A and 2B;***:P<0.001 vs.the UA-treated group in Fig.2C.
2.3 木犀草素降低模型小鼠血清尿酸、CR与BUN水平
图3结果显示,与NC组小鼠相比,HN组小鼠血清尿酸、CR、BUN水平明显升高,而高、低剂量木犀草素能显著下调上述异常指标。H&E染色结果也明确显示,木犀草素能明显改善高尿酸引起的肾小管扩张和炎性细胞浸润(图4A)。
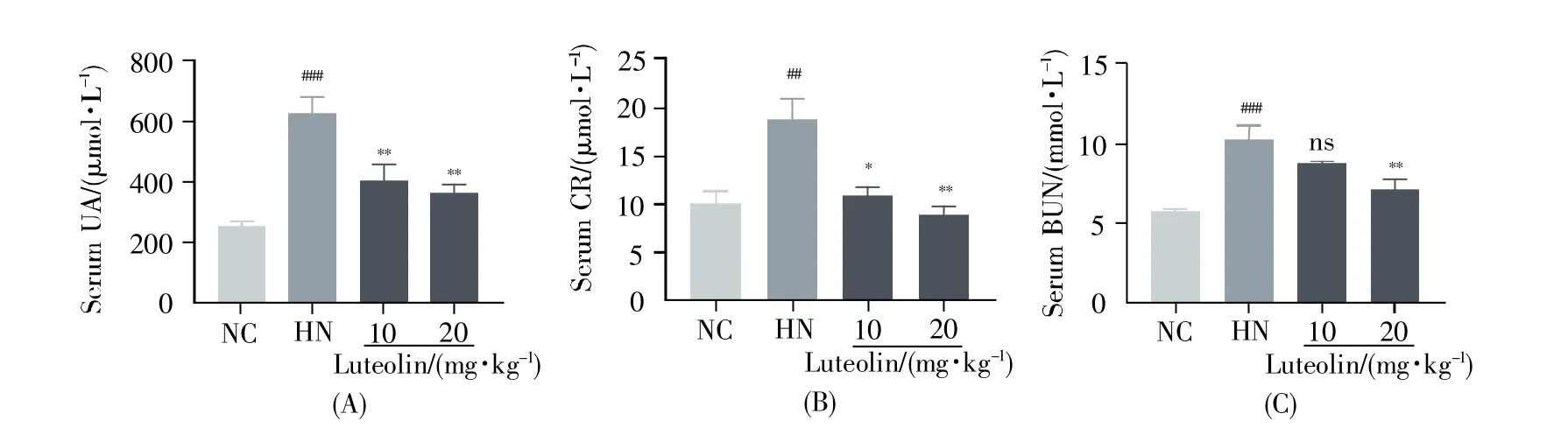
图3 木犀草素对HN小鼠血清尿酸、CR与BUN水平的影响(A)血清尿酸水平;(B)血清肌酐水平;(C)血清尿素氮水平。##:P<0.01,###:P<0.001 vs.NC组;*:P<0.05,**:P<0.01 vs.HN组;ns表示与HN组相比没有统计学差异。Fig.3 Effects of luteolin on serum UA,CR and BUN levels in mice with HN(A)Serum UA level;(B)Serum CR level;(C)Serum BUN level.##:P<0.01,###:P<0.001 vs.the NC group;*:P<0.05,**:P<0.01 vs.the HN group;ns represents no statistical difference compared with the model group.
2.4 木犀草素改善尿酸性肾病模型小鼠肾脏纤维化
从图4可知,HN组小鼠肾脏出现明显的肾间质纤维化(图4B),其纤维化评分较NC组具有显著性差异(图4C,P<0.001);与HN组小鼠相比,木犀草素处理组肾脏肾间质纤维化水平显著降低(图4C,P<0.001)。我们还检测了肾脏中纤维化因子TGF-β、α-SMA和E-cadherin的mRNA表达水平。结果如图4D~F所示,木犀草素可逆转高尿酸诱导的TGF-β和α-SMA上调与E-cadherin下调。上述结果提示,木犀草素可能是防治尿酸性肾病过程中肾纤维化的有效候选化合物。
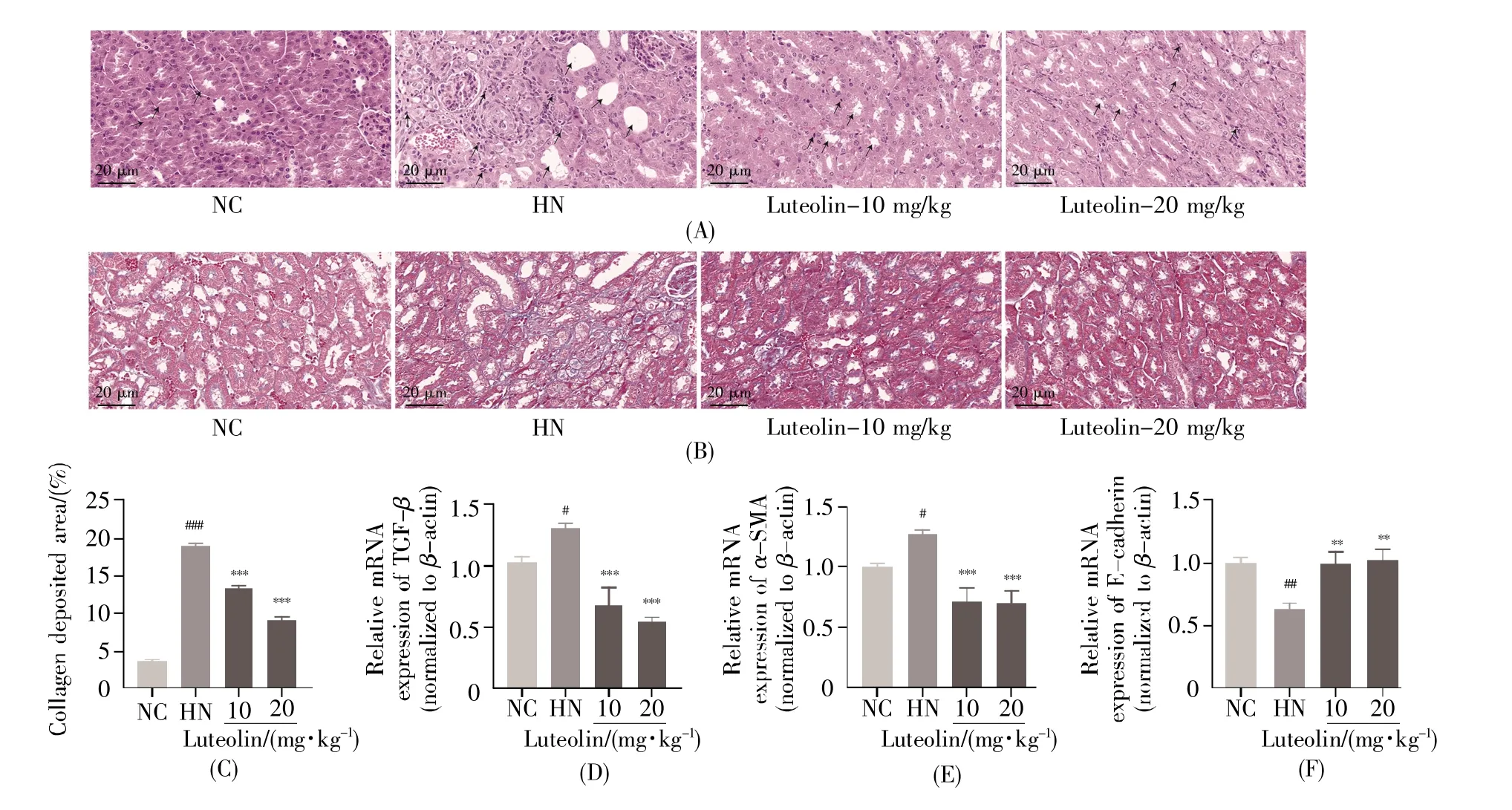
图4 木犀草素对HN小鼠肾脏病理变化与纤维化的影响(A)各组肾脏H&E染色结果,黑色箭头表示肾小管扩张、炎性细胞浸润;(B)各组肾脏Masson染色结果;(C)纤维化评分;(D)肾脏TGF-β基因的相对表达水平;(E)肾脏α-SMA基因mRNA的相对表达水平;(F)肾脏E-cadherin基因的相对表达水平。#:P<0.05,##:P<0.01,###:P<0.001 vs.NC 组;**:P<0.01,***:P<0.001 vs.HN 组。Fig.4 Effects of luteolin on histopathologic changes and renal fibrosis in mice with HN(A)Representative images of H&E staining of kidney tissue in HN mice treated with luteolin.The black arrows indicate renal tubules dilation and inflammatory infiltration;(B)Representative images of Masson’s trichrome staining;(C)Collagen deposition area analysis;(D)Relative mRNA expression of renal TGF-β;(E)Relative mRNA expression of α-SMA in kidney;(F)Relative mRNA expression of E-cadherin in kidney.#:P<0.05,##:P<0.01,###:P<0.001 vs.the NC group;**:P<0.01,***:P<0.001 vs.the HN group.
2.5 木犀草素对各组小鼠肾脏URAT1 mRNA与蛋白质水平的影响
图5的结果显示,通过氧嗪酸钾与腺嘌呤诱导尿酸性肾病模型后,HN组小鼠肾脏URAT1 mRNA(图5A,P<0.01)与蛋白质(图5B,P<0.001)表达水平明显升高,而高剂量木犀草素(20 mg/kg)能明显下调其mRNA(P<0.05)与蛋白质(P<0.001)表达水平,使其趋于正常水平。
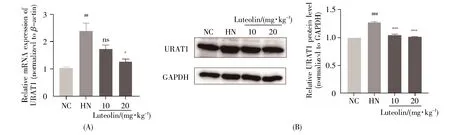
图5 木犀草素对HN小鼠肾脏URAT1 mRNA与蛋白质表达水平的影响(A)各组肾脏URAT1基因表达水平;(B)各组肾脏URAT1蛋白表达水平以及蛋白质定量结果。##:P<0.01,###:P<0.001 vs.NC组;*:P<0.05,***:P<0.001 vs.HN组;ns表示与HN组相比没有统计学差异。Fig.5 Effects of luteolin on the mRNA and protein expression of URAT1 in kidney of mice with HN(A)Relative expression of URAT1 mRNA levels;(B)Relative expression and quantification of URAT1 protein.##:P<0.01,###:P<0.001 vs.the NC group;*:P<0.05,***:P<0.001 vs.the HN group;ns represents no statistical difference compared with the HN group.
2.6 木犀草素对HN小鼠肾脏氧化应激反应的影响
结果如图6所示,相比于NC组小鼠,HN组小鼠肾脏氧化应激水平异常升高,其中MDA含量明显增加(P<0.01),SOD活力(P<0.01)与GSH水平(P<0.001)均显著下降,而木犀草素(20 mg/kg)能显著下调MDA含量(P<0.01),增加SOD活性(P<0.01)与 GSH 水平(P<0.01)。

图6 木犀草素对HN小鼠肾脏MDA、SOD和GSH水平的影响(A)各组肾脏MDA含量;(B)各组肾脏SOD活性;(C)各组肾脏总GSH含量。##:P<0.01,###:P<0.001 vs.NC组;*:P<0.05,**:P<0.01 vs.HN 组。Fig.6 Effects of luteolin on MDA,SOD and GSH in mice with HN(A)The levels of MDA in kidney;(B)The SOD activities in kidney;(C)The levels of GSH in kidney.##:P<0.01,###:P<0.001 vs.the NC group;*:P<0.05,**:P<0.01 vs.the HN group.
2.7 木犀草素对HN小鼠肾脏Nrf2/HO-1通路的影响
进一步的机制研究显示,与NC组小鼠相比,HN组小鼠肾脏Nrf2的mRNA(P<0.001)与蛋白质(P<0.001)表达水平均显著下调,同时,肾脏HO-1的mRNA(P<0.05)与蛋白质(P<0.01)表达水平也均显著下调;与HN组相比,木犀草素(10 mg/kg)组小鼠肾组织中Nrf2的mRNA(P<0.05)与蛋白质(P<0.001)表达水平显著上调,HO-1的mRNA(P<0.001)与蛋白质(P<0.001)表达水平也显著上调,提示木犀草素可能是通过激活Nrf2/HO-1通路降低肾脏氧化应激水平(图7)。
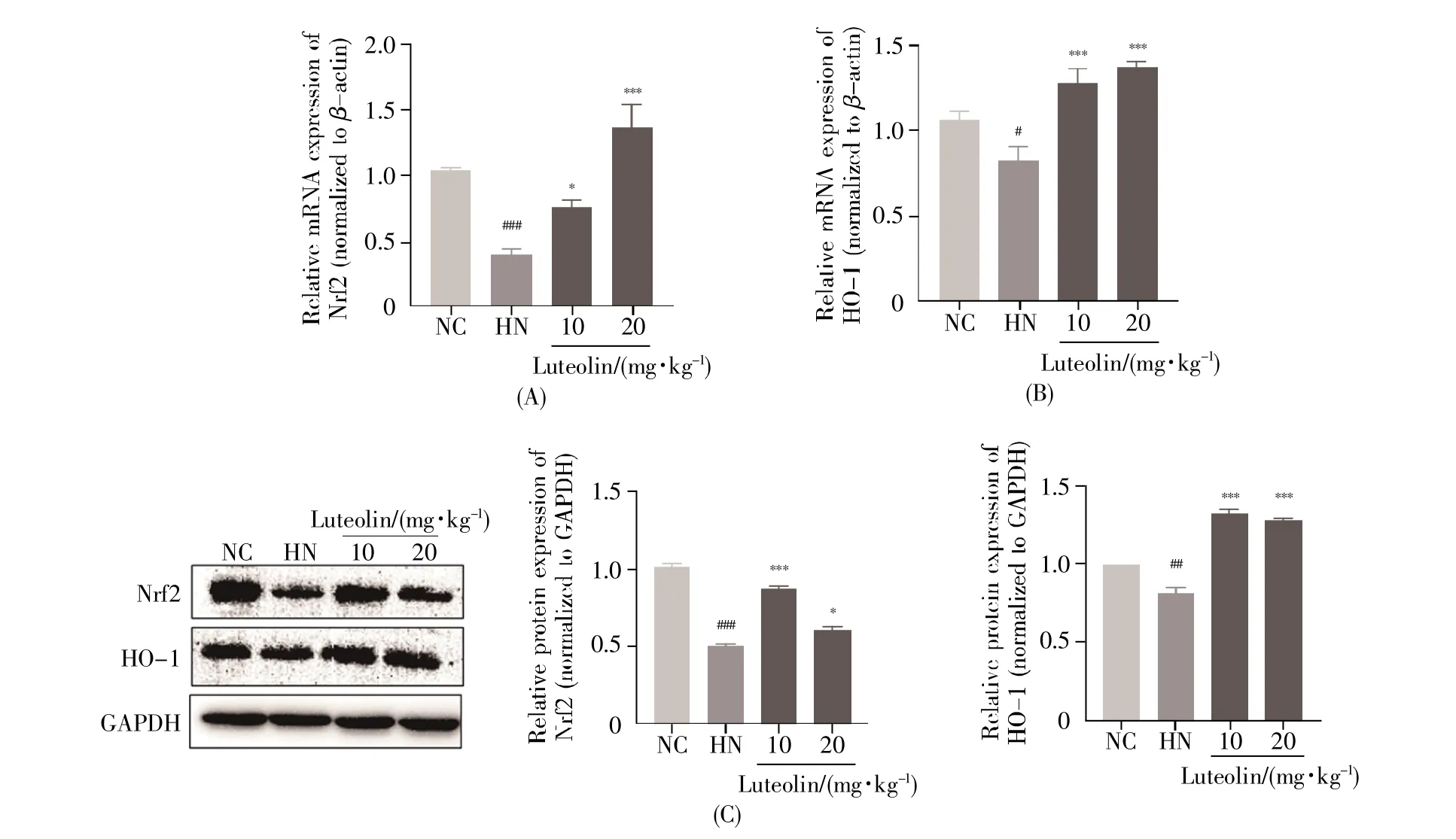
图7 木犀草素对HN小鼠肾脏Nrf2/HO-1通路的影响(A)各组肾脏Nrf2基因的相对表达水平;(B)各组肾脏HO-1基因的相对表达水平;(C)各组肾脏Nrf2、HO-1蛋白表达水平以及蛋白质定量结果。#:P<0.05,##:P<0.01,###:P<0.001 vs.NC组;*:P<0.05,***:P<0.001 vs.HN组。Fig.7 Effects of luteolin on the Nrf2/HO-1 pathway in mice with HN(A)Relative expression of Nrf2 mRNA in kidney;(B)Relative expression of HO-1 mRNA in kidney;(C)The levels of Nrf2 and HO-1 proteins in kidney.#:P<0.05,##:P<0.01,###:P<0.001 vs.the NC group;*:P<0.05,***:P<0.001 vs.the HN group.
3 讨论
本文采用氧嗪酸钾联合腺嘌呤的方法建立尿酸性肾病小鼠模型,造模14 d后可观察到小鼠肾脏出现明显损伤,伴随血清尿酸、CR、BUN异常升高。氧嗪酸钾是一种尿酸酶抑制剂,通过抑制尿酸酶从而抑制尿酸在体内的分解;腺嘌呤可经黄嘌呤氧化酶催化最终转化为尿酸。因此,氧嗪酸钾与腺嘌呤联合使用可迅速增加血清尿酸水平,可以用于建立可靠的尿酸性肾病动物模型[19~20]。
肾脏是尿酸排泄的主要器官,其排泄尿酸的作用主要依赖于多种表达于肾小管上皮细胞的尿酸转运体,如负责尿酸重吸收的URAT1和葡萄糖转运蛋白9(glucose transporter 9,GLUT9)[18,21]。这些尿酸转运蛋白是肾脏调节和保持体内尿酸水平稳定的关键,也是多种降尿酸药物的作用靶点[22]。前期研究虽然已报道了木犀草素的降尿酸作用,但其机制主要与其抑制黄嘌呤氧化酶活性、上调ABCG2表达有关[5,17]。本文首次发现,木犀草素可体外抑制URAT1转运尿酸,降低尿酸水平,并且可下调尿酸性肾病模型小鼠肾脏URAT1的表达水平,发挥降尿酸作用,阐明了木犀草素降尿酸作用的新机制。
尿酸性肾病进展到一定程度后会出现肾间质纤维化[3],TGF-β是纤维化产生的重要介质,在炎症和细胞外基质积累中具有至关重要的作用[23]。本实验通过Masson染色观察肾脏中胶原纤维的数量,发现模型组小鼠肾间质胶原纤维合成明显增加,木犀草素可明显抑制上述变化。此外,qRTPCR结果也表明,木犀草素可抑制纤维化因子TGF-β、α-SMA的mRNA表达,同时上调E-cadherin的mRNA表达,减轻肾脏纤维化,发挥肾脏保护作用。
氧化应激是高尿酸诱导的肾脏损伤的主要机制之一[24]。Nrf2/HO-1通路在机体氧化应激反应中发挥着重要的调控作用[12,25]。本研究结果显示,木犀草素处理19 d能显著降低模型小鼠肾脏组织MDA含量,并显著提高SOD活性与GSH水平,与此同时,Nrf2、HO-1的蛋白质和mRNA表达水平也明显上调,提示木犀草素具有抑制尿酸性肾病小鼠肾组织氧化应激损伤的作用,相关机制可能与激活Nrf2/HO-1通路有关。
综上所述,木犀草素对尿酸性肾病小鼠肾脏损伤具有保护作用,其机制可能与抑制URAT1从而降低体内尿酸水平,抑制肾脏纤维化,激活Nrf2/HO-1通路进而抑制氧化应激反应有关。