金盏花精油的微波辅助提取及其成分与抗氧化活性研究
2022-05-14赵巨堂罗海涛熊文俊邹恩凯
刘 欢,赵巨堂,何 力,罗海涛,熊文俊,邹恩凯,
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西中烟工业有限责任公司,江西南昌 330096)
金盏花(Calendula officinalisL.)是菊科金盏菊属植物,别名金盏菊、盏盏菊等。其在世界各地均有广泛种植,尤其以欧洲及美国为主[1],目前在国内主要分布于四川、安徽、广西、广东等地。金盏花中不仅含有糖类、脂肪、氨基酸等基本营养物质[2],还富含类胡萝卜素、类固醇、三萜皂苷、黄酮等有效成分,具有很强的健胃、收敛、止血和愈伤的功效,此外还有抗炎、抗肿瘤、免疫调节和促进细胞再生等药理作用[3−4]。精油作为金盏花中主要活性组分之一,其优异的抗菌、抗氧化等功效,正受到消费者及研究人员的关注。
水蒸气蒸馏法是提取精油最为常用的方法之一,可以较好地保留原料的香气,且工艺及设备都较为简单,但耗时长,能耗高。近年来微波辅助法以其快速省时、节约能耗的特点在植物精油的提取中广泛应用,并取得了较好效果,微波辐射所产生的热效应和非热效应都可以加速活性物质的溶出,从而使目标产物得率上升,而且不会改变精油的成分组成[5]。很多研究者利用微波辅助水蒸气蒸馏法对许多植物原料的精油进行了提取。杨婷等[6]采用微波辅助水蒸气提取法对香桂叶精油进行了提取,经过优化后得率达到了4.43%,与单一水蒸气提取相比得率上升了0.14%,同时达到了减少耗时、提高效率的目的。李晓娇等[7]利用微波结合水蒸气蒸馏法提取的清香木叶精油得率最高可达到2.09%,对比超声波辅助法(1.78%)和蒸馏萃取法(0.93%)精油得率显著提高。Farhat等[8]利用微波蒸气扩散法提取橙皮精油,与普通蒸馏法相比得到了相似的得率,但是极大缩短了提取时间,而且含有相同数量的挥发性次生代谢物,且产率相近。综上,微波辅助水蒸气蒸馏法是一种绿色、高效的精油提取方法。
目前,关于金盏花精油的研究多集中在化学成分的鉴定和比较,而有关其工艺和抗氧化活性的研究还不充分。本研究在传统水蒸气蒸馏法基础上结合微波辅助,以干燥的金盏花为原料,优化了制备金盏花精油的三项关键工艺参数,并用气相色谱-质谱联用(GC-MS)法对金盏花精油的化学组分及含量进行鉴定分析,检测了其体外抗氧化性。本研究将为金盏花精油的大规模生产提供较为可靠的工艺参数,并为探索其作为天然抗氧化剂的潜力提供理论依据及参考。
1 材料与方法
1.1 材料与仪器
金盏花花瓣 产自内蒙古,亳州市连锐商贸有限公司;无水硫酸钠、水杨酸、30%过氧化氢、过硫酸钾、抗坏血酸、氯化钠、正己烷、无水乙醇、七水合硫酸亚铁(均为分析纯) 西陇科学股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)(均为分析纯) 索莱宝生物科技有限公司。
GZX-9420 MBE鼓风干燥箱 上海博迅实业有限公司;HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;DFY-500中药粉碎机 大德中药机械有限公司;KE-52AA旋转蒸发器、SHZ-III型循环水真空泵 上海亚荣生化仪器厂;Agilent7890-7000A气相色谱-三重串接四极杆质谱联用仪 美国安捷伦科技有限公司;ZNHW型智能恒温电热套 上海锦岐仪器设备有限公司;LE2202E电子天平 梅特勒托利多仪器有限公司;U-T6紫外可见分光光度计 屹谱仪器制造有限公司;BD/BC-218E冰柜 浙江星星冷链集成股份有限公司;WBFY-205型微波化学反应器 上海秋佐科学仪器有限公司;VORTEX 3旋涡振荡器 艾卡(广州)仪器设备有限公司。
1.2 实验方法
1.2.1 金盏花精油的提取 参考段宾宾等[9]的提取方法并做出一些改动:将干燥的金盏花粉碎,过60目筛子,得到金盏花粉末。量取50 g金盏花粉末于5000 mL烧瓶中,加水后经微波加热再进行水蒸气蒸馏,探究提取时间(2、3、4、5、6 h)、NaCl质量浓度(1%、2%、3%、4%、5%)、料液比(1:20、1:30、1:40、1:50、1:60 g/mL)、微波功率(80、240、400、640、800 W)、微波时间(2、4、6、8、10 min)五个因素对精油得率的影响,蒸馏结束后用10 mL正己烷把上层金黄色的金盏花精油萃取出来放入50 mL离心管,然后加入适量无水硫酸钠,再放入−18 ℃的冰箱冷冻8 h,将固体滤除后减压蒸发,即得金盏花精油。
1.2.2 单因素实验
1.2.2.1 提取时间对精油得率的影响 将50 g金盏花粉置于蒸馏烧瓶中,按照1:40 g/mL料液比与水混合再加3%质量浓度的NaCl,经过6 min功率为400 W的微波辐射后蒸馏提取一定时间,后续操作如1.2.1所述,观察了金盏花精油在2、3、4、5、6 h的蒸馏时长下产量的变化。
1.2.2.2 NaCl浓度对精油得率的影响 将50 g金盏花粉置于蒸馏烧瓶中,按照1:40 g/mL料液比与水混合再加一定量的NaCl,经过6 min功率为400 W的微波辐射后蒸馏提取4 h,后续操作如1.2.1所述,观察了金盏花精油在1%、2%、3%、4%、5%质量浓度的NaCl条件下产量的变化。
1.2.2.3 料液比对精油得率的影响 将50 g金盏花粉置于蒸馏烧瓶中,按照一定料液比与水混合再加3%质量浓度NaCl,经过6 min功率为400 W的微波辐射后蒸馏提取4 h,后续操作如1.2.1所述,观察了金盏花精油在1:20、1:30、1:40、1:50、1:60 g/mL料液比条件下产量的变化。
1.2.2.4 微波功率对精油得率的影响 准确称取50 g金盏花粉于蒸馏烧瓶中,按照1:30 g/mL料液比与水混合再加3%质量浓度NaCl,在一定功率下微波辐射6 min后蒸馏提取4 h,后续操作如1.2.1所述,观察了金盏花精油在80、240、400、640、800 W微波功率条件下产量的变化。
1.2.2.5 微波时间对精油得率的影响 准确称取50 g金盏花粉于蒸馏烧瓶中,按照1:30 g/mL料液比加入水以及3%质量浓度NaCl,经过功率为240 W的微波辐射一定时间后蒸馏提取4 h,后续操作如1.2.1所述,观察了金盏花精油在2、4、6、8、10 min微波时间条件下产量的变化。
1.2.3 正交试验 参照单因素实验的结果,以金盏花精油得率为指标,选取三个得率波动较大的因素(NaCl浓度、料液比、微波功率)进行三因素三水平正交试验,其他两项因素水平固定在提取时间4 h,微波时间8 min。试验设计水平安排如表1。
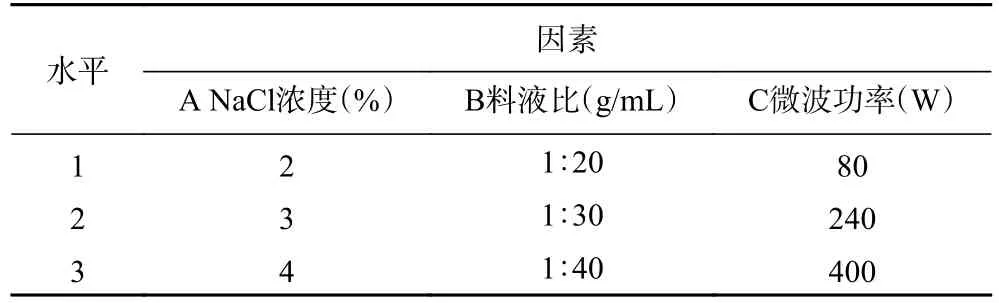
表1 正交试验因素及水平Table 1 Factors and levels of orthogonal test
1.2.4 金盏花精油得率的计算

1.2.5 GC-MS分析金盏花精油成分
1.2.5.1 色谱条件 色谱柱:HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初始温度60 ℃,保持3 min,以5 ℃/min升温至120 ℃,保持3 min,再以4 ℃/min升温至230 ℃,保持5 min。进样口温度250 ℃,载气为氦气,流量:1 mL/min,进样量:1 μL;分流比:30:1。
1.2.5.2 质谱条件 电离方式EI,电离能量:70 eV;离子源温度:230 ℃;四级杆温度150 ℃,溶剂延迟:4 min;扫描离子质量范围:35~550 amu。对照质谱库NIST08结合参考文献进行成分定性,使用面积归一化法计算金盏花精油各组分的相对含量。
1.2.6 金盏花精油对DPPH自由基清除能力测定 参考苏瑾等[10]的方法:将1 mL精油-无水乙醇稀释液用移液枪转移到5 mL离心管中,再移取1 mmol/L的DPPH反应液3 mL,涡旋后在阴暗条件下反应30 min,测得混合液在517 nm下的吸光值A1,无水乙醇代替精油测得A0,无水乙醇代替DPPH反应液测得A2,用无水乙醇作调零,以抗坏血酸作为阳性对照,平行操作重复3次。清除率按下式计算:
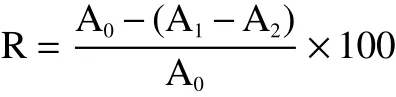
式中:R:清除率,%;A0:空白组吸光值;A1:样品组吸光值;A2:无水乙醇代替DPPH反应液所得吸光值。
1.2.7 金盏花精油对羟自由基清除能力测定 参考范三红等[11]和刑颖等[12]的方法:首先用移液枪移取6 mmol/L的FeSO4溶液、水杨酸-乙醇溶液各1 mL加入到5 mL离心管中,再移取1 mL精油-无水乙醇稀释液,最后加入1 ml 6 mmol/L H2O2于37 ℃水浴30 min,在510 nm下测定吸光度值A1,蒸馏水代替精油测得A0,蒸馏水代替H2O2测得A2,用无水乙醇调零,以抗坏血酸作为阳性对照,平行操作重复3次。清除率按下式计算:
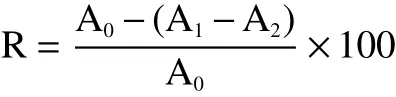
式中:R:清除率,%;A0:空白组吸光值;A1:样品组吸光值;A2:蒸馏水代替H2O2所得吸光值。
1.2.8 ABTS+自由基清除能力测定 参考李娜等[13]的方法:分别用10 mL容量瓶以蒸馏水为溶剂配制好7 mmol/L ABTS溶液与2.5 mmol/L过硫酸钾溶液后在烧杯中混合,避光保存16 h后即为ABTS储备液,然后用无水乙醇将其稀释成734 nm下OD值为0.70±0.02的淡绿色的ABTS工作液。将1 mL精油−无水乙醇稀释液与2 mL上述工作液在5 mL离心管中混合后于阴暗条件下反应30 min,在734 nm处测定吸光值A1,无水乙醇代替精油测得A0,无水乙醇代替ABTS工作液测得A2,用无水乙醇调零,以抗坏血酸为阳性对照,平行操作重复3次。清除率按下式计算:
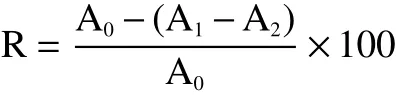
式中:R:清除率,%;A0:空白组吸光值;A1:样品组吸光值;A2:无水乙醇代替ABTS工作液所得吸光值。
1.3 数据处理
利用Excel(版本:2010;微软公司,美国)和SPSS(版本:25.0;IBM公司,美国)进行数据处理和分析,方差分析(ANOVA)采用邓肯多重比较(α=0.05),使用Origin(版本:2018;IBM公司,美国)对实验数据进行作图。所有测定重复三次,结果以平均值±标准差表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取时间对精油得率的影响 不同提取时间对金盏花精油得率的影响如图1所示,可以看出金盏花精油的得率呈现先升高后降低的趋势,在2~4 h时间里精油随着时间的延长不断积累,所以得率呈现上升趋势,反应4 h可得最高得率(0.13%);当反应超过4 h后,金盏花精油不再延续积累的态势,出现略微下降的趋势,这可能是因为金盏花精油长时间在较高的温度下会挥发而造成损失[14],因此最佳提取时间为4 h。
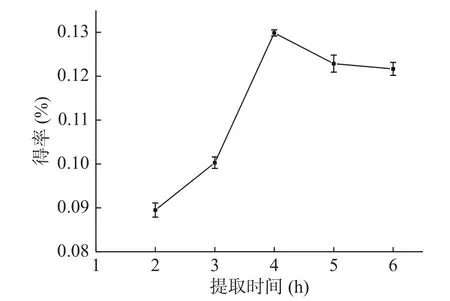
图1 提取时间对金盏花精油得率的影响Fig.1 Effect of extract time on the yield of essential oil from Calendula officinalis L.
2.1.2 NaCl浓度对精油得率的影响 不同NaCl添加量对金盏花精油得率的影响如图2所示,可以看出金盏花精油的收率一开始会随着NaCl添加量的升高而提高,在NaCl浓度升高至为3%时折线图达到顶点,这是因为NaCl作为一种无机盐夹带剂可以使体系中精油溶解度降低,同时一定量的NaCl可以让组织与溶液形成较大的渗透压差,迫使精油溶出而被提取出来[15]。另外经过NaCl溶液的浸泡可以利用其盐析作用使精油更透亮美观。随后继续提高NaCl浓度,精油的收率出现急剧下降的态势,这可能是根据拉乌尔定律,高浓度的NaCl使体系饱和蒸气压降低,难以达到大气压强,导致精油更难蒸出[16]。因此最佳NaCl浓度为3%。
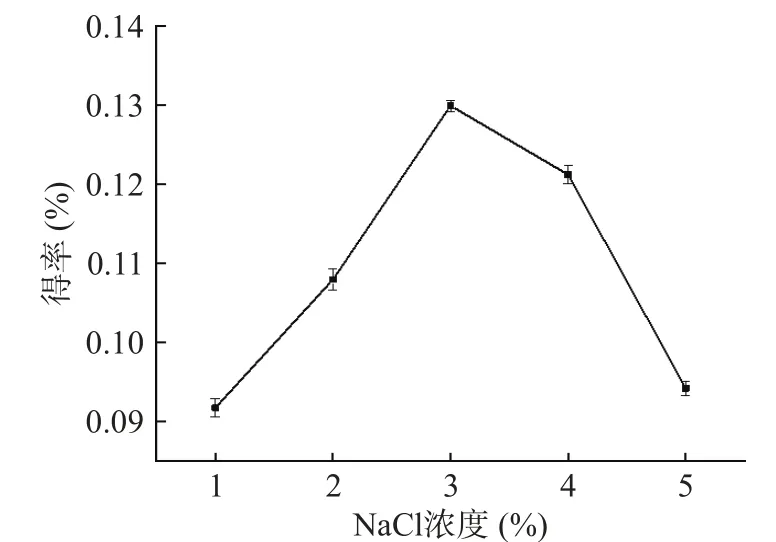
图2 NaCl浓度对金盏花精油得率的影响Fig.2 Effect of NaCl content on the yield of essential oil from Calendula officinalis L.
2.1.3 料液比对精油得率的影响 不同料液比对金盏花精油的得率影响如图3所示,可以看出,随着料液比的增加,金盏花精油的得率提高,但当原料与加水量的比例超过1:30 g/mL后,得率便会出现断崖式下跌。这是因为当加水量较少时,原料与水接触并不完全,浸润度不高,精油不能完全释放从而限制得率。加水量提高之后,有更充足的溶液与原料接触,精油可以更多地随蒸气蒸发出来。但如果加水量过高的话,则会使得精油更多地溶解分散在水中,同时液量的增加亦会减弱微波热效应,最终导致得率严重降低[17−18]。因此最佳料液比为1:30 g/mL。
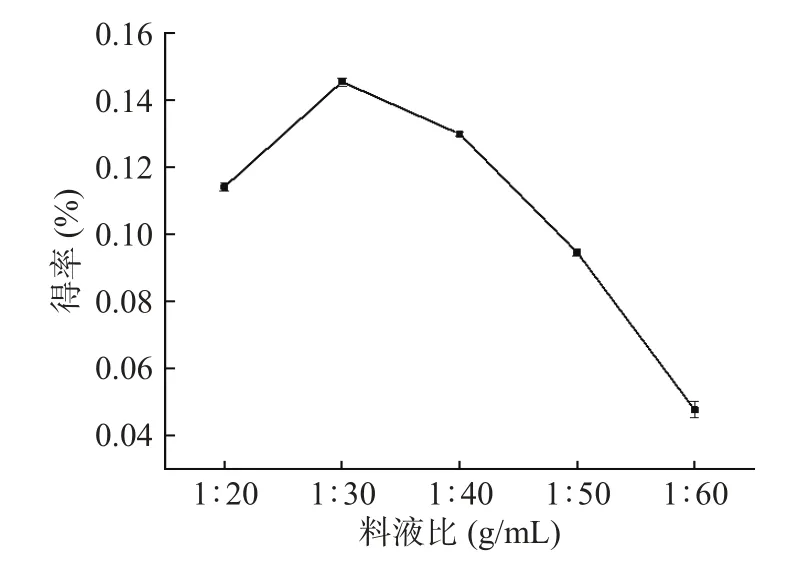
图3 料液比对金盏花精油得率的影响Fig.3 Effect of material to liquid on the yield of essential oil from Calendula officinalis L.
2.1.4 微波功率对精油得率的影响 不同微波功率对金盏花精油得率的影响如图4所示,可以看出,随着微波功率的提高,收率呈现先增加后降低的现象,在240与400 W收率相差不明显,但240 W提取效果略好于400 W。当微波功率逐渐增加时,料液的温度也会随之升高,加剧了分子热运动,使细胞内的物质更容易渗出,从而提高了金盏花精油得率。但随着功率的持续增大,精油成分中热敏性物质会因过高的加热温度而受破坏和损失,从而降低了金盏花精油的得率[19]。因此最佳微波功率为240 W。
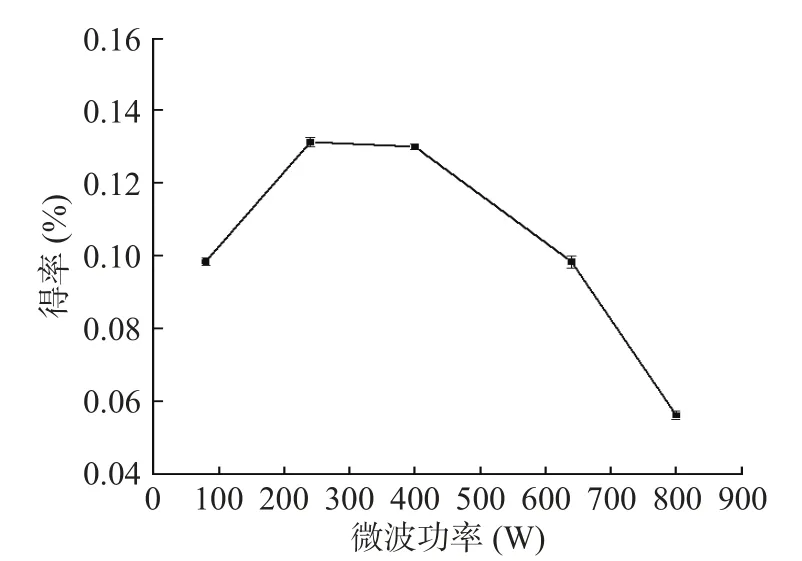
图4 微波功率对金盏花精油得率的影响Fig.4 Effect of microwave power on the yield of essential oil from Calendula officinalis L.
2.1.5 微波时间对精油得率的影响 不同微波时间对金盏花精油得率的影响如图5所示,整体来看,金盏花精油在2~10 min内得率的变化浮动相比其他因素较小,最高与最低相差只有0.02%左右。精油产量随着微波时间的延长而提高,微波辐射8 min产出效果最好,若再延长在微波反应器中的反应时间,会使产量下降。这可能是由于短时间的微波辐射所产生的热效应较小,对于植物细胞的腺体和细胞的破坏不完全,有效成分溶出较少;而微波加热时间过长会出现热敏成分挥发或降解的现象[20−21]。因此最佳微波时间为8 min。
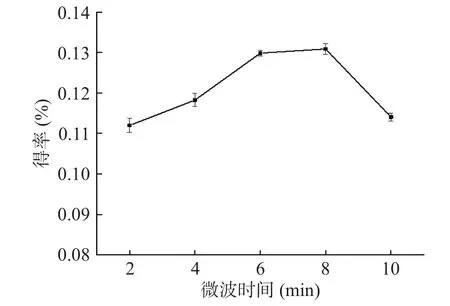
图5 微波时间对金盏花精油得率的影响Fig.5 Effect of microwave time on the yield of essential oil from Calendula officinalis L.
2.2 正交试验结果
正交试验结果见表2。从表2极差分析中可以得出影响金盏花精油产量的主次顺序为A>C>B,即NaCl浓度大于微波功率大于料液比。由表3可知,NaCl浓度对金盏花精油得率影响极显著(P<0.01),微波功率对得率的影响显著(P<0.05),料液比对于得率的影响未表现出显著性,这说明方差分析与极差分析结果一致。根据结果得出,金盏花精油的最佳提取工艺为A2B2C2,即NaCl浓度3%,料液比1:30 g/mL,微波功率240 W。由于最优组合在正交结果中不存在,所以在经过三次验证试验后,在此条件下金盏花精油产量为0.156%±0.002%,该结果比正交表中的结果都要高,理论与实际相吻合,由此可见通过正交试验优化得到的最优工艺参数呈现较好重复性及可靠性。相比于以往文献[22]中金盏花精油得率(0.02%~0.06%)有了极大提高。
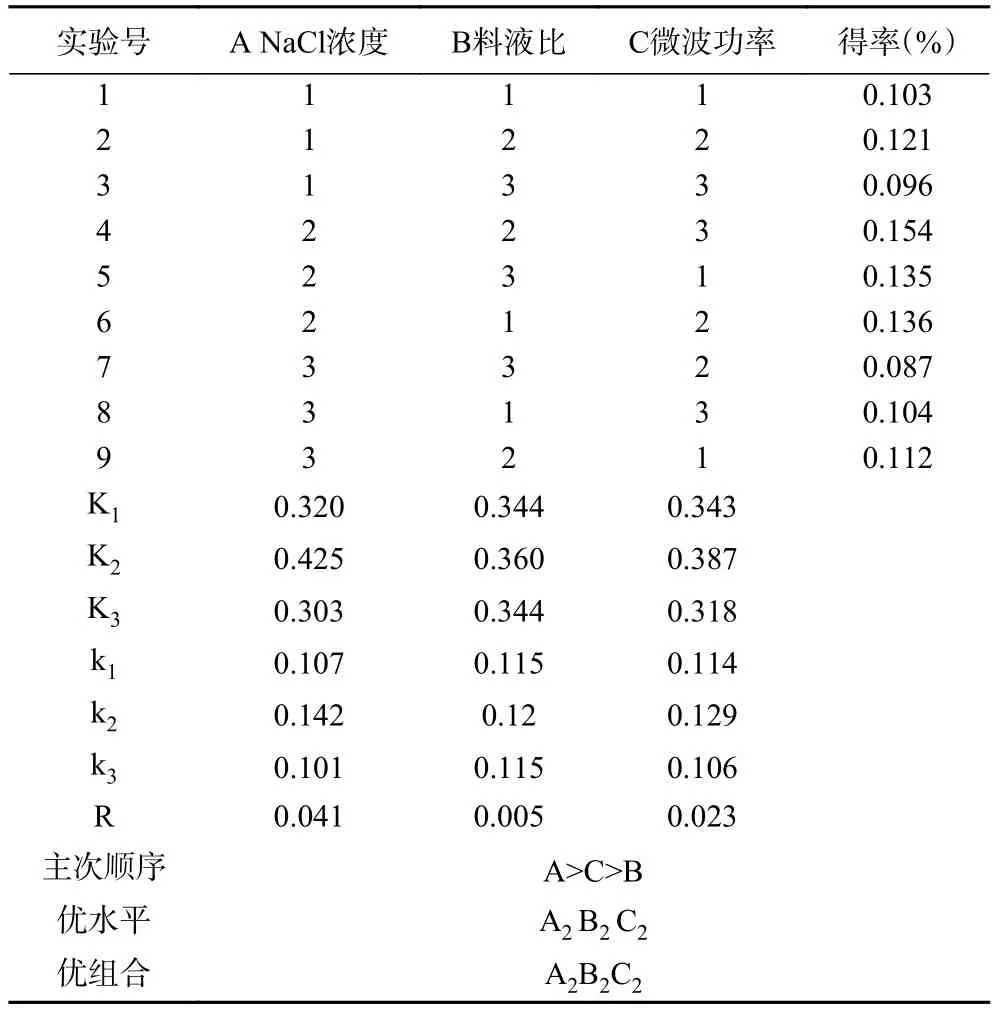
表2 正交试验结果与分析Table 2 Results and analysis of orthogonal test
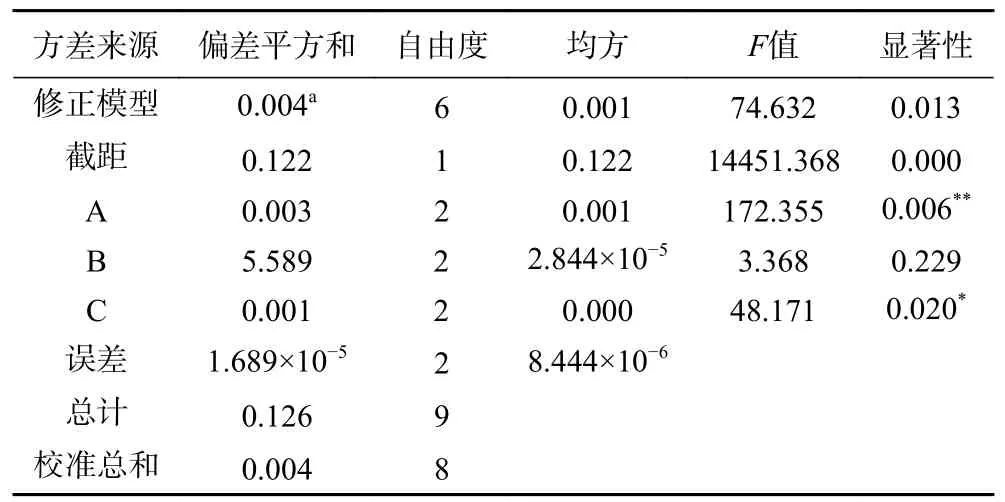
表3 正交试验方差分析结果Table 3 Analysis of variance results of orthogonal test
2.3 GC-MS结果分析
金盏花精油的GC-MS结果如图6和表4所示,总计分离出25种组分,占被检总量的97.74%,其中有11种醇类化合物,占总成分的67.42%;6种萜烯类化合物,占总成分的22.53%;3种萜烯类氧化物,占总成分的3.75%;2种酮类化合物,占总成分的2.24%;2种烷烃化合物,占总成分的1.31%;1种酯类化合物,占总成分的0.49%。
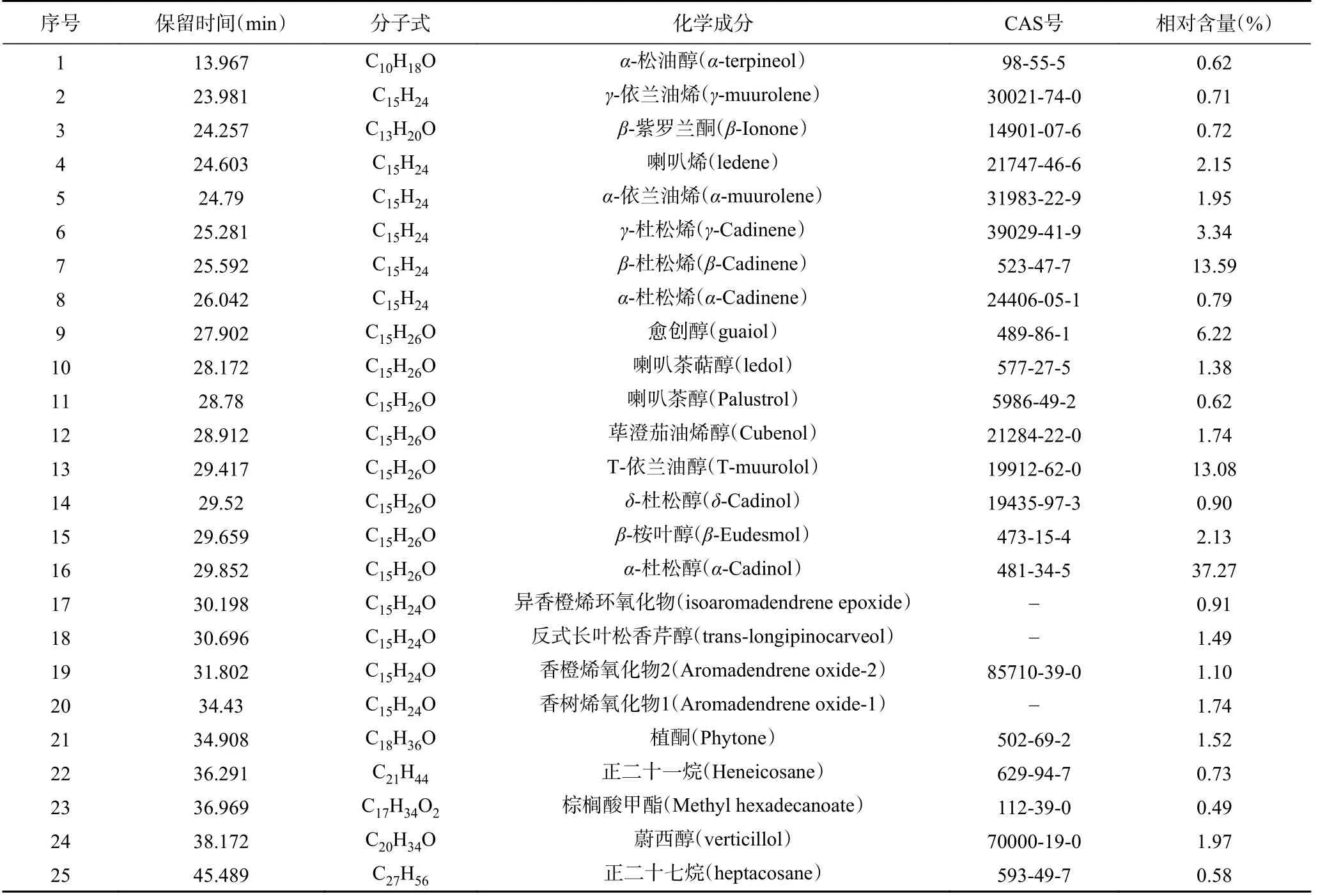
表4 金盏花精油成分的GC-MS分析结果Table 4 GC-MS analysis of essential oil from Calendula officinalis L.
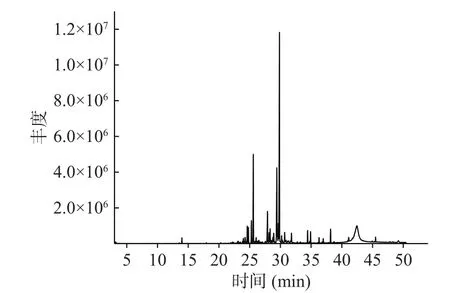
图6 金盏花精油的总离子流色谱图Fig.6 Total ion flow chromatography of essential oil from Calendula officinalis L.
通过采用面积归一化法计算金盏花精油各组分相对含量可以看出,在已鉴定的挥发性成分中含量超过1%的成分共有15个,占据主导的是α-杜松醇(37.27%),是一种倍半萜醇类化合物,具有很强的杀螨活性[23],这与黄妙玲等[24]和Petrovic等[25]的分析结果相似;其次是β-杜松烯(13.59%),是一种倍半萜烯,具有百里香和木材的香气[26],然后是T-依兰油醇(13.08%)、愈创醇(6.22%)、γ-杜松烯(3.34%)、喇叭烯(2.15%)等,这些主要成分占总成分的90.67%。Khalid等[27]研究了不同培养状态下金盏花精油的成分组成,发现其主要成分为α-杜松醇(32.01%~65.99%)、δ-杜松烯(17.79%~23.14%)、α-桉叶醇(0.26%~9.77%)。Okoh等[28]分析了金盏花干叶、鲜叶、鲜花中精油的化学成分,发现在这三个部位中都具有较高的α-侧柏烯(17.8%~26.9%)、T-依兰油烯(13.1%~40.9%)以及δ-杜松烯(9.0%~13.1%),除此之外,在鲜花精油中还有较多的大牛儿烯(2.8%)、α-可巴烯(2.7%)等[28],但这些物质在本试验中并未检出,可能是由于金盏花品种及产地、处理条件和提取方式的不同,导致得到的精油成分种类及含量具有一定差异性,但大部分检出组分与前人报道保持一致。
2.4 金盏花精油抗氧化活性分析
2.4.1 金盏花精油对DPPH自由基的清除作用 金盏花精油抵御DPPH自由基氧化的原理是精油所含的有效组分提供单电子将DPPH所带的电子捕获从而使其紫色减褪,紫色消褪越明显其抗氧化性越强[29−30]。由图7可以看出,在5~35 mg/mL浓度范围内,随着浓度的增大,精油对DPPH自由基的清除率逐渐增高,浓度为35 mg/mL时清除率达到55.71%,且有继续增长的趋势,IC50为28.89 mg/mL,但相比于VC来说,金盏花精油抵御DPPH自由基的氧化能力较弱。Sahingil[1]研究了金盏花精油的DPPH抗氧化性,在精油用量为200 μg/mL的条件下,DPPH自由基清除率为72.48%,相较于本试验对于DPPH的抗氧化性更强,可能是因为其所制备的金盏花精油里具备本次试验未能检出的γ-萜品烯和柠檬烯,这两种成分都具有可观的DPPH自由基清除活性[10,31]。
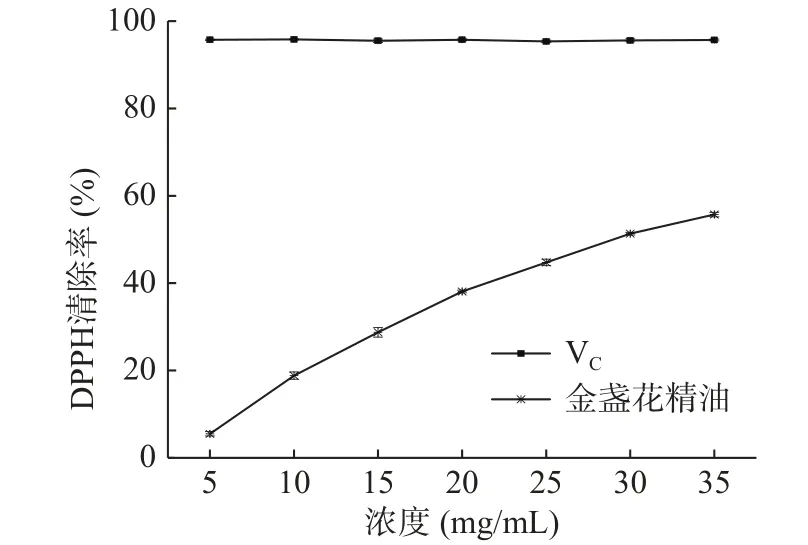
图7 金盏花精油对DPPH自由基的清除作用Fig.7 Scavenging effect of essential oil from Calendula officinalis L. on DPPH free radical
2.4.2 金盏花精油对羟自由基的清除作用 由图8可知,在5~35 mg/mL浓度范围内,金盏花精油对羟自由基的清除能力呈现较好的量效关系,随着浓度的增大,精油对羟自由基的清除率逐渐增高,浓度为5 mg/mL时清除率为44.92%,浓度为35 mg/mL时清除率达到92.18%,且仍有增长的趋势,此时已接近同浓度VC的清除活性,金盏花精油清除羟自由基的IC50为6.77 mg/mL。研究表明精油中的α-松油醇具有很好的羟自由基清除效果[32],因此金盏花精油较强的羟自由基清除能力可能与其含一定的α-松油醇有关。
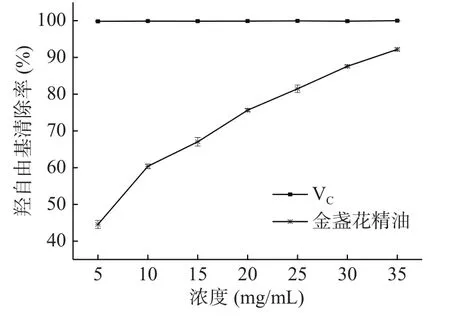
图8 金盏花精油对羟自由基的清除作用Fig.8 Scavenging effect of essential oil from Calendula officinalis L. on hydroxyl free radical
2.4.3 金盏花精油对ABTS+自由基的清除作用 ABTS+·在734 nm下具有最大吸收波长,可通过过硫酸钾与ABTS反应获得,在与抗氧化成分反应后可使其蓝绿色减褪,褪色程度与抗氧化能力呈正相关[33]。由图9可知,VC在5~35 mg/mL浓度范围内均处于99%以上。在2~14 mg/mL浓度范围内,金盏花精油对ABTS+自由基的清除能力呈现较好的量效关系,随着浓度的增大,精油对ABTS+自由基的清除率逐渐增高,浓度为2 mg/mL时清除率为43.79%,浓度为14 mg/mL时清除率达到98.40%,且有继续增长的趋势,此时已接近同浓度VC的清除活性。金盏花精油清除ABTS+自由基的IC50为2.21 mg/mL,表明金盏花精油具有良好的ABTS+自由基清除能力,而且其相关的成分主要是β-桉叶醇和α-松油醇[34]。
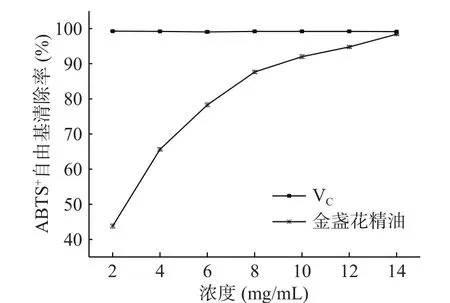
图9 金盏花精油对ABTS+自由基的清除作用Fig.9 Scavenging effect of essential oil from Calendula officinalis L. on ABTS+ free radical
3 结论
本研究采取微波辅助法提取的金盏花精油外观呈金黄色澄清液体,散发浓郁金盏花香气,通过单因素实验和正交试验确定了金盏花精油的最优提取工艺为NaCl浓度3%,料液比1:30 g/mL,微波功率240 W,此参数下金盏花精油收率为0.156%±0.002%,较先前文献极大提高了金盏花精油的产量。由GC-MS结果可知从金盏花精油中分离出25种化学组分,最为主要的是α-杜松醇(37.27%)、β-杜松烯(13.59%)和T-依兰油醇(13.08%)。从抗氧化试验中可以看出金盏花精油对三种自由基都呈现一定清除能力,三者相比来说对于ABTS+自由基清除能力最好,对于DPPH自由基清除能力较弱。综上所述,金盏花精油是一种有潜力的天然抗氧产物,在天然抗氧化剂和抗衰老的化妆品、药物中有着极大的应用价值与潜力,接下来还需要进一步研究的是其抗氧化效果与相应成分的关系以及具体的抗氧化机理。
