基于生物信息学分析人微小RNA-142-5p的靶基因及其与心血管疾病的关联
2022-05-14俞虹宇蒋智渊
俞虹宇 周 爽 蒋智渊
(广西医科大学第一附属医院心血管内科,南宁市 530021,电子邮箱:1606188485@qq.com)
miRNA是一类长度约22个核苷酸的非编码RNA,其主要作用是通过与靶基因mRNA互补碱基配对,RNA诱导沉默复合体(RNA-induced silencing complex,RISC)降解mRNA或阻碍其翻译,从而在转录后水平负性调控靶基因的表达。真菌、植物和动物中的miRNA碱基序列在物种进化过程中相当保守,且表达具备时序性和组织特异性[1]。由此可见,miRNA在物种进化过程中起着不可替代的作用,决定着组织和细胞的功能特异性。研究表明,miRNA参与许多生物学过程,包括细胞的生长、增殖、分化、凋亡,器官的形成,生物个体的发育、繁殖,并与人类疾病息息相关[1]。
微小RNA-142(microRNA-142,miR-142)以两种成熟异构体的形式存在,分别为miR-142-3p和miR-142-5p,它们是由完整miR-142双链的正义链和反义链经核糖核酸酶代谢产生。目前,针对miR-142-5p在心血管疾病中的作用研究,主要集中于心肌凋亡方面[2-4],其在心血管疾病中的作用仍有待探索。本研究利用生物信息学技术预测人miR-142-5p(homo sapiens-miR-142-5p,hsa-miR-142-5p)的靶基因,并通过分析靶基因涉及的生物学过程和信号通路初步探讨hsa-miR-142-5p在心血管疾病中的作用。
1 资料与方法
1.1 检索hsa-miR-142-5p在各个组织器官中的表达情况 使用miRGator v3.0数据库(http://genome.ewha.ac.kr/miRGator/miRGator.html)对hsa-miR-142-5p进行检索,查看其在各个组织器官中的表达情况。
1.2 分析hsa-miR-142-5p的染色体定位及物种保守性 使用PubMed数据库(http://www.ncbi.nlm.nih.gov/pubmed/)检索hsa-miR-142-5p的相关文献,并结合miRBase 22.1(http://www.mirtarbase.org)和UCSC Genome Browser(http://genome.ucsc.edu/)的检索结果,获取其染色体定位、碱基序列和物种保守性等基本信息。
1.3 预测hsa-miR-142-5p的靶基因 利用TargetScan 7.2(http://www.targetscan.org/vert_72)、DIANA TOOLS(http://www.microrna.gr/microT-CDS)、miRDB(http://www.mirdb.org/)和miRWalk 3.0(http://www.umm.uni-heidel-berg.de/apps/zmf/mirwalk/)预测hsa-miR-142-5p的靶基因,并利用Venny.2.1.0建立Venn图,取它们的交集。通过miRTarBase(http://mirtarbase.mbc.nctu.edu.tw)获取经过较强实验证据验证的hsa-miR-142-5p的靶基因,将其与上述靶基因的交集进行合并,组成新的基因集。
1.4 hsa-miR-142-5p靶基因集的生物功能和通路富集分析 使用基因本体论(Gene Ontology,GO)功能富集分析网站(http://geneontology.org/)和 DAVID 6.7数据库(https://david.ncifcrf.gov/)对此基因集进行功能富集分析,并利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/)进行信号通路富集分析。选取高频率注释及有统计学意义的信号通路进行分析,其中以P<0.05为差异有统计学意义。
2 结 果
2.1 hsa-miR-142-5p的表达情况 hsa-miR-142-5p在淋巴细胞、淋巴样细胞、外周血单核细胞、扁桃体中的表达丰度较高,其中心脏存在基础表达量。见图1。

图1 hsa-miR-142-5p在各组织器官中的表达情况
2.2 hsa-miR-142-5p的染色体定位及物种保守性 使用UCSC Genome Browser检索,发现hsa-miR-142-5p定位于染色体17q22,共21个碱基序列。使用miRBase检索到包括人类在内的共26个不同物种miR-142-5p的成熟序列,对其进行分析后发现,在这26个物种中几乎都包含了miR-142-5p的“CAUAAAGUAGAAAGCACU”18个碱基序列,表明该碱基序列在这26个物种中高度保守,见表1。

表1 26个物种 miR-142-5p 的成熟序列
2.3 hsa-miR-142-5p的靶基因预测结果 TargetScan、DIANA TOOLS、miRDB和miRWalk软件预测得到的 hsa-miR-142-5p靶基因分别为950个、1 934个、1 133个、956个,将4种预测方法所得的靶基因取交集后共获得39个靶基因,分别为AFF4、AHR、AKAP11、ARMC8、ATP13A3、ATP1B1、BMPR1A、BTBD7、C21orf91、CHD9、CIT、CNTN1、EIF4E3、FAM91A1、FBXO21、FIGN、GAS7、GRSF1、HS2ST1、IL6ST、ITGAV、KITLG、MAN1A1、NFAT5、NR2C1、ONECUT2、OTUD4、PIK3CA、PUM2、RAP1A、RC3H1、SCN2A、SETX、SLC5A3、SPRY3、SPTBN1、TBC1D9、TRIM36、ZBTB37,见图2。通过miRTarBase获得12个经较强实验证据验证过的靶基因,分别是CLDN1、HIF1A、IGF2BP3、NFE2L2、PTEN、RAC1、SIRT1、SMAD3、SOCS1、TGFBR2、TP53INP1、ZEB1,合并后共获得51个候选基因,组成1个靶基因集。

图2 4种软件对has-miR-142-5p靶基因预测结果的Venn图
2.4 hsa-miR-142-5p靶基因集的GO功能富集分析和KEGG通路富集分析结果 将hsa-miR-142-5p靶基因集进行GO功能富集分析,分别获得66项生物学过程、18项分子功能和13个细胞组分,其中有统计学差异的生物学过程有37项、分子功能9项、细胞组分7项。结果显示,靶基因功能富集在心内膜垫融合、胚胎心管形态发生、心脏心室形态的发生和心肌肥厚的调控、心脏上皮向间质转化的正调控等生物学过程,富集在转录因子β受体、蛋白激酶和特异性核酸序列等分子功能上,以及胞质溶胶、核染色质(体)和PML主体等细胞组分中(均P<0.05)。见表2。
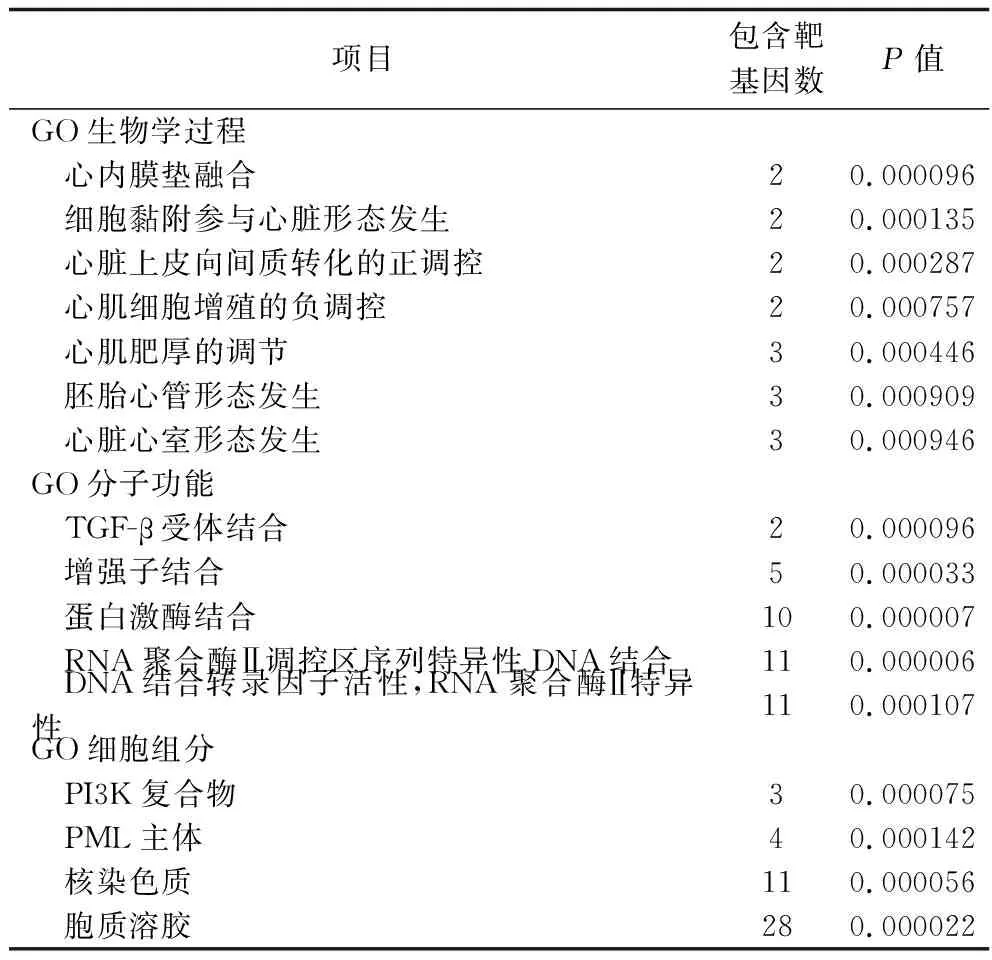
表2 hsa-miR-142-5p靶基因的 GO分析结果
通过DAVID数据库对 hsa-miR-142-5p靶基因集进行基于KEGG的信号通路富集分析,共获取24条信号通路(P<0.05),本部分仅选取其中8个信号通路进行分析,包括hsa-miR-142-5p靶基因富集于局灶性粘连、磷脂酰肌醇3-激酶(phosphoinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、叉头框蛋白O(forkhead box O,FoxO)信号通路、白细胞跨内皮迁移、甲状腺激素信号通路、Rap1信号通路、黏附连接、转化生长因子β(transforming growth factor β,TGF-β)等信号通路中(均P<0.05),见表3。

表3 hsa-miR-142-5p靶基因的KEGG通路分析结果
3 讨 论
hsa-miR-142-5p序列在人类参考基因组中被发现,是miR-142的家族成员之一,经检索发现其序列共有21个核苷酸,且在26个物种间高度保守。通过5个数据库进行靶基因预测,共获得包含51个候选基因的靶基因集;GO功能富集分析结果显示,hsa-miR-142-5p的靶基因功能富集在心内膜垫融合、胚胎心管形态发生、心脏心室形态的发生和心肌肥厚的调控、心脏上皮向间质转化的正调控等生物学过程,并主要集中于胞质溶胶、染色质(体)等细胞组分,调控转录生长因子β受体、蛋白激酶和特异性核酸序列等分子功能。由此可见,hsa-miR-142-5p与多个基因相互作用,调节生命形式所必需的基本功能。
研究表明,扩张型心肌病患儿的外周血miR-142-5p表达显著上调,miR-142-5p有可能成为诊断扩张型心肌病和评估心力衰竭的潜在生物指标[5]。还有研究表明, miR-142-5p表达下调与非ST段抬高型的急性冠脉综合征患者慢性心力衰竭的发生有关[6]。此外,母体血清中miR-142-5p表达下调与胎儿先天性心脏缺陷的发生相关[7]。Pan等[8]研究发现,miR-142-5p的循环水平在支架内在狭窄患者中显著升高。上述研究提示miR-142-5p或可作为诊断心血管疾病的血清学标志物,但其在上述疾病发生中的具体作用仍有待探索。近期,已有学者对miR-142-5p在心血管疾病发生中的作用进行了探索。Du等[2]研究发现,长链非编码RNA GAS5可作为竞争性内源RNA与miR-142-5p结合,沉默长链非编码RNA GAS5表达可促进miR-142-5p表达,从而激活PI3K/Akt和丝裂原活化蛋白激酶激酶/细胞外调节蛋白激酶信号通路,减少缺氧造成的大鼠心肌凋亡。Wang等[9]的研究表明, miR-142-5p与miR-212-5p协同抑制c-Myc/肿瘤蛋白p53诱导核蛋白1信号通路,从而抑制小鼠心肌梗死后心脏成纤维细胞增生和胶原纤维分泌,改善心脏功能。Shrestha等[4]发现,miR-142-5p可以控制出生后心肌细胞的适应性生长,是调控心肌细胞适应性肥厚的关键因子;miR-142-5p表达上调可导致小鼠心肌细胞过度凋亡、心脏明显扩张和心功能障碍。此外,还有研究表明,miR-142-5p还能通过下调B细胞易位基因3促进血管平滑肌细胞增殖[10]。
上述研究多集中在miR-142-5p心肌细胞凋亡中的作用,个别研究涉及心肌纤维化及平滑肌细胞增殖。我们利用生物信息学技术进行分析后发现,hsa-miR-142-5p与心内膜垫融合、胚胎心管形态发生、心脏心室形态发生和心肌肥厚的调节有关,提示hsa-miR-142-5p可能在先天性心脏病和心肌肥厚的发生中起着重要作用,此外,hsa-miR-142-5p还参与了心脏上皮向间质转化的调控,这可能与心肌纤维化有关[11]。我们还发现,hsa-miR-142-5p参与PI3K/Akt信号通路、黏附连接、TGF-β信号通路、甲状腺激素信号通路、Rap1信号通路和FoxO信号通路的调控。研究表明,PI3K/Akt信号通路与心肌纤维化和心肌肥厚有关[12-13],黏附连接信号通路对于维持血管内皮细胞屏障及正常功能起着重要作用[14],TGF-β信号通路与心肌纤维化密切相关[15],甲状腺激素信号通路与心肌肥厚有关[16],Rap1信号通路则主要与血管平滑肌细胞及血管内皮细胞的调控有关[17-18],而FoxO信号通路则主要与心肌肥厚的调控有关[19]。上述结果提示,hsa-miR-142-5p在先天性心脏病、心肌肥厚、心肌纤维化、血管平滑肌细胞和血管内皮细胞调控中具有一定的作用,可作为今后进一步研究的方向,而PI3K/Akt信号通路、黏附连接、TGF-β信号通路、甲状腺激素信号通路、Rap1信号通路和FoxO信号通路则为进一步探索hsa-miR-142-5p在上述病理生理过程中的具体机制提供了线索。
综上所述,hsa-miR-142-5p的靶基因可能与先天性心脏病、心肌肥厚、心肌纤维化、血管平滑肌细胞和血管内皮细胞调控有关,而PI3K/Akt信号通路、黏附连接、TGF-β信号通路、甲状腺激素信号通路、Rap1信号通路和FoxO信号通路可能参与上述病理生理过程。上述结果为进一步研究hsa-miR-142-5p在心血管疾病发生中的作用及机制提供了一定的线索。
