2种实时荧光定量聚合酶链式反应法检测HBeAg阳性慢性乙型肝炎患者血清HBV RNA的一致性分析
2022-05-14邓中平卞丹丹蒋莹莹鲁凤民段钟平郑素军
王 扬, 廖 昊, 邓中平, 卞丹丹, 任 艳, 蒋莹莹, 刘 霜, 陈 煜,鲁凤民, 段钟平, 郑素军
1 首都医科大学附属北京佑安医院 疑难肝病与人工肝中心, 北京 100069; 2 北京大学基础医学院 病原生物学系暨感染病中心, 北京 100191; 3 北京大学 前沿交叉学科研究院, 北京 100871; 4 基因诊断技术湖南省 重点实验室, 长沙 410205; 5首都医科大学电力教学医院 感染性疾病科, 北京 100073
全世界约2.92亿人感染HBV[1],HBV感染是慢性乙型肝炎(CHB)、肝硬化、肝衰竭和肝细胞癌(HCC)的主要致病因素[2]。HBV DNA定量、HBeAg和HBsAg定量可以反映病毒复制活跃程度[3],但是仅以此作为CHB患者接受患者核苷(酸)类似物(NUC)或干扰素治疗期间疗效监测、方案管理是不够的,尤其是经长期抗病毒治疗后HBV DNA水平低于试剂盒检测下限的患者。新近累积的证据表明,血清HBV RNA定量可以反映共价闭合环状DNA (cccDNA)复制活跃程度并且与组织学变化相关[4],预测NUC治疗中的早期病毒耐药[5],与接受NUC或干扰素治疗的CHB患者应答相关[6-7]。国内目前有基于实时荧光定量聚合酶链式反应(real-time PCR)技术的S(Shengxiang)、X (Xinbo) HBV pgRNA核酸检测试剂可供使用,但是HBeAg血清学转换与未转换CHB患者间HBV RNA定量结果差异显著[8],而且不同试剂在临床样本中检测结果的一致性尚未知晓。在本研究中,笔者拟评价两种试剂检测方法在临床样本检测结果中的相关性和一致性。
1 资料与方法
1.1 研究对象 对前瞻性收集于2007年7月—2008年8月首都医科大学附属北京佑安医院疑难肝病及人工肝中心组建的108例CHB患者队列,其中HBeAg阳性患者83例,回顾性分析基线、12周、24周及48周的数据。符合入组条件的病例连续入组,入组标准:(1)男性或女性年龄≥16岁;(2)CHB的诊断及治疗标准符合2005年《慢性乙型肝炎防治指南》[9]。排除标准:(1)其他原因造成的活动性肝病或合并其他病毒感染,包括:HCV、HDV、HIV,或存在自身免疫性肝病;(2)除乙型肝炎外有其他重大身心疾病,如严重心脏病、肾脏疾病等;(3)肾脏功能下降(肌酐清除率<50 mL/min)需要减少药物使用剂量者;(4)依从性差者;(5)既往恶性肿瘤病史,包括HCC、原位癌和肝脏不典型增生结节,不行肝移植预期寿命少于1年者;(6)精神疾病患者;(7)入组前6个月接受皮质类固醇药物、免疫抑制剂和化疗药物者;(8)女性妊娠、哺乳者。
1.2 血液生物化学、病毒学指标检测 肝功能、生化等检测由首都医科大学附属北京佑安医院检验中心完成,使用自动生化检测器(AU640生化分析仪,OLYMPUS,日本)进行ALT和AST等生化指标的测定。使用电化学发光免疫测定法(Abbott Laboratories,Chicago,IL,USA),在Roche Cobas e601分析仪上测定血清HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc。使用Elecsys进行HBsAg定量(Roche Diagnostics),最低检测限为0.05 IU/mL。使用Cobas HBV Amplicor Monitor测定法(Roche Diagnostics,Pleasanton,CA,USA)测定血清HBV DNA水平,最低检测下限为50 IU/mL。
1.3 HBV RNA定量检测 S试剂法:采用S公司HBV RNA定量检测试剂盒(PCR-荧光探针法),具体操作过程如既往文献[3,10-11]所述。X试剂法操作如下:HBV RNA用核酸提取或纯化试剂盒(Xinbo公司,科研用试剂)分离,并用配套的DNase I处理450 μL血清中的核酸。DNase I处理中,包含待测血清样本以及阴性对照品、阳性对照品、消化对照品,每种反应混合物均包含4 μL DNase I反应缓冲液(10×),4 μL DNAse I(不含RNase)和40 μL核酸。标准品中加入48 μL洗脱液(替代4 μL Dnase I和4 μL 10×buffer),混匀。在37 ℃下反应30 min,再加入40 μL 4 mmol/L EDTA,混匀,接着将每种混合物在65 °C孵育10 min以使DNase I失活,标准品不参与加热,不加EDTA终止。最后,使用HBV pgRNA高灵敏定量试剂盒(Xinbo公司,科研用)对DNase I处理的HBV RNA进行一步逆转录和实时荧光定量PCR检测。使用ABI7500荧光定量PCR系统(Applied Biosystems,Foster City,CA,USA)测量血清HBV RNA水平,其扩增条件:在95 °C变性1 min,37 ℃ 2 min,逆转录50 ℃ 5 min,逆转录42 ℃ 20 min;94 ℃变性10 min,94 ℃变性30 s 45个循环,62 ℃ 45 s退火(收集荧光信号)。扩增结果被自动分析。测定的最低下限为200 拷贝/mL。
2 结果
2.1 一般资料 83例HBeAg阳性患者,随访108(18~138)个月,37例(44.58%)发生HBeAg血清学转换,随机选取20例发生HBeAg血清学转换患者,基于性别、年龄、使用药物种类(ETV vs ADV)和HBV DNA载量,容差0.04进行1∶1匹配,纳入20例HBeAg血清学未转换患者的临床资料,两组患者基线资料中BMI、基因型构成、ALT、AST、AST/ALT、TBil、ALP、PLT和HBsAg定量之间,差异均无统计学意义(P值均>0.05)(表1)。
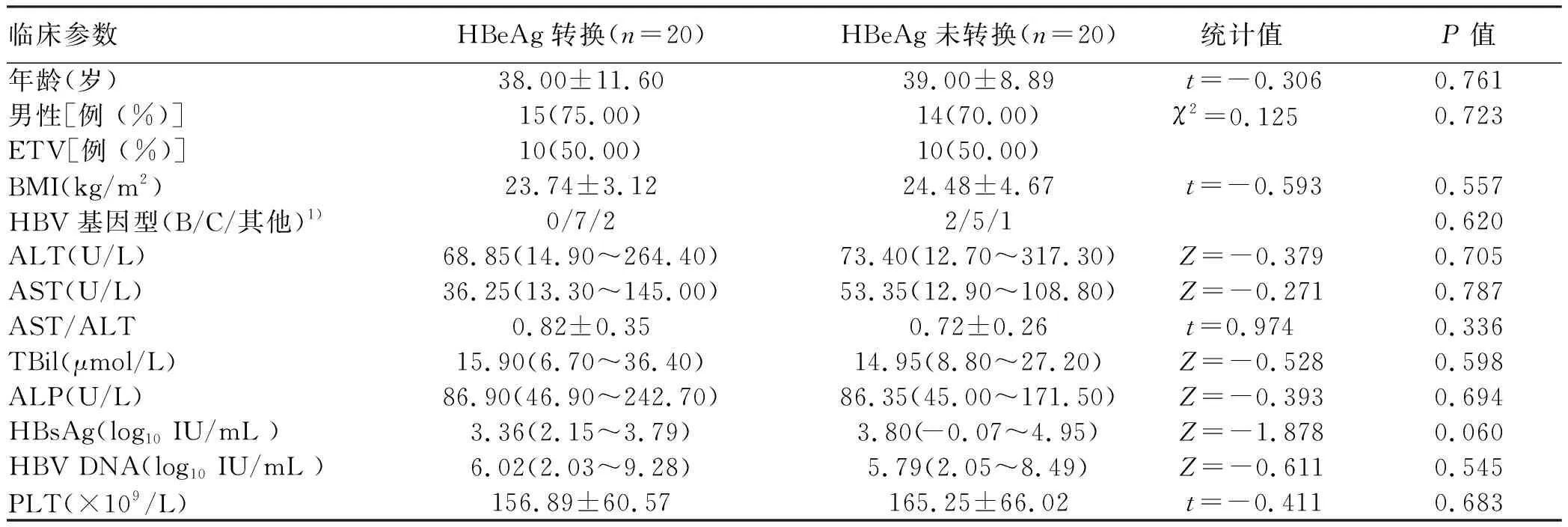
表1 HBeAg转换与未转换患者基线时一般临床特征
2.2 HBV RNA检测结果比较 40例患者基线、随访12、24及48周数据纳入此项分析,其中X试剂检测154份血清样本,S试剂检测132份血清样本,两种试剂对送检样本中HBV RNA检出率均为100%。
两种试剂共同检测血清样本131份,各随访时间点血清样本数分别为34、29、35及33份,X试剂检测HBV RNA定量数据均高于S试剂,差异均具有统计学意义(P值均<0.001)(表2)。两种检测方法中,随着治疗延续,HBeAg转换和未转换组HBV RNA定量均呈下降趋势,且X试剂检测HBV RNA定量数据均高于S试剂,差异均具有统计学意义(P值均<0.05)(图1)。
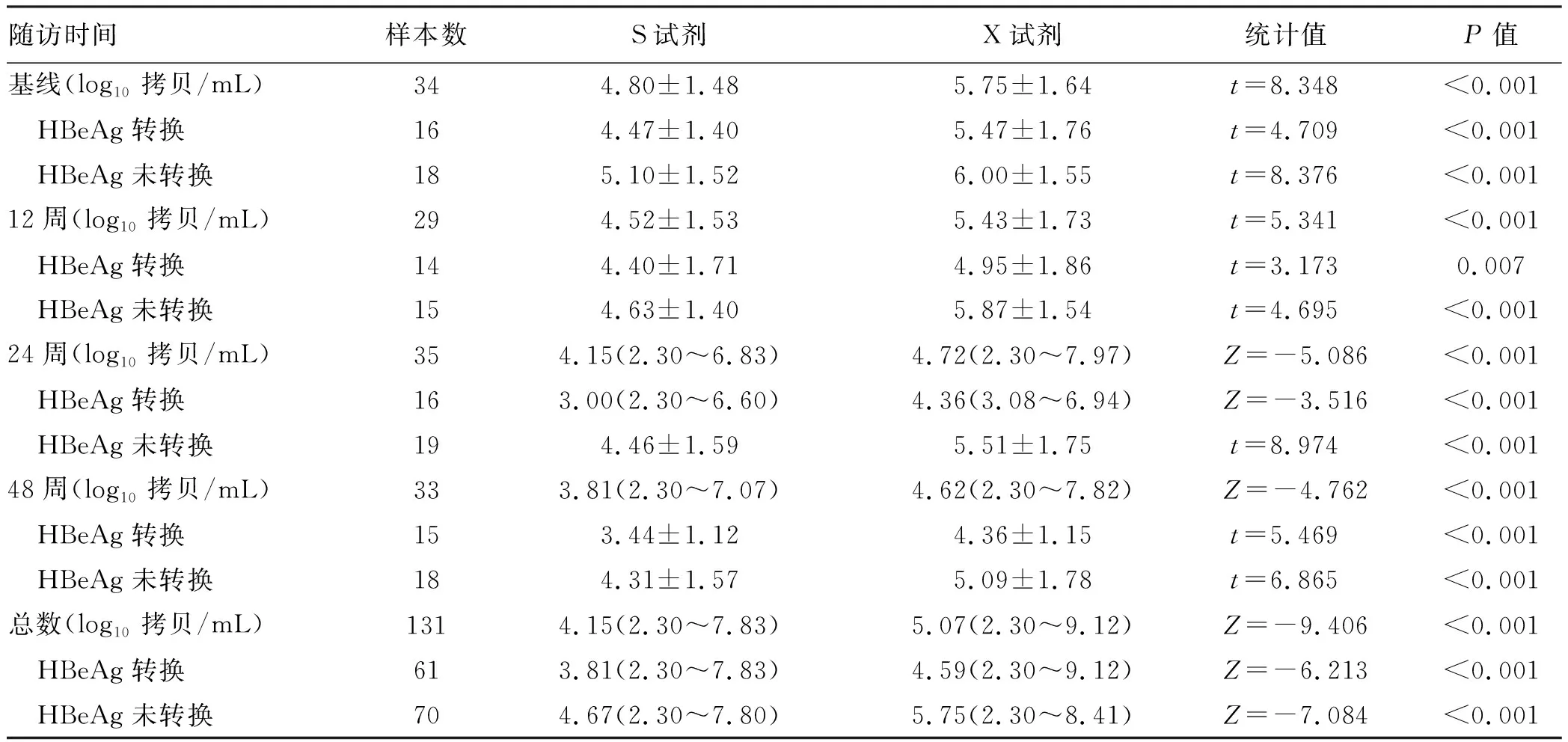
表2 HBV RNA定量检测结果比较
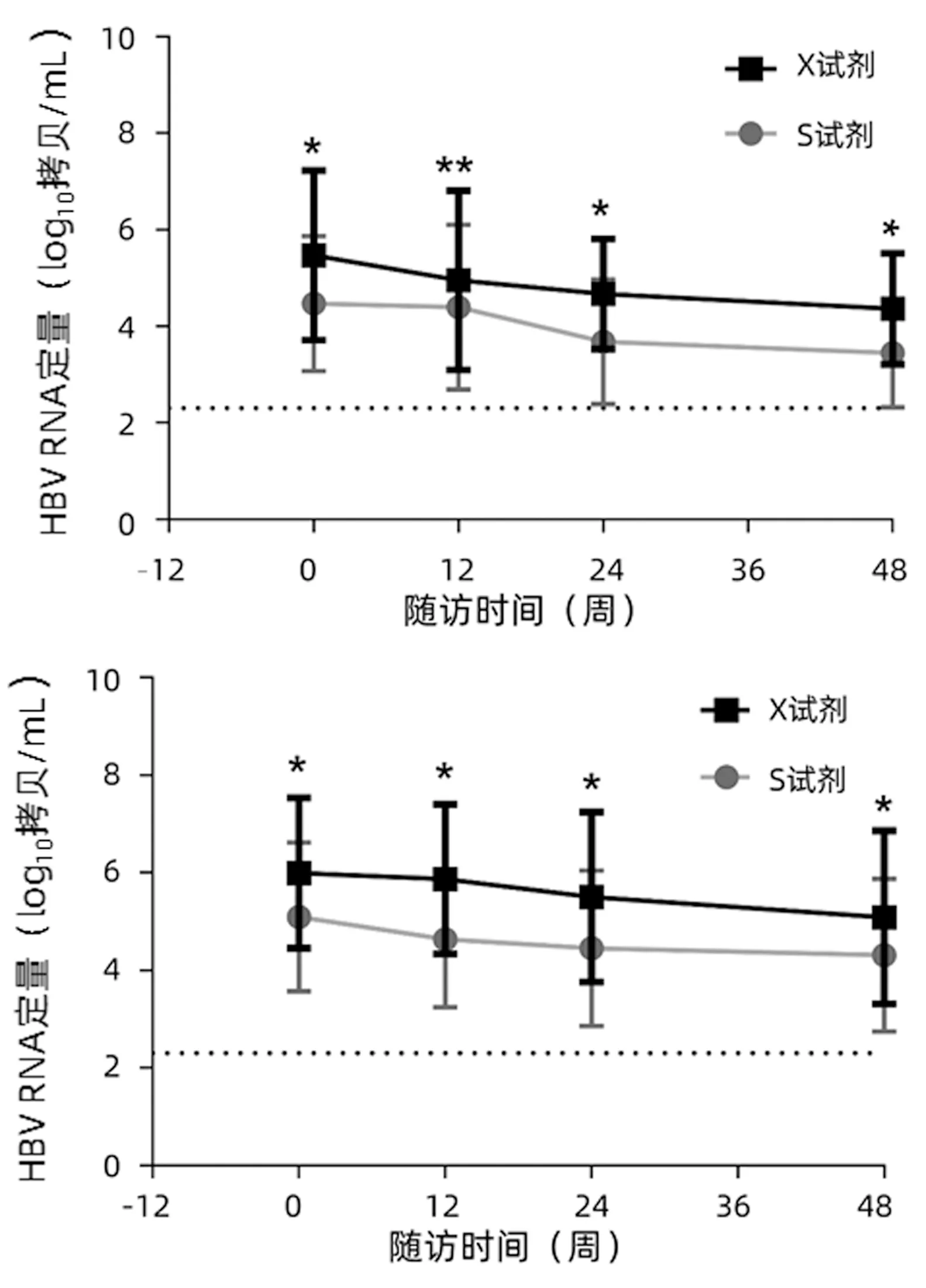
图1 两种检测方法在HBeAg转换和未转换患者中测得的HBV RNA定量动态变化
2.3 HBV RNA定量检测结果一致性评价 两种检测方法相关系数如表3所示。总体样本中,r和ICC分别为0.916(95%CI:0.883~0.940)和0.777(95%CI:-0.003~0.926)(P值均<0.05)。在基线、随访12周、24周及48周,两种检测方法r及ICC分别为0.915(95%CI:0.836~0.957)与0.771(95%CI:-0.021~0.931)、0.849(95%CI:0.701~0.927)与0.733(95%CI:0.138~0.902)、0.951(95%CI:0.905~0.975)与0.776(95%CI:-0.058~0.942)、0.933(95%CI:0.867~0.967)与0.804(95%CI:-0.014~0.944)(P值均<0.05)。在HBeAg转换及未转换患者血清中,两种方法检测结果之间的相关性见表3。
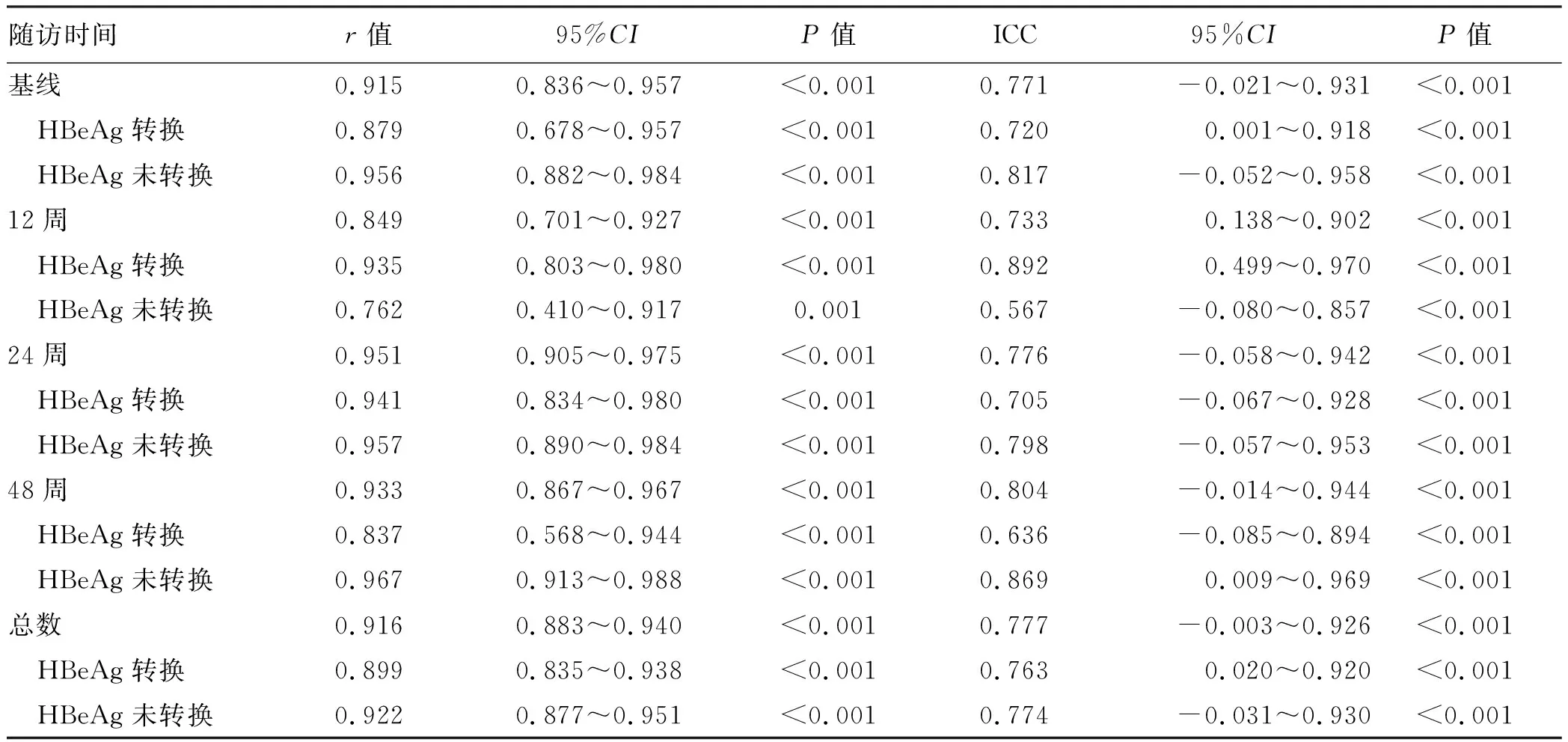
表3 两种方法检测HBV RNA定量结果之间的相关性
Bland-Altman法一致性分析结果如图2所示。两种检测方法中,96.18%(126/131)的差异位于平均差±1.96标准差之间,方法间定量差异<1 log、1~2 log和>2 log的样本比例分别为54.96%(72/131)、42.75%(56/131)和2.29%(3/131)。两种方法间差值均数为0.93(95%CI:-0.36~2.22)log10拷贝/mL,差值最大为4.66 log10拷贝/mL。在HBeAg转换和未转换患者中,方法间差异位于平均差±1.96标准差之间的比例分别为95.08%(58/61)和97.14%(68/70)。
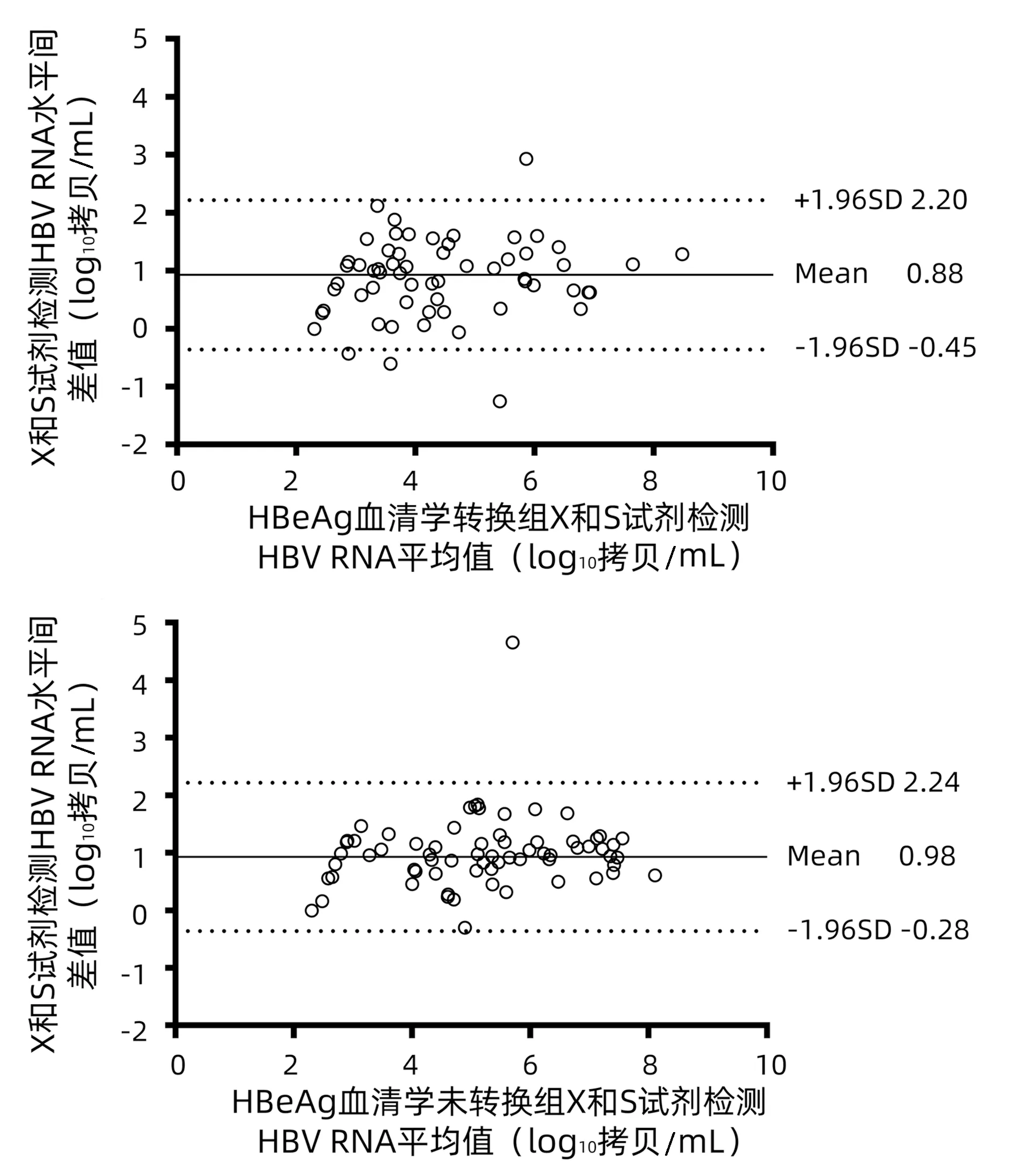
注:用X和S试剂在131份CHB患者临床血清中检测的HBV RNA水平,纵坐标为检测结果的两种试剂检测结果的差值,虚线之间的区域对应于平均差±1.96标准差。
3 讨论
欧洲肝病学会和国内最新的CHB管理指南[14-15]中,血清HBV RNA定量作为新型的病毒学标志物出现,新近的研究中,其不仅可以反映cccDNA复制活跃程度并且与组织学变化相关[4],在预测NUC治疗中的早期病毒耐药[5]、抗病毒治疗应答[6-7]及评估NUC停药后复发风险方面[10,16]具有潜在的临床应用价值。但是,目前的局限性在于不同研究团队采用的检测方法不完全相同。本研究首次比较国内目前可用的两种HBV pgRNA核酸检测试剂盒,结果表明,X检测试剂定量结果读数高于S检测试剂结果,但两种试剂HBV RNA定量结果的相关性及一致性良好。
HBeAg阳性CHB患者使用NUC长期抗病毒治疗过程中,两种试剂定量检测结果均反映HBV RNA水平的动态变化过程。即无论在HBeAg转换或未转换患者中,HBV RNA定量水平随治疗时间的延长均呈现逐渐下降趋势,与其他真实世界HBeAg阳性CHB患者NUC抗病毒治疗长期随访研究结果类似[8,17]。第二,既往有研究[17]表明,HBV RNA水平在HBeAg转换组显著低于未转换组,并且在抗病毒治疗早期下降更快。此外,HBV RNA和HBeAg水平在治疗基线和治疗早期中均具有相关性,可能提示HBV RNA和HBeAg mRNA均转录自cccDNA。为避免因HBeAg转换未转换构成差异导致比较结果出现偏倚,笔者使用倾向性评分对HBeAg转换未转换人群进行1∶1匹配,在一般资料均衡情况下,研究结果表明,不管HBeAg转换或未转换,在12、24及48周随访中,两种试剂定量检测HBV RNA结果均呈现较强的正相关性,提示两种试剂检测结果可能均反映了cccDNA的转录[11,18-20]。第三,与X试剂检测结果相比,S试剂检测结果HBV RNA读数较低,且二者差异具有统计学意义(P值均<0.05),提示S检测试剂灵敏度可能较高或线性范围更广,但目前仍然缺乏HBV RNA检测试剂标准品进行直接比较,仍需要进一步的深入研究。
HBeAg阳性CHB患者长期NUC抗病毒治疗过程中,Bland-Altman法一致性分析结果提示,两种试剂对HBV RNA定量检测结果中96.18%的差异位于平均差±1.96标准差之间,97.71%(128/131)样本之间的差异<2 log。造成两种方法检测结果之间的差异,可能的原因包括核酸的提取,洗脱液量、模板量、PCR反应体积及扩增靶区的不同等。这也提示了临床检验中需要标准化的检测流程及质控体系。除此之外,HBeAg阴性患者及使用干扰素抗病毒治疗过程中,两种试剂检测结果的一致性仍有待于进一步的研究。
综上所述,在临床HBeAg阳性CHB患者血清中,S和X检测试剂实时HBV RNA定量检测结果之间具有很强的相关性和良好的一致性,但不同实验室检测流程的标准化仍需要进一步改进。
伦理学声明:本研究经由首都医科大学附属北京佑安医院伦理委员会批准,批号:京佑科伦字〔2019〕056号。所纳入患者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王扬负责整理、统计数据并撰写初稿;廖昊、邓中平给予试验平台及负责试验操作;卞丹丹、任艳及蒋莹莹负责临床数据及血清样本的收集、整理及分析;刘霜、陈煜负责管理项目实施;鲁凤民、段钟平、郑素军负责研究设计,严格审阅及修订稿件并批准最终版本投稿。所有作者审阅稿件并参与稿件的修订。
