短程糖皮质激素联合核苷类似物治疗重型肝炎前期及早期患者的临床效果
2022-05-13彭芳涂龙廖群
彭 芳 涂 龙 廖 群
宜春学院第二附属医院感染科,江西宜春 336000
重型肝炎是一种严重肝脏疾病,主要病理表现为大量肝细胞坏死。在我国,引起重型肝炎最常见的病因是乙肝病毒(hepatitis B virus,HBV)感染,约占所有重型肝炎的70%[1]。此外,药物滥用毒副作用导致的肝损害、酒精性肝炎以及自身免疫性肝病所导致的重型肝炎也是临床常见的重症肝炎类型。由于重型肝炎发病后疾病临床症状严重且病后合并症多,预后难以达到良好的效果,死亡率高,导致其成为目前临床重点关注的疾病之一[2]。糖皮质激素(glucocorticoid,GC)是临床常用的调节免疫的药物,但常会出血、感染等严重毒副作用,因此用以治疗重型肝炎在临床上的应用一直无法统一标准[3]。近年来,随着抗病毒治疗药物的不断进展和抗生素及质子泵抑制剂研究的发展,GC的应用变得相对安全,两者联合用药后临床效果更好,且副作用更少。但国内外核苷类似物联合GC 治疗重型肝炎的临床资料报道较少[4]。为此,本研究通过对短程GC 联合核苷类似物治疗重型肝炎前期及早期患者的效果分析,评价GC 联合核苷类似物治疗重型肝炎患者的效果及安全性。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月至2020年12月宜春学院第二附属医院收治的60 例重型肝炎前期及早期患者的临床资料,其中男49 例,女11 例;年龄22~65岁,平均(43.51±10.51)岁;病程2~19年,平均(10.36±4.18)年。根据不同药物治疗方法分为试验组(29 例)和对照组(31例)。试验组中,男24 例,女5 例;年龄22~64 岁,平均(43.01±10.52)岁;病程2~19年,平均(10.61±4.31)年。对照组中,男25 例,女6例;年龄23~65 岁,平均(44.03±10.50)岁;病程2~18年,平均(10.12±4.06)年。两组患者性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会通过。
纳入标准:①符合《肝衰竭诊治指南》[5];②首次行抗病毒治疗;③临床资料完整。排除标准:①Ⅱ级以上肝性脑病、肝肾综合征及合并细菌或真菌感染者;②对GC 或核苷类似物药物过敏者;③严重器质性病变患者;④患者近期采用其他方式治疗重型肝炎。
1.2 方法
对照组采用核苷类类似物抗病毒、还原性谷胱甘肽、甘草酸制剂、肠道菌群调节剂等常规内科综合治疗。试验组在与对照组相同的治疗基础上,加用GC,使用甲强龙(比利时Pfizer Manufacturing Belgium NV,国药准字HJ20170197,批号20101006)80 mg,静脉滴注,1 次/d,观察患者是否出现不良反应,继续给无不良反应患者连续使用5~7 d,且逐渐减量,所有纳入患者均使用抗生素预防感染,质子泵抑制剂保护胃黏膜。治疗过程中观察患者的实际病情酌情增减药物的服用量。
1.3 观察指标及评价标准
1.3.1 临床疗效[6]观察比较两组患者治疗后不同分型患者数情况。
A 型(快速进展型):治疗后4 周内,凝血酶原活动度(prothrombin activity,PTA)进行性下降或者始终≤40%,和/或总胆红素(total bilirubin,TBil)进行性升高或者下降程度<50%峰值水平,病情快速进展,4 周内死亡或者肝移植。
B 型(快速恢复型):治疗后4 周内,PTA 进行性升高至>40%,且TBil 下降程度≥50%峰值水平,病程快速恢复,未发生死亡或者肝移植。
C 型(缓慢进展型):治疗后12 周内,PTA 进行性下降或者始终≤40%,和/或TBil 进行性升高或者下降程度<50%峰值水平,病情逐渐进展,在4 周至12 周内病死或肝移植。
D 型(缓慢恢复型):治疗后12 周内,PTA 进行性升高至>40%,且TBil 下降程度≥50%峰值水平,病情逐渐恢复,未发生死亡或肝移植。
E 型(缓慢持续型):治疗后12 周时,PTA 仍≤40%,和/或TBil 进行性升高或者下降程度<50%,病情迁延未愈,但未发生死亡或者肝移植。
1.3.2 检测指标 所有纳入的患者均于早晨空腹采集静脉血5 ml,进行离心(离心半径12.5 cm,转速3000 r/min,离心10 min)沉淀,将分离后的血清放入-70℃的冰箱中保存待检测。采用BS-280 型全自动生化分析仪(迈瑞)及CA-1500 型全自动血凝仪(希森美康)分别检测肝功能相关指标、凝血功能相关指标。
肝功能指标:TBil、谷丙转氨酶(alanine aminotransferase,ALT)、白蛋白(albumin,ALB)。
凝血功能指标:凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)和PTA。
1.3.3 不良反应 统计两组患者治疗期间的不良反应发生情况,包括失眠、头痛、感染、头晕等。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,满足正态分布且方差齐的计量资料采用(±s)表示,采用独立样本t检验;计数资料用率表示,采用χ2检验;等级资料采用秩和检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床治疗效果的比较
两组的整体临床治疗效果比较,差异无统计学意义(P>0.05)(表1)。

表1 两组患者临床治疗效果的比较(n)
2.2 两组患者治疗前后肝功能指标的比较
两组治疗前的肝功能指标比较,差异无统计学意义(P>0.05)。两组治疗后的TBil、ALT 水平低于治疗前,差异有统计学意义(P<0.05);试验组治疗后的TBil、ALT 水平低于对照组,差异有统计学意义(P<0.05);两组治疗前后的ALB 水平比较,差异无统计学意义(P>0.05)(表2)。
表2 两组患者治疗前后肝功能指标的比较(±s)
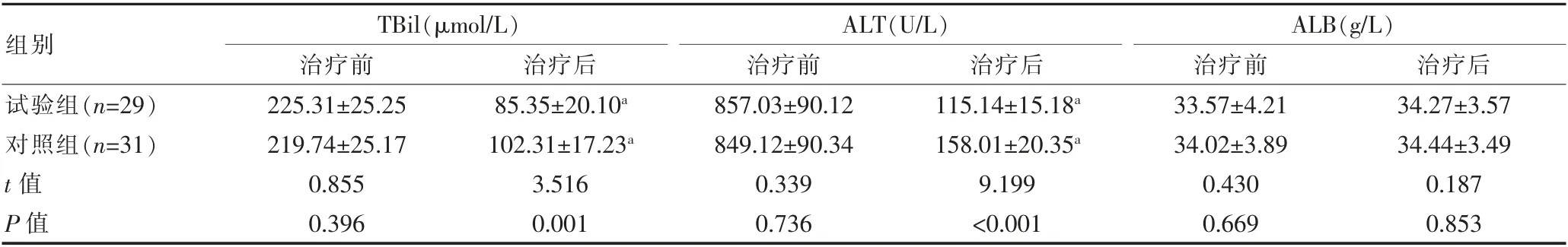
表2 两组患者治疗前后肝功能指标的比较(±s)
注 与本组治疗前比较,aP<0.05;TBil:总胆红素;ALT:谷丙转氨酶;ALB:白蛋白
组别TBil(μmol/L)治疗前治疗后ALT(U/L)治疗前治疗后ALB(g/L)治疗前治疗后试验组(n=29)对照组(n=31)t 值P 值225.31±25.25 219.74±25.17 0.855 0.396 85.35±20.10a 102.31±17.23a 3.516 0.001 857.03±90.12 849.12±90.34 0.339 0.736 115.14±15.18a 158.01±20.35a 9.199<0.001 33.57±4.21 34.02±3.89 0.430 0.669 34.27±3.57 34.44±3.49 0.187 0.853
2.3 两组患者治疗前后凝血功能指标的比较
两组治疗前的凝血功能指标比较,差异无统计学意义(P>0.05);两组治疗后的PT、APTT 短于治疗前,PTA 高于治疗前,FIB 低于治疗前,差异均有统计学意义(P<0.05);试验组治疗后的PT、APTT 短于对照组,FIB 低于对照组,PTA 高于对照组,差异均有统计学意义(P<0.05)(表3)。
表3 两组患者治疗前后凝血功能指标的比较(±s)
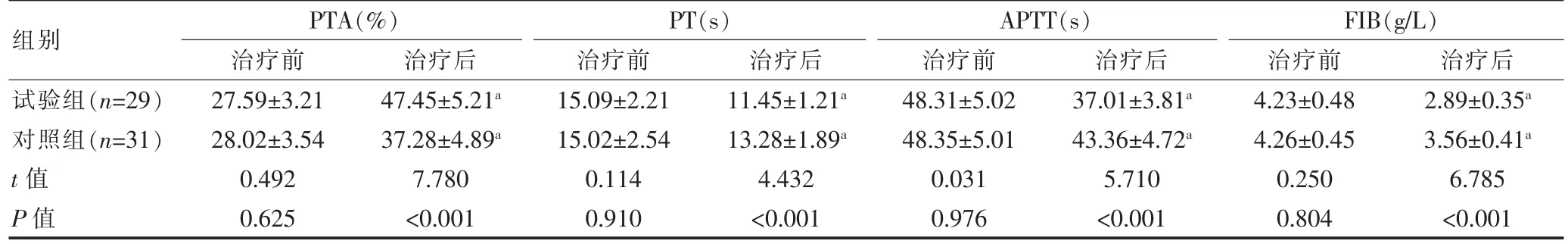
表3 两组患者治疗前后凝血功能指标的比较(±s)
注 与本组治疗前比较,aP<0.05;PTA:凝血酶原活动度;PT:凝血酶原时间;APTT:活化部分凝血活酶时间;FIB:纤维蛋白原
组别PTA(%)治疗前治疗后PT(s)治疗前治疗后APTT(s)治疗前治疗后FIB(g/L)治疗前治疗后试验组(n=29)对照组(n=31)t 值P 值27.59±3.21 28.02±3.54 0.492 0.625 47.45±5.21a 37.28±4.89a 7.780<0.001 15.09±2.21 15.02±2.54 0.114 0.910 11.45±1.21a 13.28±1.89a 4.432<0.001 48.31±5.02 48.35±5.01 0.031 0.976 37.01±3.81a 43.36±4.72a 5.710<0.001 4.23±0.48 4.26±0.45 0.250 0.804 2.89±0.35a 3.56±0.41a 6.785<0.001
2.4 两组患者不良反应发生情况的比较
试验组患者治疗1 周时出现3 例失眠,对症治疗后恢复正常,2 例患者治疗期间出现皮疹,停止注射GC 后恢复正常,不良反应总发生率为17.24%(5/29);对照组患者治疗1 周时出现2 例失眠,对症治疗后恢复正常,不良反应总发生率为6.45%(2/31)。两组的不良反应总发生率比较,差异无统计学意义(P>0.05)。
3 讨论
重型肝炎的发病是由于人体免疫反应激发的细胞因子风暴,使人体处于内毒素血症的环境,进而导致肝细胞坏死,使肝脏的新成代谢功能发生障碍,导致人体内毒性物质异常增多,而体内的有毒物质继续通过各种途径损害肝脏,形成恶性循环[7-8]。GC 联合核苷类似物等抗病毒药物能够有效缓解重型肝炎后的肝功能异常,对于部分重症化患者,可降低病情进展速度,提高患者生存率[9],本研究结果显示,重型肝炎前期及早期,经过治疗后,重型肝炎患者病情均有好转,本次研究结果与上述研究[7-9]结论基本一致。
有关研究表明[10],对重型肝炎患者在一般治疗基础上加用GC 可有效阻断肝细胞的进一步破坏。本研究中两组患者治疗后与治疗前血清TBil、ALT 改变情况比较,血清TBil、ALT 降低;治疗后,试验组血清TBil、ALT 水平低于对照组(P<0.05)。相关研究报道[11],应用GC 联合恩替卡韦治疗早期及前期乙型肝炎肝衰竭,可有效改善患者肝功能。本次实验结果与上述结论基本一致,表明GC 与核苷类似物联合使用能够有效阻止重型肝炎患者肝功能恶化。有研究报道,肝功能受损患者体内多伴随出现凝血功能异常[12]。PT、APTT 指标能够有效检测患者的凝血功能,FIB 指标能够检测患者的纤溶活性水平,能够有效甄别患者是否处于高凝状态[13];相关研究表明[14],PTA 与重型肝炎严重程度呈负相关。本研究结果显示,治疗前两组患者PT、FIB、APTT 指标高于正常值,与上述结论基本一致。治疗后与治疗前PT、APTT、FIB、PTA 指标情况比较,PT、FIB、APTT 降低、PTA 增高;治疗后,试验组PT、FIB、APTT 低于对照组、PTA 高于对照组(P<0.05)。已有研究报道[15],GC 可调节急性肺损伤的凝血功能,结合本次研究结果,进一步说明GC 与核苷类似物联合使用能够有效改善重型肝炎患者因肝损伤导致的凝血功能障碍。
综上所述,治疗前期及早期重型肝炎患者在应用短期GC 联合核苷类似物的治疗,能有效改善肝脏功能,减轻凝血功能障碍,且安全性良好,值得临床进一步推广。
